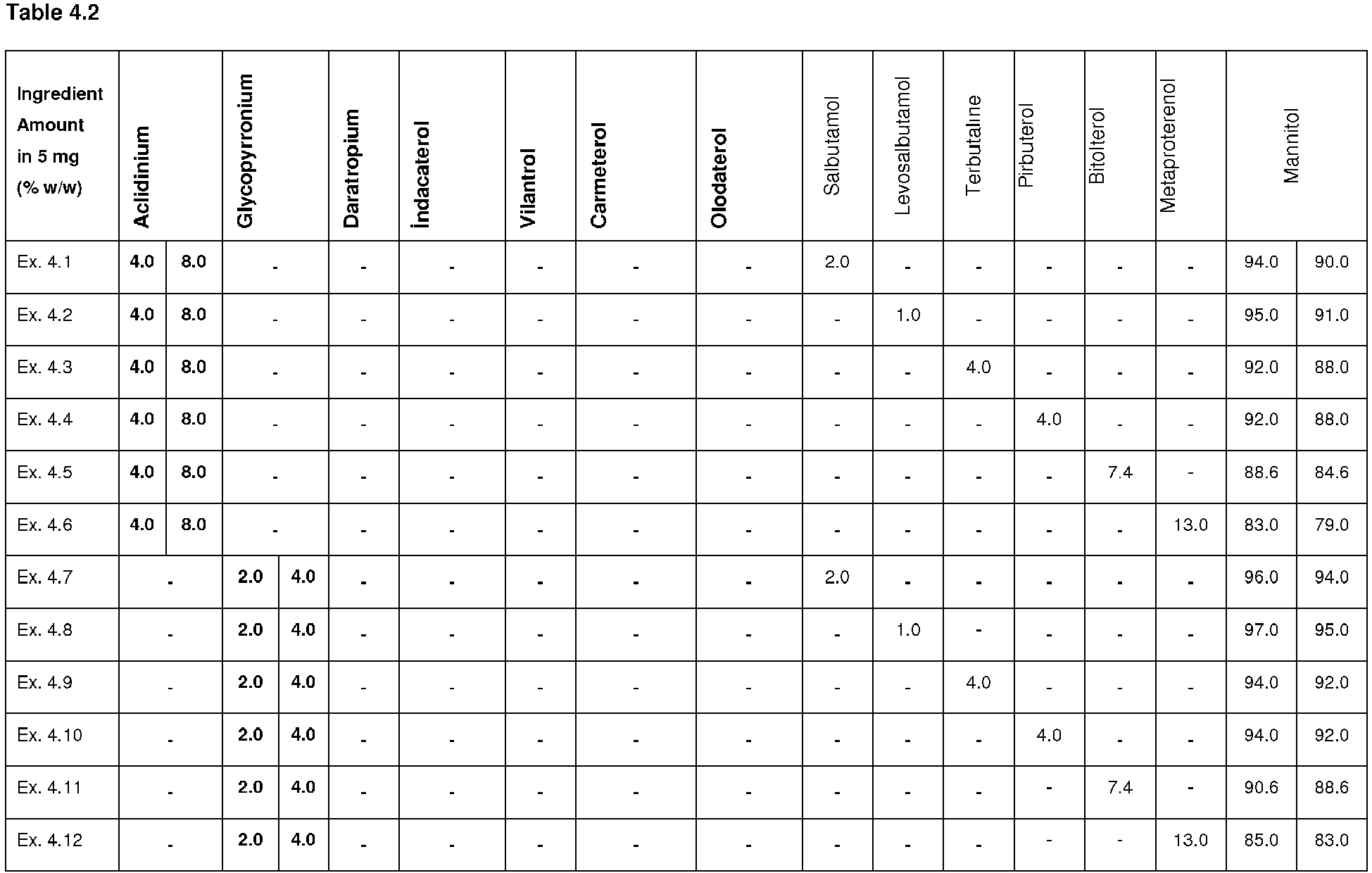
Таблица совместимости металлов
| Металлы, в отноше- нии которых представ- лены данные в таблице по подвержен- ности их коррозии |
Соот-ноше-ние пло-щади метал-ла к дру-гим метал-лам табли-цы |
Маг-ний |
Цинк | Алю-ми-ний | Кад- мий |
Угле-ро-дис-тая сталь | Низ-ко- леги-ро-ван-ная сталь |
Ли-тей- ная сталь |
Хро-ми- ро-ван- ная сталь |
Сви-нец | Оло-во | Медь | Нер-жа- вею-щая сталь |
| Магний | Низкое | С | С | С | С | С | С | С | С | С | С | С | |
| Высокое | У | У | С | С | С | С | С | С | С | ||||
| Цинк | Низкое | У | У | У | С | С | С | С | С | С | С | С | |
| Высокое | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ||
| Алюминий | Низкое | У | Н | Н | У | С | С | С | С | ||||
| Высокое | Н | У | Н | Н | Н | У | У | С | С | С | У | ||
| Кадмий | Низкое | Н | Н | Н | С | С | С | С | С | С | С | С | |
| Высокое | У | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ||
| Углеродистая сталь |
Низкое | Н | Н | Н | Н | У | С | С | С | С | С | С | |
| Высокое | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | |||
| Низколеги- рованная сталь |
Низкое | Н | Н | Н | Н | Н | Н | С | С | С | С | С | |
| Высокое | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ||
| Литейная сталь |
Низкое | Н | Н | Н | Н | Н | У | С | С | С | С | С | |
| Высокое | Н | Н | Н | Н | Н | Н | Н | Н | Н | ||||
| Хромирован ная сталь |
Низкое | Н | Н | Н | Н | Н | Н | Н | У | У | С | С | |
| Высокое | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | |||
| Свинец | Низкое | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ||
| Высокое | Н | Н | Н | Н | Н | Н | У | Н | Н | Н | |||
| Олово | Низкое | Н | Н | Н | Н | Н | Н | Н | Н | ||||
| Высокое | Н | Н | Н | Н | Н | Н | Н | У | Н | ||||
| Медь | Низкое | Н | Н | Н | Н | Н | Н | У | У | С | |||
| Высокое | Н | Н | Н | Н | Н | Н | Н | Н | У | Н | |||
| Нержавеющая сталь |
Низкое | Н | Н | Н | Н | Н | Н | Н | Н | ||||
| Высокое | Н | Н | Н | Н | Н | Н | Н | У | У | У | Н |
В 1 столбце таблицы представлены металлы, которые подвергаются или не подвергаются коррозии с металлами указанными в остальных столбцах таблицы и пропорция соотношения площадей металла, указанного в 1 столбце, к металлам в остальных столбцах таблицы.
Краткое обозначение С, У, Н в таблице означает:
- С – сильная и быстрая коррозия металла;
- У – умеренная коррозия металла;
- Н – Несущественная или ничтожная коррозия металла
Допустимые и недопустимые контакты металлов. Популярные метрические и дюймовые резьбы
Электронику часто называют наукой о контактах. Многие знают, что нельзя скручивать между собой медный и алюминиевый провода. Медная шина заземления или латунная стойка для платы плохо сочетаются с оцинкованными винтиками, купленными в ближайшем строительном супермаркете. Почему? Коррозия может уничтожить электрический контакт, и прибор перестанет работать. Если это защитное заземление корпуса, то прибор продолжит работу, но будет небезопасен. Голая алюминиевая деталь вообще может постепенно превратиться в прах, если к ней приложить даже низковольтное напряжение.Доступные нам металлы не ограничиваются только медью и алюминием, существуют различные стали, олово, цинк, никель, хром, а также их сплавы. И далеко не все они сочетаются между собой даже в комнатных условиях, не говоря уже о жёстких атмосферных или морской воде.
И далеко не все они сочетаются между собой даже в комнатных условиях, не говоря уже о жёстких атмосферных или морской воде.
В советских ГОСТах было написано почти всё о допустимых контактах металлов, но если изучение чёрно-белых таблиц из 1000 ячеек мелким шрифтом утомляет, то правильный ответ на «медный» вопрос — нержавейка, либо никелированная сталь, из которой, кстати, и сделан почти весь «компьютерный» крепёж. В эпоху чёрно-белого телевидения были другие понятия об удобстве интерфейса, поэтому для уважаемых читателей (и для себя заодно) автор приготовил цветную шпаргалку.
И, раз уж зашла речь о металлообработке, заодно автор привёл таблицу с популярными в электронике резьбами и соответствующими свёрлами, отобрав из объёмных источников наиболее релевантное по тематике портала. Не все же здесь слесари и металлурги, экономьте своё время.
Преамбула
Да, в век 3D-печати популярность напильника с лобзиком несколько потускнела. Но клетка Фарадея для РЭА по-прежнему является преимуществом, не забываем и про защитное заземление.
 Да, для печати корпусов РЭА уже доступен электропроводный (conductive) ABS-пластик, но судя по источнику, его удельное сопротивление примерно в миллион раз больше меди. Дескать, пыль уже не липнет, но для заземления всё равно многовато. Напечатать же стальные детали корпуса ПК в домашних условиях пока никак невозможно, да мы и алюминий-то с оловом никак не освоим…
Да, для печати корпусов РЭА уже доступен электропроводный (conductive) ABS-пластик, но судя по источнику, его удельное сопротивление примерно в миллион раз больше меди. Дескать, пыль уже не липнет, но для заземления всё равно многовато. Напечатать же стальные детали корпуса ПК в домашних условиях пока никак невозможно, да мы и алюминий-то с оловом никак не освоим…Что же делать? Нашему брату приходится действовать методом Микеланджело, используя для творчества вместо каменной глыбы купленные в DIY-магазине заготовки, либо вообще старые корпуса ПК. Работая как-то с корпусом от старого сервера IBM из шикарной миллиметровой стали, автор впал в ступор, потому что имеющаяся резьба была крупнее М3, но мельче #6-32 (позже выяснилось, что это М3,5). Зачем вообще понадобилось в 2003-м году использовать метизы М3,5, останется загадкой, но о существовании дробной метрической резьбы автор даже не подозревал.
UPD
Для моддеров, кстати, рынок предлагает новые, удобные инструменты арсенала домашней мастерской, и про один из них (осциллорез) я рассказываю в отдельной публикации.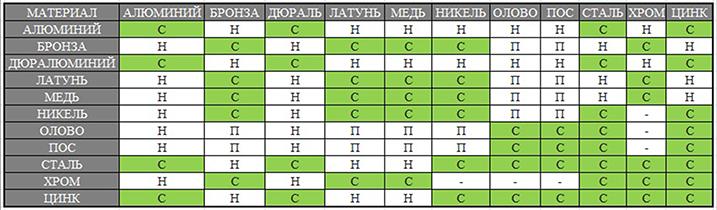 Арсенал принадлежностей прекрасно дополнит более привычные циркулярные мини-пилы (aka «дремели»), а отсутствие эффекта «запрессовки зубьев» упростит обработку вязких металлов типа меди и алюминия. Инструмент лёгкий, не такой неуклюжий и опасный, как «болгарка». Можно пилить металл практически на уровне носа и без риска получить рубящий удар от заклинившего или осколок от «взорвавшегося» диска. А так бывает в красочно описанных уважаемыми читателями случаях с УШМ: 300-граммовый блин «болгарки» делает 200 оборотов в секунду, потребляя до 2кВт электричества, и требует чуть ли не костюм сапёра. Работающий же осциллорез травматологи упирают себе пильной стороной прямо в ладонь, чтобы успокоить пришедшего на снятие гипсовой повязки пациента… Впрочем, вернёмся к нашим металлам.
Арсенал принадлежностей прекрасно дополнит более привычные циркулярные мини-пилы (aka «дремели»), а отсутствие эффекта «запрессовки зубьев» упростит обработку вязких металлов типа меди и алюминия. Инструмент лёгкий, не такой неуклюжий и опасный, как «болгарка». Можно пилить металл практически на уровне носа и без риска получить рубящий удар от заклинившего или осколок от «взорвавшегося» диска. А так бывает в красочно описанных уважаемыми читателями случаях с УШМ: 300-граммовый блин «болгарки» делает 200 оборотов в секунду, потребляя до 2кВт электричества, и требует чуть ли не костюм сапёра. Работающий же осциллорез травматологи упирают себе пильной стороной прямо в ладонь, чтобы успокоить пришедшего на снятие гипсовой повязки пациента… Впрочем, вернёмся к нашим металлам.
Допустимые и недопустимые контакты металлов по ГОСТ 9.005-72
DISCLAIMER: Предоставляется «как есть». Если уважаемый читатель занимается моделизмом, автомобилизмом или робототехникой, в ГОСТе также приведены: Таблица №2 для жестких и очень жестких атмосферных условий, Таблица №3 для контактов, находящихся в морской воде.
 Ниже я предлагаю выдержку из Таблицы №1 для средних атмосферных (т.е. комнатных) условий. Буква «А» означает «ограниченно допустимый в атмосферных условиях», подробности в самом ГОСТе.
Ниже я предлагаю выдержку из Таблицы №1 для средних атмосферных (т.е. комнатных) условий. Буква «А» означает «ограниченно допустимый в атмосферных условиях», подробности в самом ГОСТе.Кликабельно (спасибо, НЛО):
UPD:
Ещё цветные шпаргалки (благодарю greatvovan):
для средних атмосферных условий
для жестких и очень жестких атмосферных условий
Пара слов о металлах
Металлурги, поправляйте, если что не так. Коррозия очень объёмная и сложная тема, и я не претендую на полноту её освещения. Я лишь даю выборочные зарисовки, чтобы сформировать у читателя нужные ассоциативные ряды.Оцинковка
Оцинкованная сталь — основная рабочая лошадка народного хозяйства. В виде различных метизов «оцинковка» встречается в магазинах стройматериалов гораздо больше, чем, например, «премиумная» нержавейка. Фабричные корпуса ПК, технологические ящички и шкафчики для оборудования чаще всего выполнены из оцинкованной холоднокатанной стали толщиной порядка 1мм (чем дешевле корпус, тем тоньше лист).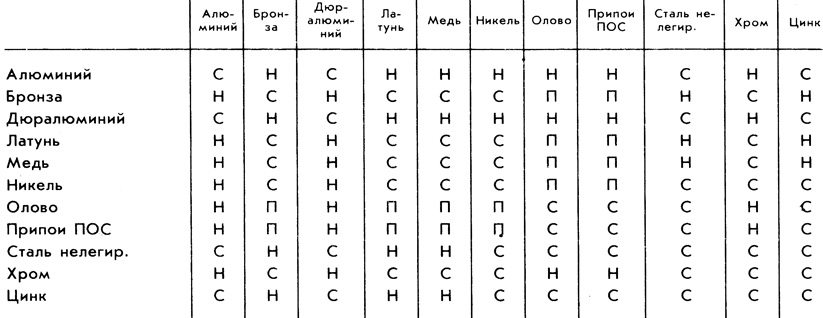
АлюминийАлюминий и его сплавы бывают анодированные (с защитным слоем) и обычные (неанодированные). Алюминий легко обрабатывать в домашних условиях, но помните о коррозии. Не используйте голый алюминий в качестве проводника даже с низковольтным напряжением, иначе ток медленно обратит деталь в прах.
 Обработанным в мастерской алюминиевым и дюралюминиевым деталям показана полная эквипотенциальность (наведённые полями токи вроде бы по фиг, заземлять тоже можно). Алюминий совместим с цинковым покрытием, но для контакта с медью, «голой» или никелированной сталью требуется оловянная «прокладка». Ограниченно допустим контакт алюминия с нержавейкой в атмосферных условиях. Для простоты можно принять, что при контакте с другими металлами и покрытиями алюминий будет корродировать сам по себе, без помощи внешнего электричества.
Обработанным в мастерской алюминиевым и дюралюминиевым деталям показана полная эквипотенциальность (наведённые полями токи вроде бы по фиг, заземлять тоже можно). Алюминий совместим с цинковым покрытием, но для контакта с медью, «голой» или никелированной сталью требуется оловянная «прокладка». Ограниченно допустим контакт алюминия с нержавейкой в атмосферных условиях. Для простоты можно принять, что при контакте с другими металлами и покрытиями алюминий будет корродировать сам по себе, без помощи внешнего электричества.Витая пара из омедненного алюминия (Copper Clad/Coated Aluminium, CCA) — это отдельная история, в домашних условиях кабель всё равно не производится.
Медь
Медь мягкая и довольно неаппетитно окисляется на воздухе, поэтому изделия из меди заключают в герметичную оболочку или лакируют. Латунные бляхи солдатских ремней и стойки для электронных печатных плат лучше сопротивляются окислению и выглядят аппетитнее позеленевшей меди, особенно если их периодически полировать (я про бляхи, конечно). При этом ни медь, ни её сплав с цинком (латунь) «не дружат» с чистым цинком и его покрытиями. Зато медь совмещается с хромом, никелем и нержавейкой. А если вы держите в руках какую-нибудь клемму, то она наверняка из лужёной (покрытой оловом) меди.
При этом ни медь, ни её сплав с цинком (латунь) «не дружат» с чистым цинком и его покрытиями. Зато медь совмещается с хромом, никелем и нержавейкой. А если вы держите в руках какую-нибудь клемму, то она наверняка из лужёной (покрытой оловом) меди.
Олово
Олово мягкое, но зато стойкое к коррозии (в комнатных условиях) и электрически совместимое почти со всеми, кроме чугуна, низколегированных и углеродистых сталей, магния. Не стоит паять оловом и бериллий, будьте внимательны при сборке домашнего ядерного реактора. Олово используют, чтобы из недопустимого электрического контакта получить допустимый, т.е. в качестве «прокладки». Клеммы из лужёной меди — отличный пример.
UPD:
На холод изделие выносить нельзя, а при минусовых температурах лучше не эксплуатировать вообще.
Никель
Никелем покрыты блестящие «компьютерные» винтики. Такое покрытие совместимо с медью и бронзой, латунью, оловом, хромом и нержавеющей сталью. Никель несовместим с цинком и алюминием (для алюминия лучше контакт с нержавеющей сталью, см.![]() ниже).
ниже).
Нержавейка
Нержавеющая сталь — королева металлов сталей: прочная, пластичная, стойкая к коррозии, электропроводная, круто выглядит. Слишком тугая, чтобы резать и гнуть её дома в промышленных масштабах. Хромистые и хромисто-никелевые нержавейки электрически плохо совместимы с цинком и «голой» сталью, зато дают надёжный контакт с медью без помощи олова. Алюминий, а также азотированная, оксидированная и фосфатированная низколегированная сталь ограниченно совместимы при стандартных атмосферных условиях. Нержавейка марки А2 не «магнитится», но существуют и нержавеющие стали с магнитными свойствами. Магнитные свойства не влияют на коррозионную стойкость нержавеющей стали.
Пара слов про case modding
Если вы занимались сборкой ПК, то наверняка знаете, что болтики для монтажа приводов CD/DVD, «ноутбучных» дисков 2.5″ и флоппи-дисководов (ха-ха) используют метрическую резьбу M3. В корпусах ПК и жёстких дисках 3.5″ используется более грубая дюймовая резьба #6-32 UNC.
 Почему? Мягкий металл любит более грубую резьбу, к тому же адепты дюймовой системы пока лидируют на рынке технологий. Стойка 19″ использует (вы не поверите) дюймы в качестве основной меры, однако для монтажа оборудования я встречал только оцинкованные клетевые шайбы и винты с метрической резьбой М6. Дюймово-метрический дуализм в технологиях…
Почему? Мягкий металл любит более грубую резьбу, к тому же адепты дюймовой системы пока лидируют на рынке технологий. Стойка 19″ использует (вы не поверите) дюймы в качестве основной меры, однако для монтажа оборудования я встречал только оцинкованные клетевые шайбы и винты с метрической резьбой М6. Дюймово-метрический дуализм в технологиях…Обустройство своей инженерной кухни я начал с того, что купил защитные очки, набор качественных свёрл по металлу, небольшой вороток и метчики на резьбы M3 и #6-32 UNC, а заодно M4 и M6. Плашки не понадобились.
Популярые виды резьбы, используемой в компьютерной технике
ГОСТ 19257-73 рекомендует использовать следующие диаметры свёрл для металлов. Наверное, стоит учитывать и количество метчиков в наборе: чем твёрже материал, тем больше необходимость в «предварительных» метчиках. У меня их по три штуки, два «грубых» и один «финишный». А как правильно, кстати?
UPD
А как правильно — читайте комментарии, на публикацию-таки зашли мастера слесарного дела, только я не успел отсортировать всю информацию. Пользователь golf2109 любезно принёс сюда прямо из мастерской два правых столбца таблицы для обозначения того, как мягкость (вязкость) металла влияет на диаметр отверстия под резьбу, благодарю за поддержку.
Пользователь golf2109 любезно принёс сюда прямо из мастерской два правых столбца таблицы для обозначения того, как мягкость (вязкость) металла влияет на диаметр отверстия под резьбу, благодарю за поддержку.
| Диаметр резьбы | Стандартный шаг, мм | Диаметр сверла, мм | ||
| ГОСТ | Fe | Al | ||
| M2 | 0.4 | 1,6 | 1.5* (-0.1) | |
| M2,5 | 0.45 | 2.0 | 1.8* (-0.2) | |
| M3 | 0.5 | 2.5 | 2.3 (-0.2) | |
| M3.5 | 0.6 | 2.9 | 2.7* (-0.2) | |
| M4 | 0.7 | 3.3 | 3.2 | 3.0 (-0.3) |
| M5 | 0.8 | 4.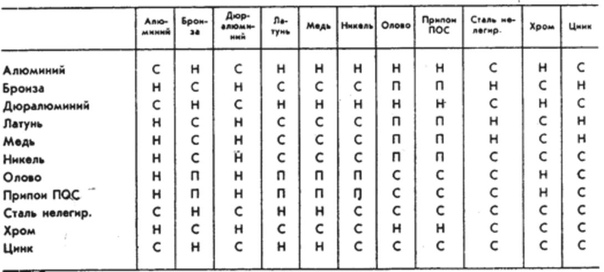 2 2 |
3.9 (-0.3) | |
| M6 | 1.0 | 5.0 | 4.9 | 4.6 (-0.4) |
| M8 | 1.25 | 6.8 | 6.7 | 6.3 (-0.5) |
| M10 | 1.5 | 8.5 | 8.0 (-0.5) | |
| #6-32 UNC | 0.794 | 2.85 | 2.7* | 2.5* (-0.35) |
* Я рискнул прикинуть калибры двух дополнительных свёрл для стали и алюминия там, где по ним у меня нет данных в источниках. Обратите внимание, резьба #6-32 UNC по наружному диаметру находится между M3 и M4, а по шагу резьбы вообще ближе к M5.
UPD
Если сверлите что-то толще миллиметрового листа, читайте спойлер про СОЖ.
Довольно большое значение и при сверлении, и при нарезании резьб имеет смазка и охлаждение обрабатываемых деталей и инструмента.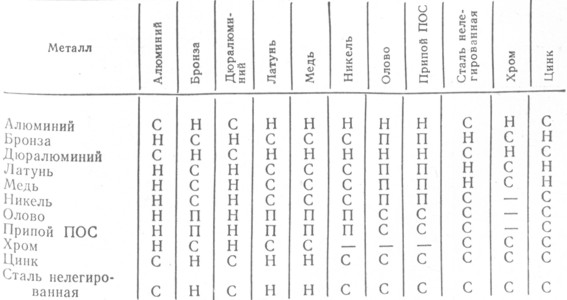 Настоятельно рекомендую при подаче сверла не спешить и пользоваться техническими жидкостями. Режущая кромка сверла легко перегревается от сухой детали, и получается металлический отпуск. Поверьте, такой отпуск не нужен: он вызывает необратимые изменения в структуре металла и деградацию его прочностных свойств (сверло тупится гораздо быстрее, чем должно). Что делать? Вот несколько советов, которые автор встречал в разных местах.
Настоятельно рекомендую при подаче сверла не спешить и пользоваться техническими жидкостями. Режущая кромка сверла легко перегревается от сухой детали, и получается металлический отпуск. Поверьте, такой отпуск не нужен: он вызывает необратимые изменения в структуре металла и деградацию его прочностных свойств (сверло тупится гораздо быстрее, чем должно). Что делать? Вот несколько советов, которые автор встречал в разных местах.
Не сверлите большим сверлом сразу, разбейте операции примерно по 3мм: т.е. отверстие 10мм сперва проходим 3мм, потом 6мм.
Хорошенько отметьте отверстие керном. Одолжите у ребёнка пластилин, сделайте бортик вокруг планируемого отверстия так, чтобы получился мини-бассейн размером с монету. Если под рукой нет *вообще ничего*, хорошенько смешайте ложку подсолнечного масла с ложкой жидкого мыла и налейте в этот мини-бассейн, хуже не будет. Но если нужно просверлить насквозь, скажем, гирю 16кг, погуглите книгу народных рецептов «сож своими руками». Желаю всем начинающим удачной пенетрации: как говорится, берегите ваши свёрла-метчики смолоду, ведь их ждут новые идеи и интересные изобретения!
Желаю всем начинающим удачной пенетрации: как говорится, берегите ваши свёрла-метчики смолоду, ведь их ждут новые идеи и интересные изобретения!
На известной китайской площадке можно приобрести «пальцевые» винтики (thumb screw), причём и на #6-32, и на M3. Материал и цвет разный.
Источники
» ГОСТ 9.005-72. Единая система защиты от коррозии и старения. Машины, приборы и другие технические изделия. Допустимые и недопустимые контакты металлов. Общие требования.
» ГОСТ 19257-73. Отверстия под нарезание метрической резьбы. Диаметры.
» Unified Coarse Thread ANSI B1.1 (резьбы UNC ANSI B1.1).
Как совместить несовместимое (о коррозии металлов)
Автор: admin-hm · Опубликовано · Обновлено
Разнородные металлы при их непосредственном контакте «выносят» друг друга далеко не всегда. Нередко они образуют довольно сильную гальваническую пару, что приводит к коррозии одного из контактирующих металлов, а иногда и к «схватыванию» этого соединения, делая невозможной его последующую разборку для ремонта.
На память приходит случай из собственной практики, когда я, еще будучи молодым инженером, работал на автогиганте. Мы доводили новую систему автомобиля — экономайзер с электронным управлением. И столкнулись с тем, что после некоторого пробега машины входящие в систему электромагнитные клапаны, покрытые никелем, наотрез отказывались выворачиваться из своих гнезд. А снимать клапаны приходилось довольно часто — для проверки. Если же их вывинчивали «насильно», они выходили «с мясом» — вся резьба клапанов была сплошняком покрыта алюминием, выдранным из смесительной камеры карбюратора.
Чтобы избежать подобной неприятности, резьбу смазывали, в том числе и графитовой смазкой, но ничто не помогало. Попробовали было заменить никелевое покрытие клапанов на кадмиевое, но тогда клапаны засели и вовсе «намертво». Чтобы их вывернуть, обычного полуметрового динамометрического ключа (до 10 кгс) уже не хватало — пришлось орудовать ломом. Правда, покрытая кадмием резьба теперь выходила из камеры без привычной алюминиевой корки. Дефект устранялся, если на резьбу наносили слой цинка. Но цинк нас тоже не устраивал. Покрытие из него нестойкое, оно быстро истиралось и вода, всегда содержащаяся в бензине, вызывала ржавление клапанов, которые просто переставали действовать.
Дефект устранялся, если на резьбу наносили слой цинка. Но цинк нас тоже не устраивал. Покрытие из него нестойкое, оно быстро истиралось и вода, всегда содержащаяся в бензине, вызывала ржавление клапанов, которые просто переставали действовать.
Лишь применив комбинированное покрытие «хром по никелю», мы навсегда избавились от этого дефекта. (Никель по-прежнему был нужен, поскольку хром не хотел ложиться на металл клапана.)
Обратившись уже после к таблице совместимости металлов (она тогда была почему-то секретной!), мы убедились, что наш чисто эмпирический выбор был сделан правильно. Жаль только, что из-за элементарной неразберихи так много времени было тогда убито впустую. Вот если бы эта «секретная» табличка была бы у нас тогда под рукой…
На таблице 1 эти «секретные» данные представлены в сокращенном виде. Из нее видно, что алюминий вполне может контактировать с цинком и хромом (знак +). А вот контакт с никелем ему противопоказан (знак -). Графу с кадмием я не привожу потому, что кадмирование сейчас почти повсеместно отменено из-за канцерогенности этого процесса.
Таблица 1. Гальваническая совместимость металлов
Анализ таблицы 1 показывает, что медь и ее сплавы (латуни и бронзы), алюминий и его сплавы (дюрали), а также олово и его сплавы (припои ПОС) ведут себя синхронно. Значит, эту таблицу можно упростить (см. таблицу 2).
Таблица 2. Упрощенный вид таблицы 1
Это упрощение облегчает пользование таблицей. Но все равно это не решает проблемы в полной мере. Ведь запоминать наизусть, словно «долбицу умножения», столь громоздкую таблицу (состоящую из 49 клеток) вряд ли кто будет. А каждый раз разыскивать таблицу, прежде чем приладить одну деталь к другой, никакой любитель мастерить тоже не будет. Как же быть?
Попробуем переложить таблицу 2 на ряд формальных (мнемонических) фраз, а именно:
1. Сталь (нелигированная!) не любит медь.
2. Алюминий не любит медь и никель, а с оловом его нужно обязательно паять (буква П).
3. Медь не любит сталь, алюминий и цинк, а с оловом ее нужно паять.
4. Хром любит всех, а с оловом нуждается в пайке.
5. Никель не любит алюминий, а с оловом его нужно паять.
6. Цинк не любит медь.
7. Олово любит сталь и цинк, а с остальными — пайку.
Можно заметить, что 6-е высказывание лишнее. Ведь в 3-м высказывании уже содержится «нелюбовь» меди к цинку, а односторонней любви среди металлов не может быть (во всяком случае, мы будем так условно считать). Значит, 3-е высказывание отбрасывать уже нельзя. Затем, 1-е высказывание оказывается лишним: «нелюбовь» стали и меди следует из 3-го высказывания. Далее, 7-е высказывание тоже, видимо, требуется сохранить. Тогда 4-е высказывание будет лишним — слова «с оловом нуждается в пайке» косвенным образом содержатся в 7-м высказывании. Потом, 2-е высказывание тоже требует сохранения, вот только слова «а с оловом его нужно паять» лишние (это и так ясно из 7-го высказывания). Наконец, в 3-м высказывании слово «алюминий» лишнее: «нелюбовь» меди и алюминия уже содержатся во 2-м высказывании. Дальше минимизировать нам уже нечего.
Дальше минимизировать нам уже нечего.
Таким образом, после ряда упрощений мы получили уже не семь, а всего лишь три высказывания:
1. Алюминий не любит никель и медь.
2. Медь не любит сталь и цинк.
3. Олово любит сталь и цинк, с остальными — пайку.
Как стихотворение, эти простые фразы запомнит едва ли не каждый. Они помогут вам правильно ориентироваться при работе с металлом, даже не имея под рукой никакой таблицы.
2-я фраза наиболее показательна: смоченная обычной водой медь беспощадно разрушает сталь и цинк. Помирить их сможет, например, облуживание «агрессивной» меди (полуда не страшна ни стали, ни цинку). «Агрессия» меди распространяется и на алюминий. Спасти последний может лужение меди, а также ее цинкование и хромирование, но не никелирование. Хотя облудить разрешается и алюминий, благо рецептов этой операции сейчас существует уже немало. Спасет лужение алюминий и от «агрессии» со стороны никеля. Следовательно, все конфликты, содержащиеся в 1-й и 2-й фразах, мы разрешили. Ну а к 3-й фразе комментарии, как говорится, излишни.
Ну а к 3-й фразе комментарии, как говорится, излишни.
Откуда известно, какой металл пострадает в нежелательной (или, наоборот, нужной нам) гальванической паре? А из ряда активности металлов. Воспроизведем его частично: Аl, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, Cu. Этот ряд показывает, что алюминий (AI) тут наименее активный металл, то есть самый слабый, а медь (Си), наоборот, наиболее активный металл, то есть она самая сильная. Поэтому в паре, скажем, железо (Fe) и медь (Cu) безусловным победителем окажется медь, то есть разрушаться будет только железо.
Поэтому непременно нужно сказать, что все плюсы и минусы, указанные в таблицах, весьма условны. Любые два разнородных металла образуют гальваническую пару. Только в одних случаях она «сильная», а в других «слабая». К примеру, таблица говорит о допустимости контакта олова (полуды) и стали. Однако попробуйте закопать в землю вскрытую консервную банку. Вскоре от нее останется одна ржавчина с остатками полуды. Влага, а главное соли, приведут к тому, что когда-то защитный слой полуды теперь неизбежно разрушит жесть. Вот если бы контакт полуды и жести не был бы открыт (то есть банка была бы цела), этого бы не произошло.
Вот если бы контакт полуды и жести не был бы открыт (то есть банка была бы цела), этого бы не произошло.
То же самое можно сказать и контакте стали и цинка. Таблица нам рекомендует эту пару. Но вот если это соединение поливать соленой водой, цинк (Zn) будет непременно разрушаться. Именно на этом как раз и обоснована весьма популярная сейчас анодная защита кузова легкового автомобиля.
Цинковую пластинку надежно прикрепляют к кузову (с небольшим зазором, но без электрического контакта с кузовом). Контакт же пластинки с кузовом производится отдельным проводом, идущим от пластинки (провод крепят к кузову на некотором удалении от пластинки).
Когда всегда имеющаяся на асфальте в сырую погоду соленая вода начнет поливать кузов и цинковую пластинку, в зазоре образуется электролит: пара «кузов-пластинка» превратится в элементарную батарейку. При этом ток от этой батарейки начнет течь через упомянутый провод и кузов машины. Цинк, как более «слабый» в гальванопаре «цинк-железо», начнет разрушаться, предохраняя стальной кузов от коррозии. Установите у себя на автомобиле десяток таких пластин — ржавление кузова прекратится.
Установите у себя на автомобиле десяток таких пластин — ржавление кузова прекратится.
Чтобы защитить от коррозии стальную ограду (например, на кладбищенской могиле), достаточно в землю вкопать четыре-пять цинковых пластин, соединив с ними проводом верх ограды. «Батарейкой» (вернее, гальваническим элементом) тут будет сама влажная земля. Такая анодная защита мало чем отличается от автомобильной.
Выходит, «все врут календари», то бишь таблицы. Нет, не врут. Просто они ориентируют нас на обычные условия эксплуатации соединений, когда явной сырости, а тем более соли, нет. Да и в их присутствии урон будет минимальным. Поэтому не поленитесь запомнить найденные нами три предложения. Они помогут вам выполнять свои самоделки грамотно.
отсюда
Понравилось это:
Нравится Загрузка…
Похожее
Влияние легирующих элементов на свойства бронз
Медь, бронзу или латунь можно купить
в ООО ВПО ПромМеталл http://bronza555. ru/
ru/
[email protected] +7-903-798-09-70 (звоните!)
Складскую справку можно скачать здесь
Цветной металлопрокат со склада в Москве.
Консультации по применению! Подбор материала!
Резка. Продажа от 1 кг.
Отправка по России ТК Деловые линии.
Алюминий в бронзах улучшает механические, антикоррозионные и антифрикционные свойства, придает высокую жидкотекучесть, концентрированную усадку и хорошую герметичность. При содержании алюминия до 7% бронза плохо обрабатывается резанием.
Железо оказывает модифицирующее действие на структуру алюминиевых бронз, немного повышает их прочность, твердость и антифрикционные свойства, уменьшает склонность к охрупчиванию двухфазных бронз, понижает коррозионную стойкость и горячеломкость, ухудшает обработку резанием.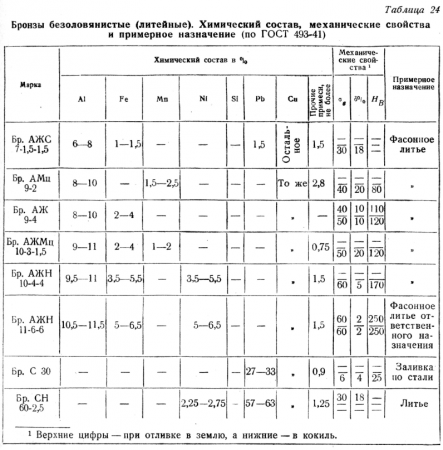 Железо не влияет существенно на механические свойства, но измельчает структуру сплава в отливках.
Железо не влияет существенно на механические свойства, но измельчает структуру сплава в отливках.
Олово. Основной легирующий компонент оказывает существенное влияние на весь спектр свойств оловянных бронз. Литейные свойства сплавов зависят от содержания олова: с увеличением содержания олова до 10… 12% увеличивается температурный интервал кристаллизации сплавов, снижается их жидкотекучесть. В то же время олово снижает линейную усадку, уменьшает газонасыщенность расплава. Олово повышает коррозионную стойкость, твердость и прочность сплава, снижает относительное удлинение и ударную вязкость. Легирование меди оловом придает сплаву «бронзовый» оттенок. Олово достаточно дорогой металл.
Никель улучшает технологические и механические свойства алюминиево — железных бронз, в том числе и при повышенных температурах. В оловянистых — никель повышает прочностные свойства, улучшает пластичность и деформируемость бронз, повышает их коррозионную стойкость, плотность, уменьшает ликвацию. Никель в бронзах увеличивает коррозионную стойкость, затрудняет чеканку отливок, гравировку.
Никель в бронзах увеличивает коррозионную стойкость, затрудняет чеканку отливок, гравировку.
Кремний обеспечивает бронзам высокую пластичность и хорошую обрабатываемость давлением. Они хорошо свариваются, паяются, обрабатываются резанием, однако, их литейные свойства хуже, чем у латуней и других бронз. Кремнистые бронзы характеризуются хорошими механическими, упругими и антифрикционными свойствами. Их используют вместо более дорогих оловянных бронз для изготовления антифрикционных деталей (бронзы БрКН 1-3, БрКМц 3-1), а также для замены бериллиевых бронз при производстве пружин, мембран и других деталей приборов, работающих в пресной и морской воде при температурах до 250°С.
Легирование цинком способствует улучшению литейных свойств кремнистых бронз. При небольших добавках цинка (0,5… 1%) жидкотекучесть сплава резко возрастает, затем плавно понижается при увеличении содержания цинка (до 15…20%), но все равно остается выше, чем жидкотекучесть чистой меди. Цинк в оловянных бронзах уменьшает интервал кристаллизации, снижает линейную усадку, горячеломкость, газонасыщаемость расплава. При добавлении цинка коррозионная стойкость сплава уменьшается. Плотность лицевой поверхности отливок улучшается. Механические свойства, в т.ч. твердость при содержании цинка до 5% повышаются. Цинк снижает склонность бронз к ликвации, способствует получению более плотного литья, раскисляет расплав и уменьшает содержание в нем водорода.
Цинк в оловянных бронзах уменьшает интервал кристаллизации, снижает линейную усадку, горячеломкость, газонасыщаемость расплава. При добавлении цинка коррозионная стойкость сплава уменьшается. Плотность лицевой поверхности отливок улучшается. Механические свойства, в т.ч. твердость при содержании цинка до 5% повышаются. Цинк снижает склонность бронз к ликвации, способствует получению более плотного литья, раскисляет расплав и уменьшает содержание в нем водорода.
Марганец и никель повышают их прочность и твердость, марганец повышает предел упругости бронз, уменьшает литейную усадку, повышает пластичность, делает сплав более коррозионностойким, улучшает способность к холодной обработке давлением.
Свинец улучшает антифрикционные свойства и обрабатываемость резанием бронз, а также удешевляет их стоимость, но снижает механические свойства, твердость.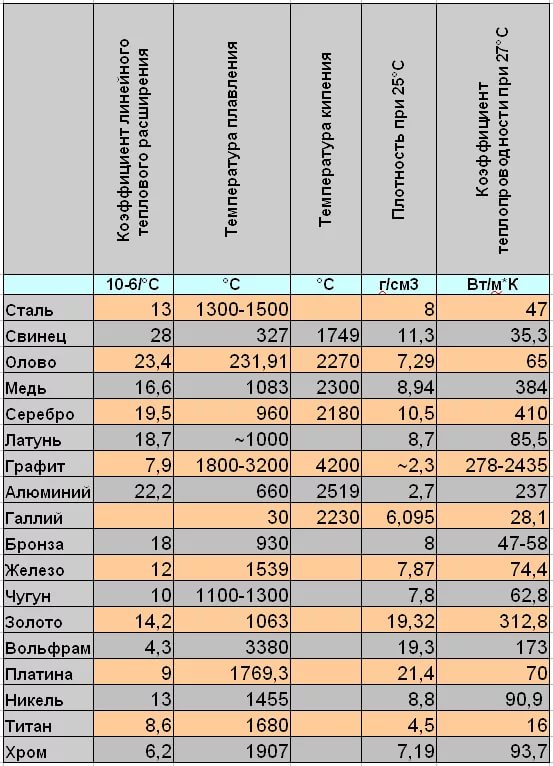 При содержании свинца в сплавах свыше 1% жидкотекучесть уменьшается, происходит расслоение расплава и ликвация по плотности.
При содержании свинца в сплавах свыше 1% жидкотекучесть уменьшается, происходит расслоение расплава и ликвация по плотности.
Использование бериллия приводит к резкому повышению прочностных и упругих свойств бронзы. Бериллиевые бронзы используют для изготовления упругих элементов ответственного назначения: пружин, пружинящих деталей, мембран, деталей, работающих на износ в агрессивных средах. Бериллиевые бронзы характеризуются высоким пределом упругости и низким модулем упругости, высокой коррозионной стойкостью, электропроводимостью, немагнитностью, хорошей технологичностью и способностью упрочняться термической обработкой.
Фосфор повышает твердость. Введение фосфора в сплав улучшает жидкотекучесть, предупреждает образование оксидов. При содержании фосфора до 0,1% горячеломкость сплавов повышается, свыше 0,1%-уменьшается. Свариваемость сплава с фосфором улучшается, повышается коррозионная стойкость в условиях бытовой среды.
Хром значительно упрочняет медь, повышает уровень ее жаропрочности и значительно повышает температуру рекристаллизации меди.
| Свойства | Марка бронзы |
| Высокие механические свойства | БрАЖ, БрКН |
| Антифрикционные свойства | БрАЖ, ОЦС5-5-5, БрОФ10-1, БрБ2, БрКН |
| Наибольшая электро- и теплопроводность | БрСр, БрКд, БрМг, БрЦр, БрХЦр, БрХ |
| Жаропрочность | БрМц, БрАЖ, БрАЖМц, БрАЖН, БрАЖНМц, БрКН |
| Жаропрочность в сочетании с высокой электропроводностью | БрХЦр, БрХ, БрКН, БрНБТ |
| Износостойкость | БрОФ6.5-0.15, БрОФ7-0,2, БрА5, БрА7, БрБ2 |
| Обрабатываемость резанием | ОЦС, БрОС |
| Хорошая свариваемость | БрКМц3-1, оловянные бронзы |
| Эрозионная и кавитационная устойчивость | БрАЖМц, БрАЖН, БрАЖНМц |
| Твердость | БрОФ7-0,2, БрАЖН, БрБ2, БрОЦ4-3 |
| Сопротивление коррозионной усталости | БрБ2 |
| Стойкость к истиранию | БрА5, БрА7 |
| Коррозионная стойкость | БрА7, БрАЖМц, БрАМц, БрКМц |
| Высокое сопротивление сжатию | БрКМц |
| Высокое сопротивление при знакопеременной нагрузке | БрАМц |
| Высокие пружинные свойства | БрБ2, БрКМц, БрБНТ |
| Прочность | БрБ2, БрБНТ |
| Прочность при повышенных температурах | БрАЖМц |
Понравилось это:
Нравится Загрузка. ..
..
Похожее
| | Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Инженерные приемы и понятия / / Защита от воздействия окружающей среды. Коррозия. Климатические исполнения / / Таблица 2 совместимости металлов и сплавов (оценка риска гальванической коррозии).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Нашли ошибку? Есть дополнения? Напишите нам об этом, указав ссылку на страницу. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| TehTab.ru Реклама, сотрудничество: [email protected] | Обращаем ваше внимание на то, что данный интернет-сайт носит исключительно информационный характер. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Все риски за использование информаци с сайта посетители берут на себя. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Совместимость металлов — ЭлектроХимия
Поставщики и производители
Наука и образование
Литература и нормативные документы
Главная » Архив библиотека » Прочее » Совместимость металловСамодеятельному строителю необходимо знать, что не все металлы можно соединять, создавая какие-либо конструкции.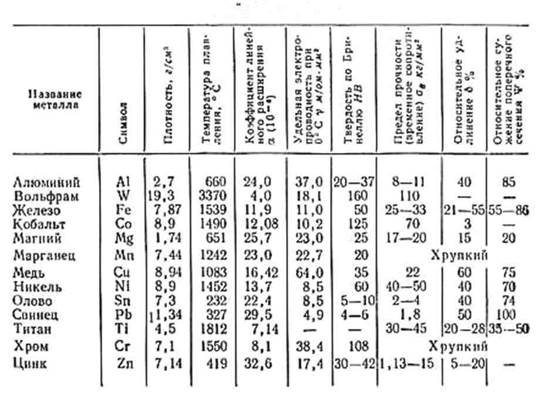
Таблица 1
|
|
Алюминий |
Бронза |
Дуралюминий |
Латунь |
Медь |
Никель |
Олово |
Припой ПОС |
Сталь нелегир. |
Хром |
Цинк |
|
Алюминий |
С |
Н |
С |
Н |
Н |
Н |
Н |
Н |
С |
Н |
С |
|
Бронза |
Н |
С |
Н |
С |
С |
С |
П |
П |
Н |
С |
Н |
|
Дуралюминий |
С |
Н |
С |
Н |
Н |
Н |
Н |
Н |
С |
Н |
С |
|
Латунь |
Н |
С |
Н |
С |
С |
С |
П |
П |
Н |
С |
Н |
|
Медь |
Н |
С |
Н |
С |
С |
С |
П |
П |
Н |
С |
Н |
|
Никель |
Н |
С |
Н |
С |
С |
С |
П |
П |
С |
С |
С |
|
Олово |
Н |
П |
Н |
П |
П |
П |
С |
С |
С |
Н |
С |
|
Припой ПОС |
Н |
П |
Н |
П |
П |
П |
С |
С |
С |
Н |
С |
|
Сталь нелегир. |
С |
Н |
С |
Н |
Н |
С |
С |
С |
С |
С |
С |
|
Хром |
Н |
С |
Н |
С |
С |
С |
Н |
Н |
С |
С |
С |
|
Цинк |
С |
Н |
С |
Н |
Н |
С |
С |
С |
С |
С |
С |
Простая английская Википедия, бесплатная энциклопедия
- Эта статья о железе и металле.
 Для инструмента, называемого утюгом, см. Глажение.
Для инструмента, называемого утюгом, см. Глажение.
Железо — это химический элемент и металл. Это самый распространенный химический элемент на Земле (по массе) и наиболее широко используемый металл. Он составляет большую часть ядра Земли и является четвертым по распространенности элементом земной коры.
Металл используется очень часто, потому что он прочный и дешевый.Железо — основной ингредиент, используемый для производства стали. Необработанное железо магнитно (притягивается к магнитам), а составной магнетит — постоянно магнитный.
В некоторых регионах железо использовалось около 1200 г. до н. Э. Это событие считается переходом от бронзового века к железному веку.
Физические свойства [изменить | изменить источник]
Железо — серый серебристый металл. Он магнитный, хотя разные аллотропы железа обладают разными магнитными свойствами. Железо легко найти, добыть и выплавить, поэтому оно так полезно.Чистое железо мягкое и очень пластичное.
Химические свойства [изменить | изменить источник]
Железо реактивно. Он реагирует с большинством кислот, например с серной кислотой. При реакции с серной кислотой образует сульфат железа. Эта реакция с серной кислотой используется для очистки металла.
Железо реагирует с воздухом и водой с образованием ржавчины. Когда ржавчина отслаивается, обнажается больше железа, позволяя ржаветь большему количеству железа. В конце концов, вся железка заржавела. Другие металлы, такие как алюминий, не ржавеют.Железо можно легировать хромом, чтобы получить нержавеющую сталь, которая в большинстве случаев не ржавеет.
Порошок железа может реагировать с серой с образованием сульфида железа (II), твердого черного твердого вещества. Железо также реагирует с галогенами с образованием галогенидов железа (III), таких как хлорид железа (III). Железо реагирует с галогеноводородными кислотами с образованием галогенидов железа (II), таких как хлорид железа (II).
Химические соединения [изменить | изменить источник]
Железо образует химические соединения с другими элементами. Обычно другой элемент окисляет железо.Иногда берутся два электрона, а иногда три. Соединения, в которых у железа есть два электрона, называются соединениями железа. Соединения, в которых у железа есть три электрона, называются соединениями трехвалентного железа. Соединения двухвалентного железа содержат железо в степени окисления +2. В соединениях трехвалентного железа железо находится в степени окисления +3. Соединения железа могут быть черными, коричневыми, желтыми, зелеными или пурпурными.
Обычно другой элемент окисляет железо.Иногда берутся два электрона, а иногда три. Соединения, в которых у железа есть два электрона, называются соединениями железа. Соединения, в которых у железа есть три электрона, называются соединениями трехвалентного железа. Соединения двухвалентного железа содержат железо в степени окисления +2. В соединениях трехвалентного железа железо находится в степени окисления +3. Соединения железа могут быть черными, коричневыми, желтыми, зелеными или пурпурными.
Соединения железа являются слабыми восстановителями. Многие из них зеленые или синие. Наиболее распространенное соединение двухвалентного железа — это сульфат железа.
Соединения железа являются окислителями. Многие из них коричневые. Наиболее распространенное соединение железа — оксид железа, тоже самое, что ржавчина. Одна из причин, по которой железо ржавеет, заключается в том, что оксид железа является окислителем. Он окисляет железо, ржавея даже под покраской. Поэтому при небольшой царапине на краске все это может заржаветь.
Соединения железа (II) [изменить | изменить источник]
Соединения в степени окисления +2 являются слабыми восстановителями. Обычно они светлые.Они реагируют с кислородом воздуха. Они также известны как соединения железа.
- Сульфид железа (II), блестящее химическое вещество, которое реагирует с кислотами с выделением сероводорода, обнаружено в земле
- Сульфат железа (II), сине-зеленый кристаллический химикат, получаемый в результате реакции серной кислоты со сталью, используемый для уменьшения содержания ядов, таких как хромат, в бетоне
- Хлорид железа (II), бледно-зеленый кристаллический химикат, получаемый в результате реакции соляной кислоты со сталью
- Гидроксид железа (II), темно-зеленый порошок, полученный путем электролиза воды железным анодом, вступает в реакцию с кислородом и становится коричневым.
- Оксид железа (II), черный, легковоспламеняющийся, редкий
Смешанная степень окисления [изменить | изменить источник]
Эти соединения редки; только один общий. Они находятся в земле.
Они находятся в земле.
Соединения железа (III) [изменить | изменить источник]
Соединения в степени окисления +3 обычно коричневые. Они окислители. Они едкие. Они также известны как соединения трехвалентного железа.
- Оксид железа (III), ржавчина, красно-коричневый, растворяется в кислоте
- Хлорид железа (III), ядовитый и едкий, растворяется в воде с образованием темно-коричневого кислого раствора. Получается в результате реакции железа с соляной кислотой и окислителем
- Нитрат железа (III), светло-фиолетовый, коррозионно-активный, используемый при травлении
- Сульфат железа (III), редко, светло-коричневый, растворяется в воде.Производится в результате реакции железа с серной кислотой и окислителем.
Во Вселенной много железа, потому что это конечная точка ядерных реакций в больших звездах. Это последний элемент, который должен быть произведен до того, как взрыв сверхновой звезды выбросит железо в космос.
Металл — главный ингредиент ядра Земли. На поверхности он находится в виде соединения железа или трехвалентного железа. Некоторые метеориты содержат железо в виде редких минералов. Обычно железо находится в земле в виде гематитовой руды, большая часть которой была произведена во время Великого события оксигенации.Железо можно извлечь из руды в доменной печи. Некоторое количество железа встречается в виде магнетита.
В мясе есть соединения железа. Железо является важной частью гемоглобина красных кровяных телец.
Железо производится на крупных заводах , , путем восстановления гематита углеродом (коксом). Это происходит в больших контейнерах, называемых доменными печами. Доменная печь заполнена железной рудой, коксом и известняком. Подается очень горячий поток воздуха, который вызывает возгорание кокса.Сильная высокая температура заставляет углерод вступать в реакцию с железной рудой, забирая кислород из оксидов железа и образуя диоксид углерода. Двуокись углерода представляет собой газ, и он выходит из смеси. В утюг попал песок. Известняк, состоящий из карбоната кальция, превращается в оксид кальция и диоксид углерода, когда известняк очень горячий. Оксид кальция вступает в реакцию с песком, образуя жидкость, называемую шлаком. Шлак сливается, остается только чугун. В результате реакции в доменной печи останется чистое жидкое железо, где ему можно придать форму и закалить после охлаждения.Почти все металлургические заводы сегодня являются частью сталелитейных заводов, и почти весь чугун превращается в сталь.
В утюг попал песок. Известняк, состоящий из карбоната кальция, превращается в оксид кальция и диоксид углерода, когда известняк очень горячий. Оксид кальция вступает в реакцию с песком, образуя жидкость, называемую шлаком. Шлак сливается, остается только чугун. В результате реакции в доменной печи останется чистое жидкое железо, где ему можно придать форму и закалить после охлаждения.Почти все металлургические заводы сегодня являются частью сталелитейных заводов, и почти весь чугун превращается в сталь.
Есть много способов работать с железом. Железо можно закалить, нагревая кусок металла и опрыскивая его холодной водой. Его можно смягчить, нагревая и давая ему медленно остыть. Его также можно штамповать с помощью тяжелого пресса. Его можно натянуть на провода. Из него можно прокатать листовой металл.
В Соединенных Штатах большая часть железа была извлечена из земли в Миннесоте, а затем отправлена на корабле в Индиану и Мичиган, где из него превратилась сталь.
Как металл [изменить | изменить источник]
Железо используется больше, чем любой другой металл. Это прочно и дешево. Из него делают здания, мосты, гвозди, шурупы, трубы, фермы и башни.
Это прочно и дешево. Из него делают здания, мосты, гвозди, шурупы, трубы, фермы и башни.
Железо не очень реактивно, поэтому его легко и дешево извлечь из руды. После превращения в сталь он очень прочен и используется для армирования бетона.
Есть разные виды утюгов. Чугун — это чугун, производимый способом, описанным выше в статье. Он твердый и хрупкий.Из него делают такие вещи, как крышки ливневых водостоков, крышки люков и блоки двигателя (основная часть двигателя).
Сталь — наиболее распространенная форма железа. Стали бывают нескольких видов. Мягкая сталь — это сталь с низким содержанием углерода. Он мягкий и легко сгибается, но не трескается. Используется для гвоздей и проволоки. Углеродистая сталь тверже, но более хрупкая. Используется в инструментах.
Есть и другие марки стали. Нержавеющая сталь из-за содержания хрома устойчива к ржавчине, а никель-железные сплавы могут оставаться прочными при высоких температурах.Другие стали могут быть очень твердыми, в зависимости от добавленных сплавов.
Кованое железо легко формуется и используется для изготовления заборов и цепей.
Очень чистое железо мягкое и может легко ржаветь (окисляться). Он также довольно реактивный.
Как соединения [изменить | изменить источник]
Соединения железа используются для нескольких целей. Хлорид железа (II) используется для очистки воды. Также используется хлорид железа (III). Сульфат железа (II) используется для восстановления хроматов в цементе. Некоторые соединения железа используются в витаминах.
Дефицит железа — это самый распространенный дефицит питания в мире. [1] [2] [3]
Нашему телу необходимо железо, чтобы помочь кислороду добраться до наших мышц, потому что оно лежит в основе некоторых важных макромолекул нашего тела, таких как гемоглобин, которые заставляют его работать. лучше. Во многие злаки добавлено немного железа (элемент , металл, , железо). [4] [5] Его добавляют в крупы в виде крошечных металлических опилок. Иногда даже можно увидеть осколки, если взять очень сильный магнит и положить его в коробку.Магнит будет притягивать эти железки. Эти маленькие металлические стружки не вредны для нашего организма. [6]
Иногда даже можно увидеть осколки, если взять очень сильный магнит и положить его в коробку.Магнит будет притягивать эти железки. Эти маленькие металлические стружки не вредны для нашего организма. [6]
Железо наиболее доступно для организма при добавлении к аминокислотам — железо в этой форме усваивается в десять-пятнадцать раз лучше, чем в качестве элемента. [7] Железо также содержится в мясе, например в стейке. Железо, содержащееся в пищевых добавках, находится в форме химического вещества, такого как сульфат железа (II), который дешев и хорошо усваивается. Организм не потребляет больше железа, чем ему нужно, и обычно ему нужно очень мало.Железо в красных кровяных тельцах перерабатывается системой, разрушающей старые клетки. Потеря крови в результате травмы или заражения паразитами может быть более серьезной. [8]
Железо токсично при попадании в организм большого количества. Когда принимается слишком много таблеток железа, люди (особенно дети) заболевают. Кроме того, существует генетическое заболевание, которое нарушает регуляцию уровня железа в организме.
Кроме того, существует генетическое заболевание, которое нарушает регуляцию уровня железа в организме.
Есть химические вещества, связывающиеся с железом, которые могут прописать врачи.
- ↑ Центры по контролю и профилактике заболеваний (2002).«Дефицит железа — США, 1999–2000». MMWR . 51 : 897–9.
- ↑ Hider, Robert C .; Конг, Сяоле (2013). «Глава 8. Железо: эффект перегрузки и дефицита». В Астрид Сигель, Гельмут Сигель и Роланд К. О. Сигель (ред.). Взаимосвязь между ионами эссенциальных металлов и болезнями человека . Ионы металлов в науках о жизни. 13 . Springer. С. 229–294. DOI: 10.1007 / 978-94-007-7500-8_8.
- ↑ Длоуи, Эдриенн К.; Ауттен, Кэрин Э. (2013). «Глава 8.4 Поглощение, транспортировка и хранение железа». В Banci, Лючия (ред.) (Ред.). Металломика и клетка . Ионы металлов в науках о жизни. 12 . Springer. DOI: 10.1007 / 978-94-007-5561-1_8. ISBN 978-94-007-5560-4 .
 CS1 maint: дополнительный текст: список редакторов (ссылка) электронная книга ISBN 978-94-007-5561-1 ISSN 1559-0836 электронная-ISSN 1868-0402
CS1 maint: дополнительный текст: список редакторов (ссылка) электронная книга ISBN 978-94-007-5561-1 ISSN 1559-0836 электронная-ISSN 1868-0402 - ↑ «Проверка прочности железа в зерновых». Министерство сельского хозяйства США.Проверено 29 января 2010.
- ↑ Адамс, Сесил. Возвращение прямого наркотика . Нью-Йорк: Ballantine Books, 1994
- ↑ Фелтон, Брюс. Единственный в своем роде . Нью-Йорк: Уильям Морроу и компания, 1992.
- ↑ Пинеда О., Эшмид HD (2001). «Эффективность лечения железодефицитной анемии у младенцев и детей раннего возраста с хелатом бис-глицината железа». Питание . 17 (5): 381–4. DOI: 10.1016 / S0899-9007 (01) 00519-6. PMID 11377130.
- ↑ Эндрюс Н.С. 2000. Нарушения обмена железа. Медицинский журнал Новой Англии . Соответствующая переписка, опубликована в NEJM 342 : 1293-1294.
Металлы и сплавы — температуры плавления
Точка плавления — это температура, при которой вещество переходит из твердого состояния в жидкое.
Точки плавления для некоторых металлов и сплавов:
| Металл | Точка плавления ( o C) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Адмиралтейство Латунь | 00 | 902 Алюминий | 660 | |||||||
| Алюминиевый сплав | 463-671 | |||||||||
| Алюминиевая бронза | 1027-1038 | |||||||||
| Сурьма | 630 | |||||||||
| Баббит | Бериллий Медь | 865-955 | ||||||||
| Висмут | 271.4 | |||||||||
| Латунь, красный | 1000 | |||||||||
| Латунь, желтый | 930 | |||||||||
| Кадмий | 321 | |||||||||
| Хром | Хром | 902 | 1084 | |||||||
| Мельхиор | 1170-1240 | |||||||||
| Золото, 24K чистое | 1063 | |||||||||
| Хастеллой C | 1320-1350 | 1320-1350 | ||||||||
| 1390-1425 | ||||||||||
| Иридий | 2450 | |||||||||
| Кованое железо | 1482-1593 | |||||||||
| Чугун серое литье | 1127-1204 | 1127-1204 | 9019||||||||
| Свинец | 327. 5 5 | |||||||||
| Магний | 650 | |||||||||
| Магниевый сплав | 349-649 | |||||||||
| Марганец | 1244 | |||||||||
| Марганцево-ртутная бронза | — 890198209 Марганцево-ртутная бронза | — 890198209 | ||||||||
| Молибден | 2620 | |||||||||
| Монель | 1300-1350 | |||||||||
| Никель | 1453 | |||||||||
| Ниобий (колумбий) | 9010Палисий | 9010 | 1555 | |||||||
| Фосфор | 44 | |||||||||
| Платина | 1770 | |||||||||
| Плутоний | 640 | |||||||||
| Калий | 63.3 | |||||||||
| Красная латунь | 990-1025 | |||||||||
| Рений | 3186 | |||||||||
| Родий | 1965 | |||||||||
| Рутений | 1411 | |||||||||
| Серебро, монета | 879 | |||||||||
| Серебро, чистое | 961 | |||||||||
| Серебро, стерлинговое | 893 | |||||||||
| Натрий | Натрий | . 83 83 | ||||||||
| Припой 50-50 | 215 | |||||||||
| Сталь углеродистая | 1425-1540 | |||||||||
| Сталь нержавеющая | 1510 | |||||||||
| Тантал | Тантал | |||||||||
| Олово | 232 | |||||||||
| Титан | 1670 | |||||||||
| Вольфрам | 3400 | |||||||||
| Уран | 1132 | Желтый | 932 | |||||||
| Цинк | 419.5 | |||||||||
| Цирконий | 1854 |
Золото, серебро и медь — давление и температура плавления
Алюминий или алюминий? — ANSI Blog
Химический элемент, классифицированный в Периодической таблице с атомным номером 13 и символом Al, представляет собой пластичный, ковкий серебристо-белый металл. Этот металл повсеместно используется в упаковке, автомобилестроении, энергетике, строительстве, транспорте, энергетике, аэрокосмической и оборонной промышленности, но его официальное название на английском языке вызывает удивительную двусмысленность. Это потому, что это алюминий и алюминий.
Это потому, что это алюминий и алюминий.
Современное различие между этими двумя терминами очевидно: алюминий является правильным для американского английского, а также канадского английского, в то время как алюминий является правильным для британского английского, а также для большинства других форм английского языка. Различия между этими взаимно понятными языками не должны вызывать удивления, поскольку из-за языковых правил, характерных для этих двух стран, в Великобритании и США по-разному используется около 4000 слов (например,грамм. самолет / самолет , эстетика / эстетика , цвет / цвет ).
Однако точное происхождение этих имен может показаться немного неожиданным, поскольку различия между ними не были подтверждены до двадцатого века. По большей части, в книге Ноя Вебстера «Американский словарь английского языка » установлено множество явных различий между словами в британском и американском английском в девятнадцатом веке. Это в целом упростило язык для жителей молодых Соединенных Штатов, поскольку Вебстер изложил многие изменения между двумя языками, которые мы видим сегодня, и предложил некоторые, которые явно не прижились, например, изменение языка на tung .
В словаре Вебстера 1828 года для атомарного элемента Al было предложено только одно слово: алюминий. Это, безусловно, помогло продвинуть формулировку в Соединенных Штатах, но это не было источником более короткого слова, обозначающего металл.
Когда сэр Хэмфри Дэви открыл этот элемент в начале девятнадцатого века, он первоначально назвал его alumium , но эта версия явно не прижилась даже у него самого. Это название он получил от глинозема, минерала, который был назван по-английски менее двадцати лет назад и был заимствован из французского квасцов , белого минерала, с древних времен использовавшегося для окрашивания и дубления.Однако вскоре он изменил его на алюминий, прежде чем снова приспособить его к алюминию в 1812 году. Таким образом, алюминий появился раньше алюминия.
Однако окончательное решение Дэви было предпочтительным с самого начала его коллегами-учеными, получившими классическое образование, поскольку оно обладало более классическим кольцом и даже гармонично сочеталось со многими другими элементами, которые он лично назвал, такими как калий, натрий, и магний. Написание –um некоторое время продолжалось в Британии, но вскоре преобладала форма –ium .
Написание –um некоторое время продолжалось в Британии, но вскоре преобладала форма –ium .
Однако в США господство алюминия заняло некоторое время. Несмотря на то, что это была единственная формулировка элемента, предложенная в Словаре Вебстера, алюминий появлялся примерно так же часто, как алюминий на протяжении девятнадцатого века, а версия – фактически была более распространена в американских газетах в последнее десятилетие того века. Однако в следующем десятилетии произошел перелом, когда версия –um стала преобладать.
Этот процесс может быть связан с появлением алюминия как жизнеспособного продукта.Фактически, ни алюминий, ни алюминий не встречались бы сколько-нибудь существенно на протяжении 1800-х годов; его было так трудно добывать из руд, что металл оставался экзотическим и дорогим, более ценным, чем золото или серебро. Когда император Наполеон III изготовил алюминиевые столовые приборы для государственных банкетов, новый процесс улучшил процесс извлечения, но металл по-прежнему стоил больше, чем золото.
Примерно на рубеже веков доступность и производство Al стремительно росли, и можно констатировать, что именно здесь произошел полный переход к –.Поскольку стандарты всегда важны, общее слово для химического элемента с тринадцатью протонами в его атомном ядре было неотъемлемой частью. А для разъяснений журналисты и даже ученые обратятся к официальному источнику американского английского: Webster’s Dictionary. Здесь они нашли только алюминий, подтвердив это официальным термином. В 1925 году Американское химическое общество официально приняло его, вероятно, в ответ на этот сдвиг.
Неотъемлемой целью стандартизации является предоставление ясной информации, и эти знания обычно служат для повышения безопасности и эффективности производственных процессов.Таким образом, может показаться, что использование двух похожих слов для описания алюминия / алюминия может противоречить этой идее. Однако взаимозаменяемость этих двух слов очевидна, и обычно выбирается только одно.
Например, стандарты, опубликованные Алюминиевой ассоциацией и Американским обществом сварки (AWS), базирующимися в США, используют алюминий (например, ANSI h45.

 ru/
ru/ 
 Для инструмента, называемого утюгом, см. Глажение.
Для инструмента, называемого утюгом, см. Глажение.  CS1 maint: дополнительный текст: список редакторов (ссылка) электронная книга ISBN 978-94-007-5561-1 ISSN 1559-0836 электронная-ISSN 1868-0402
CS1 maint: дополнительный текст: список редакторов (ссылка) электронная книга ISBN 978-94-007-5561-1 ISSN 1559-0836 электронная-ISSN 1868-0402