Разница между ГКЛ и ГВЛ, сравнение характеристик
Сегодня отделка жилых и офисных помещений с помощью ГКЛ и ГВЛ очень распространена. Эти материалы отлично выдерживают повышенную влажность и высокие температуры. На них удобно наносить декоративное покрытие, их легко красить и оклеивать обоями. Но существует несколько различий между этими строительными материалами, которые мы и рассмотрим. Давайте сравним характеристики и узнаем какая разница между этими товарами.
Листы гипсокартона сделаны по принципу сэндвича. Они состоят из двух основных частей: сердцевина – это гипс, наружное покрытие – плотный картон. Чтобы сердечник был прочным и не обсыпался, в его состав добавляют дополнительные укрепляющие компоненты.
Сцепляются обе составляющие гипсокартона за счет строительного клея. Картон – это своего рода армирующий каркас. Он не только прочен, но и обладает гладкой поверхностью, что позволяет его декорировать разными элементами и красить.
Гипсокартон делят на:
Особенности применения гипсокартона
Гипсокартон незаменим в строительном моделировании. Он пластичен, отлично изгибается, что дает возможность конструировать из него арки и сложные элементы. Эти качества позволяют воплощать в реальность дизайнерские задумки, формировать из гипсокартона изогнутые поверхности стен и потолка.
Гипсоволокнистый отделочный материал
ГВЛ наравне с гипсокартоном используют для внутренней отделки жилых, офисных и производственных помещений. Отличие его состоит в строении ГВЛ-плиты. Суть в том, что она однородна.
В своем составе гипсоволокно содержит гипс (80-85%), прессованную целлюлозу (20-25%) и дополнительные примеси. Лист ГВЛ однороден, сам по себе он прочен, поэтому его не обшивают защитным слоем строительного картона.
Использование ГВЛ
Этот экологически чистый материал отлично подходит для конструирования межкомнатных перегородок, арок, подвесных потолков и сложных конструкций. Благодаря своему безвредному составу, ГВЛ можно устанавливать не только в жилых помещениях, но и в медицинских и детских учреждениях.
Благодаря своему безвредному составу, ГВЛ можно устанавливать не только в жилых помещениях, но и в медицинских и детских учреждениях.
Конструкция ГВЛ прочная, она устойчива к ударам и другим механическим повреждениям. Выполняются листы гипсоволокна в соответствии с требованиями пожарных служб, поэтому они обладают повышенной огнестойкостью.
Гипсоволокно делят на:
Отличие ГКЛ и ГЛВ
Итак, главное отличие этих двух строительных материалов – строение каждого листа.
ГВЛ, благодаря повышенной устойчивости к ударам, отлично подойдет для конструирования перегородок. ГВЛ отлично режется, потому что при его распиле не нужно учитывать направленность картонного волокна. Поэтому если нужно смоделировать небольшие поверхности, ГВЛ будет лучшим материалом.
ГКЛ станет хорошим материалом при обшивке стен. Ведь его поверхность очень гладкая, а это значит, что покрывать его краской или оклеивать обоями будет гораздо проще. Также рекомендуется использовать ГКЛ при обшивке больших конструкций, где не требуется исполнение мелких декоративных элементов.
Также рекомендуется использовать ГКЛ при обшивке больших конструкций, где не требуется исполнение мелких декоративных элементов.
Сказать однозначно, что ГКЛ или ГВЛ лучше, нельзя. Каждый из этих материалов отлично справится с разными строительными задачами. Поэтому выбор должен происходить с учетом вышеперечисленных нюансов и пожеланий клиента.
Наш магазин предлагает вам:
КУПИТЬ СТРОЙМАТЕРИАЛЫ МИНСК
по низким ценам, также предлагаем вам услугу: доставка стройматериалов по Минску.
Что лучше ГВЛ или гипсокартон?
При выравнивании и отделке стен, полов и потолков в помещениях наиболее востребованными являются гипсокартонные и гипсоволокнистые листы. Их популярность обусловлена простотой монтажа, нетребовательностью к ровности поверхности под установку, возможностью нанесения любых декоративных покрытий и доступной стоимостью. Однако, что предпочтительнее: гипсоволокнистый лист или гипсокартон?
Гипсокартон имеет трёхслойную структуру, состоящую из слоя гипса, поверх которого с двух сторон наклеен картон. Представляет собой экологически чистый материал, состоящий на 93% из гипса, 6% картона и 1% специализированных добавок. Обладает малым удельным весом, поэтому не создаёт значительных нагрузок на стены.
Представляет собой экологически чистый материал, состоящий на 93% из гипса, 6% картона и 1% специализированных добавок. Обладает малым удельным весом, поэтому не создаёт значительных нагрузок на стены.
Обратите внимание
Материал обладает оптимальным соотношением прочности и гибкости, за счёт чего при монтаже сложных поверхностей его можно изгибать без повреждений. Однако при этом он является весьма хрупким, поэтому требует использования специальных креплений при монтаже и бережной транспортировки. Механические воздействия выше определённого предела становятся причиной необратимых повреждений листов.
Среди основных свойств ГКЛ можно выделить следующие:
- простота обработки;
- отличная стойкость к воспламенению;
- листы имеют гладкую поверхность, которая пригодна для нанесения любых отделочных материалов;
- материал обеспечивает отличный воздухо- и влагообмен с внешней средой, создавая особый микроклимат в помещениях.

ТОП 3 лучших товаров по мнению покупателей
Структура и свойства гипсоволокнистых листов
Гипсоволокнистый лист, в отличие от гипсокартонного, представляет собой однородный слой, изготовленный из измельчённой целлюлозы, выполненной в виде волокон, и гипса. Для улучшения водоотталкивающих свойств производители дополнительно пропитывают верхние слои специальными пропитками.
Характерной особенностью ГВЛ является высокая прочность листов, достигаемая за счёт высокой плотности более 1200 кг/м3. Им не присуща хрупкость, поэтому их намного проще транспортировать, чем гипсокартон, а при монтаже необязательно использовать специализированные крепежи. Наблюдается разница и в пластичности — создавать арки или другие сложные поверхности не получится.
Стоит знатьХарактерной особенностью ГВЛ является высокая прочность листов, достигаемая за счёт высокой плотности более 1200 кг/м3. Им не присуща хрупкость, поэтому их намного проще транспортировать, чем гипсокартон, а при монтаже необязательно использовать специализированные крепежи.
Среди основных свойств ГВЛ можно выделить следующие:
- способны выдерживать значительные нагрузки в среднем от 40 до 100 кг/м2 при толщинах 9,5 и 12,5 мм соответственно;
- высокая огнестойкость, позволяющая монтировать листы в помещениях с повышенной температурой;
- при выполнении разреза материала кромка не раскрашивается, в отличие от ГКЛ;
- обладают достаточным уровнем звукоизоляции и минимальной теплопроводностью;
- допускается применение в качестве черновых полов.
Обзор стоимости
Сравнение и отличия ГВЛ и ГКЛ
Выбрать гипсоволокно или гипсокартон, что лучше из них, а что хуже, поможет определиться Таблица 1.
Таблица 1. Сравнение характеристик ГКЛ и ГВЛ.
| Характеристика | Гипсокартон | Гипсоволокно |
| Плотность, кг/м3 | 850 | 1200 |
| Теплопроводность, Вт/(м*К) | 0,10-0,20 | 0,22-0,35 |
| Прочность на изгиб, МПа | До 5,5 | Выше 5,5 |
| Модуль упругости | 2000 | 2500-3000 |
| Содержание влаги в материале, % | 1 | До 1,5 |
| Уровень звукоизоляции, дБ | 27-30 | 30-35 |
| Соответствие классу горючести | Г1 | Г1 |
Выбор материала для обшивки стен
Для стены выбор обшивки между гипсокартоном и гипсоволокном не так очевиден.
ГВЛ листы обладают повышенной прочностью, поэтому они идеальны для обшивки промышленных объектов или помещений, где предполагаются механические нагрузки на стены, например, в спортзалах. Хотя с их помощью и не удастся сформировать сложную поверхность, зато они будут иметь минимальную хрупкость и длительный срок эксплуатации.
При обшивке стен выбор между ГВЛ или ГКЛ производится на основе двух критериев: веса конструкции и необходимости получения заданной прочности.
Подбор материала для обшивки потолков
При обшивке потолков гипсокартоном можно получить следующие преимущества:
- возможность формирования сложной конструкции подвесных потолков;
- создавать арки с радиусом изгиба листов не более 0,75 м, в зависимости от их толщины;
- возможность нанесения любых отделочных слоёв благодаря повышенной адгезии картонного слоя.

Гипсоволокнистые листы при обшивке потолков создадут примерно в два раза большую нагрузку, чем гипсокартон, а также создадутся проблемы с нанесением штукатурки, так как потребуется специально наносить слой грунтовки. Однако при этом потолок получит отличную звукоизоляцию от верхних этажей или чердака и будет обеспечена защита от влаги и пара.
Выбор материала для обшивки ванной комнаты
Для ванной комнаты конечно выгоднее использовать гипсоволокнистые панели, так как они способны стойко переносить условия повышенной влажности и смогут стойко перенести механические воздействия, например, в случае падения из-за скользких полов. Благодаря минимальному коэффициенту расширения все стыковочные швы останутся герметичными, а материал сохранит свои свойства.
Сравнение водостойких ГВЛ и ГКЛ показывает, что гипсоволокнистые листы обладают явным преимуществом, поскольку способны выдерживать высокие уровни влажности длительное время и иметь при этом минимальное уширение. В случае повреждения наружного слоя гипсокартон начинает портиться и разрушаться, а гипсоволокно сохранит свою структуру и свойства.
В случае повреждения наружного слоя гипсокартон начинает портиться и разрушаться, а гипсоволокно сохранит свою структуру и свойства.
В ванной комнате рационально выполнить обшивку стен ГВЛ, а потолка – ГКЛ.
Результаты сравнения — что лучше выбрать?
Гипсоволокнистая панели отличается от гипсокартонной повышенной прочностью, долговечностью, звуко- и теплоизоляционными свойствами, а также огнестойкостью. Поэтому она является наиболее предпочтительным материалом для обшивки стен и потолков, при условии наличия необходимых технических условий. Однако она не позволит сформировать поверхности сложной формы.
Гипсокартон рекомендуется использовать при ограниченном бюджете проводимых работ, в целях создания конструкций со сложной геометрией, а также при недостаточных несущих способностях стен, потолков или всего объекта.
Что лучше выбрать гипсокартон или гипсоволокно для отделки дома?
При отделке и в ремонте часто используют такие популярные материалы, как гипсоволокно и гипсокартон. Это недорого и удобно. К тому же, сам процесс обработки и монтажа — не такой сложный. Не удивительно, что гипсокартонные (ГКЛ) и гипсоволкнистые листы (ГВЛ) завоевали особую любовь покупателей.
Это недорого и удобно. К тому же, сам процесс обработки и монтажа — не такой сложный. Не удивительно, что гипсокартонные (ГКЛ) и гипсоволкнистые листы (ГВЛ) завоевали особую любовь покупателей.
ГКЛ и ГВЛ, как правило, применяют для выравнивания стен, создания перегородок, придания стенам более привлекательных очертаний, создания арок и другого. В чём же отличие этих двух материалов и что лучше выбрать гипсокартон или гипсоволокно при строительно-отделочных работах? Ответ на эти вопросы нам поможет найти разница в составе и структуре.
Гипсокартон: свойства и виды
Гипсокартон представляет собой своеобразный слоеный пирог из листов картона, “склеенных” между собой гипсовой смесью. Данный строительный и отделочный материал отличается экологичностью, лёгкостью и гибкостью. Он также обладает хорошими теплоизоляционными свойствами.
Чтобы улучшить характеристики листов гипсокартона, в него добавляют разные компоненты. В зависимости от этих добавок, выделяют следующие виды гипсокартона:
- ГКЛ — обыкновенные листы.
 Их можно отличить по серому цвету и синей маркировке.
Их можно отличить по серому цвету и синей маркировке. - ГКЛВ — влагостойкие гипсокартонные листы. Они обработаны пропиткой, которая отталкивает воду, выводит влагу и защищает от грибка. Гипсокартон имеет зеленый цвет, на нем проставлена синяя маркировка.
- ГКЛО — огнеупорные гипсокартонные листы. Специальные добавки придают им улучшенную термостойкость и огнеупорность. Материал может не загораться при открытом огне до одного часа. Этот гипсокартон розового цвета с красной маркировкой.
- ГКЛВО — влагостойкий гипсокартон с повышенной огнеупорностью. Благодаря добавкам, он соединил в себе свойства двух предыдущих видов материала. Узнать эти листы можно по зелёному цвету и красной маркировке.
Отличия гипсоволокна от гипсокартона
В отличие от гипсокартона, гипсоволокно имеет не слоеную структуру. ГВЛ — это смесь волокон целлюлозы и гипса, который затем прессуется. Чтобы получилась гладкая и ровная поверхность, после прессовки материал режут и шлифуют.
Любое гипсоволокно имеет высокую огнеупорность, так как сама структура ГВЛ препятствует воспламенению.
Гипсоволокнистые листы могут быть двух видов:
- обычные ГВЛ
- влагостойкие ГВЛ.
И те, и другие, серого цвета с синей маркировкой. Вид — обычный или влагостойкий — указывается на обратной стороне изделия. Там же прописываются размеры.
Сравнение ГВЛ и ГКЛ по свойствам:
- Гипсоволокно более плотное и прочное, чем гипсокартон. К примеру, в ГВЛ можно вбивать гвозди и вкручивать шурупы без дюбелей, чего нельзя сказать о ГКЛ. ГВЛ способно выдерживать повышенные нагрузки.
- Гипсокартон лучше гипсоволокна по гибкости. С его помощью можно изготавливать фигурные конструкции — арки, оригинальные потолки и другие элементы отделки, которые требуют сгибания материала. С гипсоволокном проделать то же самое не возможно.
- Гипсокартон можно резать ножом, а вот гипсоволокно придётся распиливать.
- Для обработки углов гипсокартона нужны металлические уголки и армирующая лента. А гипсоволокно такой обработки не требует.
- Гипсокартон нельзя покрывать краской и побелкой на кремниевой основе, а гипсоволокно это вполне допускает.

- Гипсоволокно лучше гипсокартона по термостойкости, хотя оба материала отличаются огнеупорностью.
- Гипсокартон намного легче гипсоволокна. Лист ГВЛ 2500Х1200 мм весит около 40 кг, а вот ГКЛ самой большой толщины — 33 кг.
Где применять ГВЛ и ГКЛ?
Для начала нужно определиться с типом помещений, которые предстоит отделывать. Если это промышленный объект — лучше сделать выбор в пользу гипсоволокна. ГВЛ может выдерживать повышенные нагрузки.
В домашних условиях можно использовать как гипсоволокно, так и гипсокартон. Обратите внимание, что гипсокартон намного легче своего более прочного собрата. Поэтому работать с ГКЛ будет значительно удобнее.
Стены
При обшивке стен в комнатах квартиры или дома вполне можно обойтись обычным гипсокартоном. Для ванной лучше использовать влагостойкий гипсокартон.
Потолок
Если Вы хотите создать оригинальную форму потолка — используйте гипсокартон. Он гораздо гибче, что позволяет дать волю фантазии. У гипсоволокна тоже есть свои преимущества. Монтировать его сложнее, зато ГВЛ обеспечит лучшую шумоизоляцию и защитит от проникновения влаги (очень актуально для ванной и кухни).
У гипсоволокна тоже есть свои преимущества. Монтировать его сложнее, зато ГВЛ обеспечит лучшую шумоизоляцию и защитит от проникновения влаги (очень актуально для ванной и кухни).
Пол
Для отделки пола обычно используют гипсоволокно. Его прочность и устойчивость к повреждениям очевидно выигрывают в сравнении с гипсокартоном.
Экологичность и безопасность
Стоит отметить, что оба материала экологичны. Они не содержат токсичных компонентов. А поэтому использовать листы гипсоволокна и гипсокартона можно, не опасаясь за своё здоровье.
Какой из материалов лучше выбрать гипсокартон или гипсоволокно – решать Вам. Главное — это учесть свойства листов и условия, в которых ГВЛ или ГКЛ в дальнейшем будут использоваться.
ГВЛ или гипсокартон на стены: правила выбора
ГВЛ или гипсокартон на стены, потолок, для перегородок, декоративных и функциональных конструкций применяются в обязательном порядке. ГВЛ зарекомендовал себя как удобный, невредный для организма, имеющий дополнительные преимущества, такие как огнеупорность, влагоустойчивость, способность к шумоизоляции.
Рассмотрим, чем отличается ГВЛ от ГКЛ, из чего состоит и для каких целей лучше использовать тот или иной вариант. А также узнаем о преимуществах и недостатках каждого из них.
Листы гипсоволокнистые и гипсокартонные
Название листов связано с материалами, из которых они сделаны. Гипсоволокнистый гипсокартон представляет собой однородный ровный лист, в состав которого входит гипс, армированный целлюлозным волокном. Бывает следующих разновидностей: стандартный, который используется в помещениях с низкой влажностью, водостойкий – для помещений с высокой влажностью.
Гипсоволокнистый гипсокартон — однородны й лист, бывает двух типов: обычный и влагостойкий.
ГКЛ – что это такое: расшифровка данного сокращения обозначает гипсокартонный лист. Состоит этот материал из двух слоев: середина – из гипса, наружные части – из картона. Бывает следующих видов:
- огнеупорный (ГКЛО) – покрытый огнеупорным составом;
- влагостойкий (ГКЛВ) – имеющий в составе вещество, противостоящее плесени, грибкам, бактериям;
- комбинированный (КГП ПС) – с пенополистирольным составом для утепления, можно использовать для внутренних и внешних работ;
- декоративный – эксклюзивный, требует аккуратного монтажа.

В чем сходство этих материалов?
Листы гипсокартонные и гипсоволокнистые сходны между собой материалами, экологичностью, возможностью применения для стен и потолков, создания перегородок:
- применяются для выравнивания стен и потолков;
- огнеупорны;
- влагостойки;
- подходят для декоративной отделки.
Экологичность связана с отсутствием в составе листа вредных веществ, таких как смолы и формальдегид, являющихся токсичными для человеческого организма.
Благодаря способности впитывать в себя капли воды из воздуха в помещениях с повышенной влажностью и отдавать их в помещениях с низким уровнем влажности поддерживается здоровый микроклимат в жилых помещениях.
Основные отличия листов из гипсокартона и гипсоволокна
Отличие ГВЛ от ГКЛ заключаются в разных показателях влагостойкости, огнеупорности, прочности, способности принимать нужную форму:
При выборе между гипсокартоновым и гипсоволокнистым листом необходимо обращать внимание на преследуемую цель.
- Что прочнее: ГКЛ или ГВЛ? Гипсокартон отличается большой хрупкостью и подверженностью деформациям, в то время как гипсоволокно очень прочно и может выдержать большие нагрузки, в него даже можно забивать гвозди.
- Гипсокартон легче ГВЛ и не такой прочный, поэтому его удобнее резать и монтировать. Из-за тяжести при креплении гипсоволокнистого листа на потолок нужно использовать подъемный
механизм. - Для того чтобы ГКЛ имел огнеупорные свойства, лист должен быть покрыт специальным составом, а ГВЛ уже огнеупорный изначально.
- Гипсокартон имеет относительную влагоустойчивость, портится от ее избытка. Гипсоволокнистый лист может быть применен в помещениях с повышенной влажностью, кроме саун и бассейнов.
- Гипсокартон легко принимает нужную форму и может быть использован для дизайнерских целей, гипсоволокнистый лист не гнется, образует только ровную поверхность.
- Гипсокартон перед оклейкой обоями нужно полностью шпаклевать, ГВЛ не имеет в этом необходимости, нужно обработать стыки и углы.

- ГКЛ со временем может утрачивать свою однородную структуру, и в помещении окажется гипсовая пыль. То же самое происходит и во время его обработки, что требует использования индивидуальных средств защиты во время работы.
- Гипсоволокно способно хорошо сохранять тепло, его можно использовать для утепления помещений.
- Гипсокартон имеет в своей структуре поры, способные пропускать воздух, поглощать и отдавать влагу. По сравнению с ГВЛ этот материал почти в 3 раза дешевле.
Исходя из этих данных, для разных комнат и целей предпочтение отдается одному или другому материалу в зависимости от того, какие свойства более предпочтительны в каждой конкретной ситуации.
Что выбираем для моделирования стен и утепления пола
ГВЛ или ГКЛ для стен выбирают, исходя из поставленных целей. Для простого выравнивания может подойти и тот и другой вариант. Для различных элементов, таких как арки, ниши, колонны, полки, применяется гипсокартон из-за его податливости к изменению формы. Также возможно использование современного варианта – декоративного гипсокартона, который имеет очень хороший внешний вид, не требует шпаклевания, сохраняет свои качества на протяжении 10 лет.
Также возможно использование современного варианта – декоративного гипсокартона, который имеет очень хороший внешний вид, не требует шпаклевания, сохраняет свои качества на протяжении 10 лет.
Для внешних работ – отделки, утепления здания – используется исключительно гипсоволокно, так как оно прочное, морозостойкое, влагостойкое. Функциональные перегородки тоже лучше делать из этого прочного листа. Для пола можно применять только ГВЛ, его кладут на основное цементное покрытие, а сверху застилают линолеумом или ламинатом.
Выбор того или иного материала зависит также от степени необходимости в шумоизоляции и огнеупорности. ГВЛ в этом плане имеет более высокие показатели, чем ГКЛ.
Какой материал лучше подойдет на потолок
ГКЛ или ГВЛ на потолок крепится с помощью шурупов на заранее подготовленный металлический каркас. Хотя листы из гипсоволокна тяжелее гипсокартонных, их все равно применяют для потолков, особенно если нужна повышенная шумоизоляция, влагоустойчивость или огнеупорность.
ГВЛ используют для выравнивания потолков или при моделировании двухуровневых конструкций, где ровную поверхность создает ГВЛ, а декоративную – ГКЛ или другие материалы.
Гипсокартон является более популярным материалом при отделке помещений.
Применение ГКЛ несет чаще эстетическую функцию. Из этого гнущегося материала создаются модели невообразимой красоты. Способность к изменению используется для воплощения различных дизайнерских разработок.
Разница в весе и плотности делает работу с применением ГВЛ более трудоемкой, также требуется использование дополнительных инструментов и механизмов, зато эти листы не нуждаются в шпаклевке всей поверхности.
Конструкции для ванной комнаты
То, что лучше для ванной применять гипсоволокнистые листы, не вызывает никаких сомнений. Они влагоустойчивы, способны противостоять испарениям без вреда для своей структуры, а также имеют в своем составе вещества, которые останавливают плесень и грибки. В ванной комнате прежде всего должны быть соблюдены гигиенические нормы, которым соответствует материал гипсоволокнистого листа.
Чтобы установить ГВЛ, понадобятся следующие инструменты: строительный уровень, дрель, набор шпателей, перфоратор, болгарка, шуруповерт, строительный нож, отвертка, молоток, плоскогубцы, подъемный механизм.
Для работы с ГКЛ необходимы: рулетка, шуруповерт, дрель, ножовка, шпатели, наждачка, шпаклевка, ведро, лестница, молоток, сверла, очки и респиратор для защиты от пыли.
Сравнение ГВЛ и ГКЛ приводит к таким выводам: и тот и другой материал хорош, соответственно, может быть использован, исходя из поставленных задач, личных предпочтений и ценовой политики.
ГВЛ или ГКЛ: что выбрать? Плюсы и минусы каждого из материалов
Строительные материалы на основе гипса часто используются в разнообразных строительных и ремонтных работах. Как показывает практика, гипсоволокно (ГВЛ) и гипсокартон (ГКЛ) имеют ряд преимущественных характеристик, но некоторые параметры у них отличаются. И это необходимо учитывать при выборе.
ГВЛ и ГКЛ: основные преимущественные показатели
Гипсокартон является одним из наиболее распространенных материалов, и пользуется огромным спросом у потребителей. Он обладает следующими достоинствами:
- Хорошие звукоизоляционные характеристики;
- Способен при повышенной влажности впитывать в себя излишки, а потом отдавать их;
- Простота в монтаже и возможность использования для отделки помещений с нестандартными формами.
Гипсоволокно является достойным аналогом ГКЛ, однако отличается более высокой прочностью и надежностью. В целом, материал характеризуется следующими достоинствами:
- Отсутствие в составе ГВЛ формальдегидов и смол, что повышает уровень экологической безопасности материала;
- Устойчивость к переменчивым погодным условиям. Материал способен выдерживать сильную жару и низкие температуры;
- Имеет достойные звуко- и теплоизоляционные параметры.
Сравнительная характеристика ГВЛ и ГКЛ
При выборе подходящего материала его следует проанализировать по конкретным параметрам, среди которых:
- Прочность. По данному показателю ГВЛ имеет существенные преимущества, так как изначально характеризуется повышенной прочностью. Гипсоволокно выдерживает сильные нагрузки, в то время как ГКЛ может начать крошиться.
- Простота работы. По данному критерию незначительное превосходство у ГКЛ. Лист гипсокартона имеет небольшую массу, и потому при его установке не возникнет никаких проблем, а благодаря своим свойствам, материал может быть использован для создания сложных конструкций.
- Экологическая составляющая. Оба материала не содержат опасных химических компонентов, однако, с течением времени ГКЛ теряет прочность, из-за чего появляется гипсовая пыль, способная доставить значительный дискомфорт людям, особенно если они страдают легочными заболеваниями.
Устойчивость к повышенной влажности и воздействию огня. ГВЛ имеет изначально высокие показатели противопожарной безопасности и устойчив к влаге. Однако, он нуждается в дополнительной отделке и обработке грунтовкой. В то же время, ГКЛ способен впитывать влагу, из-за чего нельзя использовать его в условиях постоянной повышенной влажности. Что же касается огнеупорности, то гипсокартон необходимо дополнительно обрабатывать специальными веществами. В продаже листы материала с повышенной устойчивостью к воздействию огня имеют маркировку ГКЛО.
в чем отличие и что лучше, характеристики
При выполнении внутренней отделки помещений все более популярными становятся «сухие» технологии, позволяющие ускоренными темпами выровнять поверхности и уменьшить количество операций. Поэтому повышенным спросом пользуются гипсокартонные и гипсоволокнистые листы. ГКЛ значительно отличается от ГВЛ характеристиками и сферой применения.
Оглавление:
- Технические параметры гипсокартона
- Особенности гипсоволокнистых плит
- Что выбрать для разных помещений?
- Цена Knauf и Gyproc
В чем разница материалов?
Оба вида изготавливают на основе гипсового камня – природного минерала осадочного происхождения, состоящего из гидрата сульфата кальция. Порошок, полученный путем дробления камня, называют строительным гипсом. Из него производят строительные смеси, а также ГКЛ и ГВЛ, используемые для внутренних работ.
Гипсокартонный лист
Изделие представляет собой сердечник (плиту, сформованную из гипса с добавлением специального наполнителя), покрытый с двух сторон картоном. Картонный слой придает гладкость и делает его прочнее. Предназначен исключительно для применения в помещениях, поскольку он недостаточно устойчив к влаге и нагрузкам. Можно выровнять стены, годится для изготовления подвесных потолков, легких межкомнатных перегородок.
При выборе обращают внимание, к какой категории он относится:
- ГКЛ – стандартный; рассчитан на низкую и нормальную влажность в помещениях;
- ГКЛО – с огнестойкой пропиткой; служит для обшивки каркасных домов, межэтажных перекрытий, шахтных стен, несущих металлических систем, изоляции наружных конструкций с внутренней стороны;
- ГКЛВ – специальный влагостойкий, с низкими показателями водопоглощения; для отделки кухонь, санузлов.
Достоинства ГКЛ:
- Экологическая безопасность. Ни сердцевина, ни картонная «обертка» не содержат вредных для здоровья веществ (например, формальдегидов).
- Огнестойкость. Она обусловлена высоким содержанием химически связанной воды (до 2 литров в плите). Пока она не превратится в пар, температура на другой стороне не поднимется выше 100°. Стандартные ГКЛ выдерживают 20 мин пожара до разрушения, а ГКЛО – 50 минут.
- Регулирование уровня влажности. Благодаря пористой структуре стены поглощают избыточную влагу, а если в помещении становится слишком сухо, то выделяют ее.
- Податливость в обработке. Отлично гнется, позволяя осуществить самые невероятные дизайнерские идеи. Из влажного гипсокартонного листа создают своды арок и другие выпуклые формы. Плиты хорошо режутся острым ножом или болгаркой и подгоняются в размер, облегчая монтаж колонн и ниш.
- Легкость нанесения покрытий. Стены несложно шпаклевать, красить и грунтовать – этому способствует гладкая поверхность.
Низкая прочность структуры не позволяют использовать молоток и гвозди в процессе навешивания на стены: лучше воспользоваться клеем или саморезами с дюбелями. Для повышения жесткости чаще всего крепят на металлический каркас из профиля.
Гипсоволокнистые листы
Их производят методом полусухого прессования из смеси гипса и распушенной целлюлозной макулатуры, которая армирует и упрочняет. Стандартные ГВЛ имеют следующие размеры: толщина – 10 или 12,5 мм, ширина – 1200 (1000) мм, длина – 2500 (1500) мм. В скобках указаны габариты малоформатных плит.
Делят на три группы:
- стандартный (ГВЛ) для отделки помещений с нормальной влажностью;
- влагостойкий (ГВЛВ) – благодаря пропитке, подходит для ванных комнат и кухонь;
- элементы для укладки пола (ГВЛ ЭП) – для формирования сборных оснований под напольные покрытия.
Листы бывают нешлифованными (НШ), либо шлифованными и грунтованными с лицевой стороны (Ш). Стены, обшитые вторым вариантом, не нужно грунтовать перед нанесением декоративных покрытий.
Технические характеристики:
- ГВЛ обладают повышенной твердостью и прочностью, они не нуждаются в армирующем каркасе, саморезы вкручиваются в них без дюбелей. Плохо поддаются гибке при изготовлении арок, но не прогибаются под весом человека.
- Гипсоволокно картоном не покрывают, поэтому оно устойчиво даже к открытому огню. Негорючим материалом можно обшивать деревянные конструкции.
- Плотные, массивные плиты отлично выдерживают перепады температур: они хорошо противостоят появлению трещин даже после 15 циклов замораживания-размораживания.
- Низкая теплопроводность в сочетании с термостойкостью обуславливает применение в роли теплоизолятора.
- ГВЛ хорошо поглощает звук, уменьшая уровень шума в помещении на 35-40 Дб.
- Влагостойкий тип, находясь в воде в течение суток, набирает всего 1,5 % влаги.
Гипсоволокно «дышит» так же, как и гипсокартон: поглощает излишки влаги в сырой комнате и отдает ее, когда воздух становится сухим.
ГВЛ привлекает застройщиков более крепкой структурой: именно она противостоит разрушению материала. ГКЛ со временем начинают сыпаться, превращаясь в пыль, которая незаметно попадает в органы дыхания. Плиты из ГВ более практичны благодаря устойчивости к изгибу и сжатию, за счет массивности, хорошей теплоемкости, отличных звукоизоляционных характеристик. Если гипсокартону присущи декоративные качества, то гипсоволокно способно выдерживать значительные нагрузки. Армированный лист используют не только в частном жилье, но и во время ремонта служебных, производственных, общественных помещений.
Различия во влагостойкости заставляют делать выбор в пользу ГВЛ (особенно ГВЛВ). Пожаробезопасность заметно выше, чем у обычного ГКЛ: возгорание тормозится за счет физических характеристик.
ГВЛ или гипсокартон на стены и пол, что лучше использовать?
1. Отделка производственных помещений. Поскольку гипсоволокно лучше сопротивляется огню, то в цехах поверхности желательно облицевать именно эти материалом.
2. Функциональные межкомнатные перегородки. Сравнение по прочности со значительным перевесом выигрывают листы, армированные целлюлозой, поэтому для надежной и длительной эксплуатации лучше предпочесть ГВЛ.
3. Декоративные перегородки, арки, фигурные конструкции. Подобные дизайнерские идеи воплощают только с помощью ГКЛ: преимущество им обеспечивают различия с ГВЛ по гибкости.
4. Потолки. Для создания многоуровневых подвесных систем чаще применяют не гипсоволокно, а более легкий гипсокартон.
5. Теплоизоляционная отделка. Чтобы обшить стены на даче или в доме со слабым отоплением, используют гипсоволокно.
6. Утепление пола. Подойдут только прочные ГВЛ, основой для которых служат дерево, бетон, керамзит. Армированная плита послужит теплоизолятором, каркасом, огнезащитой для чистового пола – паркета, ламината, линолеума.
7. Отделка влажных помещений. ГВЛ в этой сфере применяется почти без ограничений, а гипсокартон – только при наличии маркировки ГКЛВ.
Стоимость листовых материалов из гипса
Ценовая составляющая при выборе лучшего варианта тоже играет роль. Гипсоволокно стоит несколько дороже, но это оправдано его качественными показателями. В таблице приведены средние по Москве цены:
| Наименование | Размеры, мм | Цена, рубли |
| ГКЛ Gyproc Стронг | 2500х1200х15 | 370 |
| ГКЛВ Gyproc Аква Стронг | 2500х1200х15 | 450 |
| ГВЛВ Кнауф | 1200х1200х10 | 230 |
| ГВЛВ Кнауф | 2500х1200х12,5 | 500 |
что лучше и в чем разница
Традиционно для создания каркасных систем используется гипсокартон. Его использование дает множество преимуществ, среди которых особое место занимает возможность формирования многоуровневых конструкций потолков и получение идеально ровных поверхностей. Высокая практичность сделала его практически незаменимым. Однако прогресс не стоит на месте и не так давно на рынке появился еще один материал, который по своим свойствам не уступает гипсокартону, а в некоторых аспектах даже превосходит его.
В связи с этим у многих возникает вопрос, что лучше гипсоволокно или гипсокартон. Ответить на него не так уж и просто, поскольку оба материала имеют как положительные, так и отрицательные стороны.
Вернуться к оглавлениюПолное содержание материала
Гипсокартон: состав, преимущества и недостатки материала
Гипсокартон появился на нашем рынке около 20 лет назад и буквально сразу приобрел высокую популярность среди строителей, а чуть позже стал использоваться повсеместно. На сегодняшний день популярность гипсокартона практически безгранична, а сфера его применения не ограничивается отделкой стен гипсокартоном. Состоит он всего из двух компонентов — гипса и картона, который формирует плотную оболочку и не дает материалу разваливаться.
Так выглядят листы гипсокартонаСтандартный размер гипсокартонного листа (ГКЛ) составляет 2500*1200 при толщине 9,5 мм. Подобные геометрические параметры являются оптимальными для внутренней отделки дома, поскольку позволяют перекрывать огромные площади за небольшой промежуток времени. Кроме этого, к преимуществам гипсокартона можно отнести:
- Не токсичность.
- Экологичность.
- Небольшой вес покрытия.
- Простоту монтажа.
- Хорошее звукоотражение.
- Низкую теплопроводность.
- Пластичность и возможность резки ГКЛ.
Подобные качества сделали гипсокартон одним из лучших материалов для внутренней отделки помещений. Он легкий и легко режется, что дает возможность создавать из него разнообразные по своей сложности объекты.
Кроме того, он легко гнется и хорошо держит заданную форму. Выпускается он в трех вариациях — обыкновенный (ГКЛ), огнестойкий (ГКЛО) и влагостойкий гипсокартон (ГКЛВ). Однако есть у подобного материала и несколько недостатков, которые заключаются в следующем:
- низкая способность противостоять поперечным нагрузкам;
- изменение структуры под воздействие влаги;
- невысокие несущие качества.
По своей структуре материал не является особенно хрупким, но из-за большой площади листа он частенько ломается. Кроме того, под воздействием влаги картон размокает, и материал теряет свою форму.
Схема устройства листов гипсокартонаПри этом на готовую поверхность нельзя закреплять никакую мебель без проведения дополнительного усиления.
Вернуться к оглавлениюГипсоволокно: структура материала и его положительные стороны
Недостатки гипсокартона послужили отправной точкой для разработки более прочного, но в то же время не менее практичного материала. Им стало гипсоволокно, вобравшее в себя все преимущества ГКЛ и позволившее устранить большинство недостатков. Структура подобного материала существенно отличается от своего родителя и состоит из следующих компонентов:
- гипса;
- целлюлозных волокон;
- перлита;
- двойных стекловолоконных листов.
Главным отличием от гипсокартона служит отсутствие бумажного основания, поддерживающего целостность материала.
В гипсоволокнистых листах его роль выполняет стекловолоконная сетка, которая накладывается на гипсово-целлюлозное основание и удерживает его от распада. Для повышения прочности готового материала, поверх сетки наносится небольшой слой гипса, обеспечивающий его армирование с обеих сторон. При этом стандартная толщина листа составляет всего 10 мм при размере 2500*1200 мм.
Схема устройства гипсоволоконного листаСуществующие размеры гипсоволоконных листовИз положительных качеств материала можно отметить:
- Высокую прочность.
- Хорошую несущую способность.
- Огнестойкость.
- Низкую теплопроводность.
- Высокое звукоотражение.
- Простоту монтажа.
- Пластичность.
- Экологичность.
Готовый материал имеет пористую структуру и не отличается гладкостью. Исходя из этого, единственным его недостатком служит необходимость полного шпаклевания поверхности гипсокартона. Сегодня гипсоволокно выпускается в двух основных вариациях — обыкновенный (ГЛВ) и влагостойкий (ГВЛВ).
Вернуться к оглавлениюГипсоволокно и гипсокартон: главные различия и сравнение материалов
Сравнивать гипсоволокно и гипсокартон можно долго, поскольку каждому материалу присущи определенные достоинства, определяющие сферу их применения. При этом нельзя забывать о том, что они имеют сходную структуру за небольшими отличиями. Поэтому точно сказать, что лучше гипсокартон или гипсоволокно, не является возможным. Первый из них может использоваться в таких местах, которые нельзя отделывать вторым и наоборот.
Технические характеристики гипсоволоконных листовТаблица отличий гипсокартона от гипсоволокнаГипсоволокно обладает высокой пластичностью и гораздо лучше изгибается. Благодаря этому свойству из него можно формировать небольшие закругления и закрывать переходы между стенами.
При этом гипсокартон менее пластичен в сухом виде, но если его намочить, то ему можно предавать любые формы. Главное следить за целостностью бумажного слоя и сделать арку своими руками или волну на стене или потолке не составит большого труда.
Оба материала отличаются хорошей паропроницаемостью, поскольку их основой является гипс. Мельчайшие частички влаги способны просачиваться сквозь материал, не изменяя его структуры. Зато влагостойкость существенно выше у гипсоволокна, поскольку его верхний слой покрывается специальным водоотталкивающим веществом, а стекловолокно не настолько восприимчиво к воздействию влажной среды, как картон, который быстро размокает и теряет свои свойства.
Конструкция гипсоволоконного листа
Благодаря высокой плотности, гипсоволокно способно выдерживать большие нагрузки. Его нередко используют для формирования подложки под напольное покрытие, поскольку он не изменяет своей структуры под давлением мебели, а сломать его крайне сложно. В этом и есть наибольшее отличие от гипсокартона, который не способен выдерживать поперечные нагрузки. В целом, понять разницу между этими двумя материалами поможет следующая таблица:
| Материал/характеристика | Гипсокартон (ГКЛ) | Гипсоволокно (ГЛВ) |
| Площадь листа, м.кв. | 3 | 3 |
| Прочность, кг/м.кв. | 30 | 120 |
| Прочность на изгиб, МПа | 2,8 | 5,5 |
| Теплопроводность | 0,22–0,35 | 0,24–0,35 |
| Класс пожаробезопасности | 2 | 1 |
| Гигроскопичность | высокая | высокая |
| Звукоизоляция, Дб | 35–40 | 35–40 |
| Толщина листов, мм | 9,5–12,5 | 10–20 |
| Покрытие | гладкое | пористое |
Приведенная выше таблица в наилучшей мере характеризует свойства обоих материалов. Как видим, большинство основных показателей отличаются не существенно.
Наиболее весомым различием служит прочность гипсоволоконного листа и способность выдерживать колоссальные нагрузки, что существенно расширяет его сферу использования. В видео рассказывается о главных отличиях гипсоволокна от гипсокартона.
Вернуться к оглавлениюЗаключение
Гипсоволокно появилось на рынке относительно недавно, но уже успело завоевать популярность среди строителей и простых людей. По своей структуре этот материал напоминает гипсокартон, у которого вместо бумажного основания оболочка из стекловолокна. Кроме того, в его состав входят древесные волокна, обеспечивающие листу повышенную прочность и плотность. Подобные свойства дают возможность использовать гипсоволокно в качестве подложки при формировании пола, отводя гипсокартону роль сугубо отделочного материала.
Вернуться к оглавлениюПодборка фото оформления помещений гипсоволокном
Разница между главной книгой и пробным балансом — AccountingTools
Что такое Главная книга?
Главная книга — это основной набор счетов, в котором резюмируются все транзакции, происходящие внутри организации. Главная книга состоит из всех индивидуальных счетов, необходимых для записи активов, обязательств, капитала, доходов, расходов, прибылей и убытков предприятия.
Что такое пробный баланс?
Пробный баланс — это отчет, запускаемый в конце отчетного периода, в котором указывается конечное сальдо каждого счета главной книги.Отчет в первую очередь используется для обеспечения того, чтобы сумма всех дебетований равнялась сумме всех кредитов, что означает, что в системе бухгалтерского учета нет несбалансированных записей журнала, которые сделали бы невозможным создание точных финансовых отчетов.
Сравнение главной книги и пробного баланса
Существует ряд различий между главной книгой и пробным балансом, а именно:
Объем информации . Главная книга содержит подробные транзакции, включающие все счета, в то время как пробный баланс содержит только конечный баланс каждого из этих счетов.Таким образом, главная бухгалтерская книга может занимать несколько сотен страниц, а пробный баланс — всего несколько страниц.
Использование . Главная книга используется в качестве основного источника информации финансовыми бухгалтерами, когда они исследуют счета. Пробный баланс имеет гораздо более ограниченное использование, когда общие суммы всех дебетов и кредитов сравниваются, чтобы убедиться, что бухгалтерские книги находятся в балансе.
Использование аудитора . Аудиторы запрашивают копию пробного баланса в рамках аудита на конец года, чтобы у них были окончательные остатки по всем счетам.Они используют главную книгу для другой цели, а именно для отслеживания остатков до отдельных транзакций.
Характер информации . Главная книга считается базой данных о бухгалтерских операциях, тогда как пробный баланс — это просто отчет, полученный из главной книги.
Сопутствующие курсы
Пакет обучения бухгалтеров
Справочник по бухгалтерскому учету
Google добавлен в IAB TCF 2.0 Framework GVL | Блог
Теперь Google внесен в список активных поставщиков в Глобальном списке поставщиков (GVL) IAB Transparency and Consent Framework (TCF) 2.0 для рекламных продуктов Google.
Google теперь включен в список активных поставщиков IAB Transparency and Consent Framework (TCF) 2.0 Global Vendor List (GVL) для рекламных продуктов Google.
До крайнего срока обновления IAB TCF 2.0 остается всего месяц. До 15 августа представители СМИ и рекламной индустрии пересекут свои границы и расставят точки над i, чтобы убедиться, что они внесли необходимые изменения в свои CMPS в соответствии с TCF 2.0 рекомендаций.
В условиях нехватки времени, длившейся месяц, Google официально присоединился к IAB TCF 2.0 GVL для рекламных продуктов Google. Организации ожидали, что Google войдет в список GVL — это долгожданная интеграция.
Обзор интеграции
Что это значит? Теперь, когда Google указан как активный поставщик на GVL, он может считывать захват строк согласия с помощью IAB TCF 2.0. Благодаря интеграции ведущего поставщика рекламных технологий показ рекламы Google теперь будет напрямую соответствовать структуре без какой-либо дополнительной настройки.
Это огромное преимущество для клиентов CookiePro. Благодаря поддержке CookiePro для IAB TCF 2.0 все существующие клиенты, использующие структуру IAB TCF 2.0, смогут автоматически работать с Google. Теперь Google будет частью списка поставщиков, из которых организации могут выбирать в рамках своего CMP, созданного CookiePro.
Использование ведущего CMP для IAB TCF 2.0
Издатели и рекламодатели любого размера могут использовать CookiePro для создания и развертывания специализированного CMP, который фиксирует, хранит и передает согласие ниже по потоку поставщикам рекламных технологий.
В качестве CMP, одобренного IAB Europe TCF 2.0, организации могут использовать бесплатную программу CookiePro TCF 2.0 CMP Builder для создания и настройки своего собственного CMP, чтобы предпринять шаги в направлении соответствия новой структуре.
Все издатели должны перейти на TCF 2.0 до 15 августа 2020 г. Не ждите, чтобы начать!
IFN типа I контролируют реакции GVHD и GVL после трансплантации | Кровь
Хотя аллогенная трансплантация костного мозга является лечебной терапией для большинства гематологических злокачественных новообразований, ее применение ограничено развитием РТПХ.GVHD является результатом иммунологического повреждения ткани хозяина аллореактивными Т-клетками из поступающего донорского трансплантата. К сожалению, развитие вредной GVHD тесно связано с терапевтическими ответами GVL. GVL-ответы важны для искоренения остаточного злокачественного новообразования хозяина и в первую очередь опосредуются аллореактивными донорскими Т-клетками и естественными киллерами (NK). Срочно необходимы терапевтические подходы для разделения этих явлений.
IFN были впервые обнаружены в результате их способности придавать клеткам устойчивость к вирусной инфекции. 1 Существует 2 различных типа IFN, тип I и тип II, и хотя обе группы индуцируют механизмы противовирусной защиты в клетках, в первую очередь за счет ограничения репликации, они проявляют различные иммунологические свойства. После отторжения аллотрансплантата хорошо установлено, что IFN-γ типа II является доминантным цитокином Th2, оказывая плеотропные эффекты как на гематопоэтические, так и негематопоэтические клетки. Важно отметить, что IFN-γ оказывает различное действие как на донорскую, так и на ткань хозяина, с преобладающей защитной ролью при GVHD легких и патогенными эффектами в желудочно-кишечном тракте. 2-4 Кроме того, клеточные субпопуляции, продуцирующие IFNγ, и время продукции также могут влиять на эффект цитокина после трансплантации BM. 5 Напротив, роль IFN типа I после трансплантации BM остается в значительной степени неизвестной.
Все IFN типа I действуют через один и тот же рецептор, который состоит из 2 субъединиц, IFNAR1 и IFNAR2, 6 и экспрессируется практически на всех клетках. 7 Тип I-IFN охватывает большое семейство цитокинов, которое включает один изотип IFN-β,> 13 изотипов IFN-α и множество других, менее описанных подтипов. 8 Было продемонстрировано, что некоторые подтипы IFN проявляют большую активность, чем другие, с хорошей корреляцией между противовирусной активностью и антипролиферативным действием. Однако, учитывая, что они передают сигнал через один и тот же рецепторный комплекс, непонятно, как это могло произойти. 9 Для решения вопроса о роли типа I-IFNs после трансплантации BM мы использовали мышей с дефицитом IFNAR1 компонента рецептора типа I-IFN в качестве доноров или реципиентов после миелоаблативного кондиционирования.Мы демонстрируем, что передача сигналов типа I-IFN у реципиентов защищает от CD4-зависимой GVHD, тогда как передача сигналов донора усиливает защитные ответы GVL. Эти исследования показывают, что тщательно спланированное по времени введение этого цитокина в условиях клинической трансплантации костного мозга может быть полезным.
Опухолевые линии P815 (H-2D d , DBA / 2), EL4 (H-2D b , B6), P210 (H-2D k , C3H), A20 (H-2D b , Balb / c) и 5GTM1 (H-2D d , C57BL / KaLwRij).Трансфицированные люциферазой клеточные линии мастоцитомы P815 или EL4 вводили внутривенно реципиентам B6D2F1 или B6, соответственно, в день трансплантации. Следили за выживаемостью и клиническими показателями. Мышей еженедельно визуализировали с помощью системы визуализации Xenogen (Xenogen IVIS 100; Caliper Life Sciences) для определения уровня опухолевой нагрузки. Смерть от лейкемии была определена как значительная опухолевая нагрузка, оцененная с помощью визуализации (> 10 6 фотонов / с / см 2 / ср) и / или развитие паралича задних конечностей (из-за хлоромы P815 внутри позвонков).Смерть от GVHD определялась как низкая опухолевая нагрузка (<10 6 фотонов / с / см 2 / sr) и значительный балл GVHD (> 5).
Чтобы определить роль передачи сигналов типа I-IFN у реципиентов после трансплантации BM, мы трансплантировали BM и Т-клетки от доноров BALB / c.WT смертельно облученным реципиентам B6.WT или B6.IFNAR1 — / — . РТПХ была значительно увеличена у реципиентов, неспособных реагировать на IFN типа I, по сравнению с B6.Получатели WT (рисунок 1A). Это раннее увеличение РТПХ у реципиентов IFNAR1 — / — было зависимым от CD4, что продемонстрировано трансплантацией Т-клеток CD4 + только внутри донорского трансплантата (рис. 1B). Важно отметить, что во время смертности от РТПХ реципиенты WT и IFNAR1 — / — имели эквивалентные уровни донорского приживления (донорский CD4 + : 98,7% ± 0,5% против 96,7% ± 1,6% соответственно, P = 0,33). ). После трансплантации CD8 + Т-клеток только в донорский трансплантат наблюдалось развитие РТПХ низкой степени, и не наблюдалось различий между реципиентами WT или IFNAR1 — / — при оценке выживаемости (рис. 1C) или клинических показателей ( день 50 = 0.7 ± 0,7 против 0 ± 0 соответственно, P = NS).
Рисунок 1
Передача сигналов IFN типа I ингибирует GVHD, нацеленную на толстую кишку, в несоответствующей MHC модели трансплантации BM. Выживаемость смертельно облученных мышей B6.WT или B6.IFNAR1 — / — мышей, перенесших трансплантацию в день 0, с 10 7 BM и либо (A) 5 × 10 6 CD3 + T-клеток (* P <.05 B6.WT против B6.IFNAR1 — / -) , (B) 3 × 10 6 CD4 + только Т-клетки (** P <0,01, B6.WT против B6.IFNAR1 — / — ), или (C) 2 × 10 6 CD8 + Т-клеток только от доноров BALB / c.WT. На панели C сингенные группы получили 10 7 BM и 5 × 10 6 CD3 + Т-клеток от доноров B6.WT. Объединенные данные из 2 экспериментов; n = 13-14 в группах BM + T, n = 4-6 в TCD или сингенных контрольных группах. (D) После трансплантации, как на панели A, на 7 день были взяты гистологические образцы и количественно оценена гистопатология GVHD в органах-мишенях, толстой кишке ( # P <.005, B6.WT против B6.IFNAR1 — / — ), тонкий кишечник, печень и легкое. В TCD баллы равны 0, столбцы не видны. (E) Типичные изображения гистологии толстой кишки (увеличение × 250). (F) Смертельно облученные B6.WT или B6.IFNAR1 — / — реципиенты получили BALB / c.WT BM (10 7 ) + BALB / c luc + Т-клеток (5 × 10 6 ). Люминесценцию количественно оценивали на 7 день после трансплантации в млN и желудочно-кишечном тракте, как показано (** P <0,01, n = 5 на группу).
Рисунок 1
Передача сигналов IFN типа I ингибирует GVHD, нацеленную на толстую кишку, в несоответствующей MHC модели трансплантации BM. Выживание смертельно облученных B6.WT или B6.IFNAR1 — / — мышей, перенесших трансплантацию в день 0, с 10 7 BM и либо (A) 5 × 10 6 CD3 + T-клеток (* P <0,05 B6.WT по сравнению с B6.IFNAR1 — / -) , (B) 3 × 10 6 CD4 + только Т-клетки (** P <0,01, B6.WT по сравнению с B6. IFNAR1 — / — ) или (C) 2 × 10 6 CD8 + Т-клеток только от доноров BALB / c.WT. На панели C сингенные группы получили 10 7 BM и 5 × 10 6 CD3 + Т-клеток от B6.Доноры WT. Объединенные данные из 2 экспериментов; n = 13-14 в группах BM + T, n = 4-6 в TCD или сингенных контрольных группах. (D) После трансплантации, как на панели A, на 7 день были взяты гистологические образцы и количественно оценена гистопатология GVHD в целевых органах, толстой кишке ( # P <0,005, B6.WT против B6.IFNAR1 — / — ), тонкий кишечник, печень и легкие. В TCD баллы равны 0, столбцы не видны. (E) Типичные изображения гистологии толстой кишки (увеличение × 250). (F) Смертельно облученный B6.WT или B6.IFNAR1 — / — получатели получали BALB / c.WT BM (10 7 ) + BALB / c luc + Т-клетки (5 × 10 6 ). Люминесценцию количественно оценивали на 7 день после трансплантации в млN и желудочно-кишечном тракте, как показано (** P <0,01, n = 5 на группу).
Чтобы подтвердить, что эти эффекты не были результатом дифференциальной восприимчивости к облучению, мы включили как B6.WT, так и B6.IFNAR1 — / — реципиентов сингенных трансплантатов в качестве контроля, которые все выжили в течение длительного времени после трансплантации BM (рис. 1C). При количественной оценке гистопатологии GVHD в органах-мишенях было показано, что повышенная смертность у реципиентов B6.IFNAR1 — / — связана с селективной индукцией тяжелой GVHD в толстой кишке (рис. 1D-E). Чтобы определить, было ли это связано с увеличением инфильтрации донорских Т-клеток в желудочно-кишечном тракте, мы выполнили трансплантации Т-клеток от доноров BALB / c luc + .Когда мы визуализировали реципиентов на 7 день после трансплантации, у реципиентов B6.IFNAR1 — / — наблюдалось увеличение экспансии Т-клеток в мезентериальном лимфатическом узле (mLN) (рис. 1F). Хотя никакой разницы в инфильтрации Т-клеток во весь желудочно-кишечный тракт не наблюдалось (рис. 1F), преобладающий сигнал был из тонкой кишки, и, таким образом, анализ не смог выявить различия в инфильтрате Т-клеток селективно в толстой кишке.
Затем мы оценили уровни воспалительных цитокинов в B6.IFNAR1 — / — реципиентов во время РТПХ. Это продемонстрировало значительное увеличение IFN-γ, TNF, IL-17A и IL-5 в сыворотке в первую неделю после трансплантации (рис. 2A). При оценке с помощью разведения CFSE через 4 дня после трансплантации было показано, что донорские CD4 + Т-клетки от реципиентов B6.IFNAR1 — / — претерпевают усиленную пролиферацию (Рисунок 2B), присутствуют в значительно большем количестве в селезенке (Рисунок 2C). ) и продуцировал больше IFN-γ и IL-17A (рис. 2D). Напротив, количество донора T reg в селезенке было увеличено в B6.IFNAR1 — / — получателей (4,5 × 10 4 ± 0,3 × 10 4 против 3,1 × 10 4 ± 0,2 × 10 4 , P = 0,03), что позволяет предположить, что тип I-IFN не ускорял острую GVHD, подавляя рост этой регуляторной популяции. Таким образом, реципиенты IFNAR1 — / — аллогенных трансплантатов умирают в течение первых 10 дней после трансплантации BM с гистологическим подтверждением тяжелой GVHD в толстой кишке одновременно с высокими уровнями воспалительных цитокинов, что соответствует эффекторному пути, который, как известно, является критическим для кишечника РТПХ. 16 Чтобы оценить вклад увеличения продукции IL-17A донорскими CD4 + T-клетками в развитие GVHD, мы выполнили трансплантации, при которых донорский трансплантат был неспособен продуцировать IL-17A. Это ослабляло большую часть усиленной GVHD в отсутствие передачи сигналов типа I-IFN; однако выживаемость все еще не была эквивалентна выживаемости у реципиентов B6.WT, что указывает на другие факторы, вероятно, высокие одновременные уровни цитокинов Th2 также способствовали усилению GVHD (рис. 2E).
Рисунок 2
Передача сигналов IFN типа I предотвращает пролиферацию и дифференцировку донорских Т-клеток после трансплантации. Смертельно облученным мышам B6.WT или B6.IFNAR1 — / — трансплантировали Т-клетки WT.BALB / c BM и CD3 + . (A) Сыворотка была взята у мышей на 4-й день (IFN-γ) и 7-й день (TNF, IL-17A и IL-5), и уровни цитокинов были определены количественно с помощью цитометрического набора гранул (IFN-γ, TNF и IL-5). ) или ELISA (IL-17) через 4 дня после трансплантации с BALB / c.WT BM и BALB / c.CD45.1 + CFSE-меченные донорские клетки. (B) Индексы пролиферации донорских CD4 + Т-клеток в селезенке рассчитывали с помощью программного обеспечения ModFit Version LT3.2 (объединенные данные из 2 экспериментов; # P <0,005; n = 8 на группу). (C) Донорские CD4 + Т-клетки были подсчитаны в селезенке (объединенные данные из 2 экспериментов; ** P <0,01; n = 8 на группу), и (D) стимулировали в течение 5 часов ex vivo и окрашивали для IFNγ и IL-17A (графики, представляющие 2 эксперимента и отображенные как среднее ± стандартная ошибка среднего, n = 8 на группу).(E) Выживание смертельно облученных мышей B6.WT или B6.IFNAR1 — / — , перенесших трансплантацию 10 7 BM и 5 × 10 6 CD3 + Т-клеток от BALB / c.WT или BALB /c.IL-17A — / — доноров ( # P <.001, BALB / c.IL-17A — / — → B6.IFNAR1 — / — по сравнению с обоими BALB / c. WT → B6.IFNAR1 — / — и BALB / c.IL-17A — / — → B6.WT; кривые выживаемости представляют собой оценки Каплана-Мейера из 2 экспериментов; n = 8-16 на группу).
Рисунок 2
Передача сигналов IFN типа I предотвращает пролиферацию и дифференцировку донорских Т-клеток после трансплантации. Смертельно облученным мышам B6.WT или B6.IFNAR1 — / — трансплантировали Т-клетки WT.BALB / c BM и CD3 + . (A) Сыворотка была взята у мышей на 4-й день (IFN-γ) и 7-й день (TNF, IL-17A и IL-5), и уровни цитокинов были определены количественно с помощью цитометрического набора гранул (IFN-γ, TNF и IL-5). ) или ELISA (IL-17) через 4 дня после трансплантации с BALB / c.WT BM и BALB / c.CD45.1 + CFSE-меченные донорские клетки. (B) Индексы пролиферации донорских CD4 + Т-клеток в селезенке рассчитывали с помощью программного обеспечения ModFit Version LT3.2 (объединенные данные из 2 экспериментов; # P <0,005; n = 8 на группу). (C) Донорские CD4 + Т-клетки были подсчитаны в селезенке (объединенные данные из 2 экспериментов; ** P <0,01; n = 8 на группу), и (D) стимулировали в течение 5 часов ex vivo и окрашивали для IFNγ и IL-17A (графики, представляющие 2 эксперимента и отображенные как среднее ± стандартная ошибка среднего, n = 8 на группу).(E) Выживание смертельно облученных мышей B6.WT или B6.IFNAR1 — / — , перенесших трансплантацию 10 7 BM и 5 × 10 6 CD3 + Т-клеток от BALB / c.WT или BALB /c.IL-17A — / — доноров ( # P <.001, BALB / c.IL-17A — / — → B6.IFNAR1 — / — по сравнению с обоими BALB / c. WT → B6.IFNAR1 — / — и BALB / c.IL-17A — / — → B6.WT; кривые выживаемости представляют собой оценки Каплана-Мейера из 2 экспериментов; n = 8-16 на группу).
Поскольку передача сигналов физиологического типа I-IFN ослабляет функцию донорских Т-клеток, мы исследовали, может ли это подавляться в дальнейшем введением экзогенного рекомбинантного мышиного IFNα. Мы использовали модель BALB / c → B6 и лечили реципиентов в день -1, так что регуляторные эффекты индуцировались только в ткани реципиента, а цитокин очищался до того, как любые потенциальные ингибирующие эффекты могли быть оказаны непосредственно на донорский трансплантат.Обработка IFN-α приводила к значительному подавлению уровней IFN-γ в сыворотке и экспансии донорских CD4 + Т-клеток в селезенке (рис. 4A). Чтобы подтвердить, что IFNα действует только на ткань хозяина, мы включили контроли, в которых IFNα также вводили реципиентам IFNAR1 — / — и не продемонстрировали никакого влияния на IFNγ в сыворотке по сравнению с реципиентами, получавшими физиологический раствор (рис. 4A). Когда оценивали продукцию IFNγ Т-клетками CD4 + , процент CD4 + T-клеток, продуцирующих IFNγ, существенно не отличался (фиг. 4B).Однако абсолютное количество CD4 + Т-клеток, продуцирующих IFNγ в селезенке, и количество, которое они продуцируют, как оценивается по средней интенсивности флуоресценции, было значительно ниже после обработки IFNα (рис. 4C).
Рисунок 4
Лечение IFN-α перед трансплантацией подавляет дифференцировку Th2 и защищает от GVHD. Реципиент B6.WT или B6.IFNAR1 — / — мыши получали либо IFN-α, либо физиологический раствор сразу после облучения всего тела, и на следующий день им трансплантировали BM + Т-клетки из BALB / c.CD45.1 + доноров. (A) Уровни цитокинов IFN-γ в сыворотке были оценены (объединенные данные из 2 экспериментов; # P <0,005, физиологический раствор против IFN-α, n = 11, 11, 7, 7) и донорский CD4 + Через 4 дня в селезенке было подсчитано Т-клеток (объединенные данные из 2 экспериментов; ** P <0,01, физиологический раствор против IFN-α; n = 6 на группу). (B) Продукцию IFN-γ Т-клетками CD4 + , стимулированными ex vivo в течение 5 часов, определяли путем окрашивания внутриклеточных цитокинов. Представленные графики представляют 3 эксперимента и отображаются как среднее ± стандартная ошибка среднего, n = 9 на группу.(C) Клетки, продуцирующие CD4 + IFN-γ, подсчитывали в селезенке и определяли MFI. Представленные графики представляют 3 эксперимента и отображаются как среднее ± стандартная ошибка среднего, n = 9 на группу. Смертельно облученные реципиенты B6D2F1 получали B6.WT BM (10 7 ) + B6 luc + Т-клеток (2 × 10 6 ). (D) Люминесценцию количественно оценивали на 7 день после трансплантации (* P <0,05, физиологический раствор против обработки IFN-α в млН и iLN; ** P <0,01, физиологический раствор против обработки IFN-α в селезенке, желудочно-кишечном тракте тракта, печени и легких, n = 5 на группу).(E) Репрезентативные биофотонные изображения показаны помеченными. (F) Экспансия донорских CD4 + Т-клеток была количественно определена на 4 день (** P <0,01, физиологический раствор против обработки IFN-α, n = 10 на группу) и (G) сывороточный IFN-γ проанализирован в на 3-й день после трансплантации ( # P <0,005, физиологический раствор против IFN-α, n = 10 на группу).
Рисунок 4
Лечение IFN-α перед трансплантацией подавляет дифференцировку Th2 и защищает от GVHD. Получатель B6.Мыши WT или B6.IFNAR1 — / — получали либо IFN-α, либо физиологический раствор сразу после облучения всего тела, и на следующий день им трансплантировали Т-клетки BM + от доноров BALB / c.CD45.1 + . (A) Уровни цитокинов IFN-γ в сыворотке были оценены (объединенные данные из 2 экспериментов; # P <0,005, физиологический раствор против IFN-α, n = 11, 11, 7, 7) и донорский CD4 + Через 4 дня в селезенке было подсчитано Т-клеток (объединенные данные из 2 экспериментов; ** P <.01, физиологический раствор против IFN-α; n = 6 на группу). (B) Продукцию IFN-γ Т-клетками CD4 + , стимулированными ex vivo в течение 5 часов, определяли путем окрашивания внутриклеточных цитокинов. Представленные графики представляют 3 эксперимента и отображаются как среднее ± стандартная ошибка среднего, n = 9 на группу. (C) Клетки, продуцирующие CD4 + IFN-γ, подсчитывали в селезенке и определяли MFI. Представленные графики представляют 3 эксперимента и отображаются как среднее ± стандартная ошибка среднего, n = 9 на группу. Смертельно облученные реципиенты B6D2F1 получали B6.WT BM (10 7 ) + B6 luc + Т-клеток (2 × 10 6 ). (D) Люминесценцию количественно оценивали на 7 день после трансплантации (* P <0,05, физиологический раствор против обработки IFN-α в млН и iLN; ** P <0,01, физиологический раствор против обработки IFN-α в селезенке, желудочно-кишечном тракте тракта, печени и легких, n = 5 на группу). (E) Репрезентативные биофотонные изображения показаны помеченными. (F) Экспансия донорских CD4 + Т-клеток была определена количественно на 4 день (** P <0,01, физиологический раствор против обработки IFN-α, n = 10 на группу) и (G) сывороточный IFN-γ проанализирован в 3-й день после трансплантации ( # P <.005, физиологический раствор против IFN-α, n = 10 на группу).
Поскольку возможно, что IFN-α может просто усилить отторжение трансплантата в этой несопоставимой системе MHC, мы повторили эти исследования в модели B6 → B6D2F1, родительской системе, в которой реципиенты также обрабатываются NK1.1 для истощения NK-клеток и исключить возможность отторжения трансплантата. В этих исследованиях мы использовали экспрессирующие люциферазу трансгенные донорские Т-клетки для мониторинга роста после трансплантации костного мозга.Как показано, лечение реципиентов IFNα перед трансплантацией BM значительно снижает экспансию донорских Т-клеток в лимфоидных органах-мишенях и органах-мишенях GVHD (рис. 4D-E). Донорские CD4 + экспансия Т-клеток в селезенке (рис. 4F) и генерация системного IFN-γ (рис. 4G) снова также подавлялись. Эти результаты подтверждают, что передача сигналов IFN-α в ткани хозяина во время кондиционирования ингибирует последующее донорское праймирование Т-клеток CD4 + .
Установив важную роль IFN типа I в снижении донорских Т-клеточных ответов после трансплантации с несоответствием MHC, мы затем исследовали их роль в системах трансплантации BM, которые были согласованы с MHC, но где GVHD индуцирована множеством незначительных несовпадений HA и CD8 + Т-клетки вносят значительный вклад в патологию.Используя модель C3H.SW → B6, мы обнаружили, что присутствие передачи сигналов типа I-IFN у реципиента снова ингибирует CD4-зависимую GVHD (рис. 5A). Однако, когда были трансплантированы только CD8 + Т-клетки, передача сигналов типа I-IFN внутри хозяина парадоксальным образом привела к ускорению GVHD (рис. 5B), и этот эффект преобладал в этой системе, когда и CD4 + , и CD8 + T клетки присутствовали (рис. 5C). Чтобы подтвердить это усиление CD8-зависимой GVHD с помощью передачи сигналов типа I-IFN у реципиента, мы предприняли дальнейшие трансплантации в модели bm1 → B6, где CD8-зависимая GVHD направлена на изолированное несоответствие MHC класса I.Эти результаты снова продемонстрировали усиление CD8-зависимой GVHD в присутствии передачи сигналов типа I-IFN в ткани хозяина (рис. 5D).
Рисунок 5
Передача сигналов IFN типа I по-разному регулирует CD4 + и CD8 + T-клеточную GVHD в модели трансплантации BM, несоответствующей антигену минорной гистосовместимости. Выживание смертельно облученных B6.WT или B6.IFNAR1 — / — мышей, которым трансплантировали 10 7 BM и либо (A) 3 × 10 6 CD4 Только Т-клетки + (* P <.05, B6.IFNAR1 — / — против получателей B6.WT; n = 13 в BM + T, n = 6 в контроле TCD), (B) 2 × 10 6 CD8 + только Т-клетки (* P <0,05, B6.IFNAR1 — / — против Реципиенты B6.WT, n = 16 в BM + T, n = 4 в сингенных контролях) или (C) CD3 + Т-клеток, содержащих 2 × 10 6 CD8 + Т-клеток ( # P <0,005, B6.IFNAR1 — / — по сравнению с реципиентами B6.WT, n = 16 в BM + T, n = 8 в контроле TCD) от иммунизированных мышей C3HSW.(D) Клинические оценки смертельно облученных мышей B6.WT или B6.IFNAR1 — / — , которым была проведена трансплантация 5 × 10 6 BM и 5 × 10 6 CD3 + Т-клеток от доноров bm1 (* P <0,05, ** P <0,01, # P <0,005, B6.IFNAR1 — / — по сравнению с получателями B6.WT, n = 16 в BM + T, n = 8 в контроле TCD, объединенные данные из 2 экспериментов). (E) На 12-й день после трансплантации CD3 + Т-клеток в системе bm1 → B6 Т-клетки CD8 + очищали сортировкой и использовали в качестве эффекторов в анализах высвобождения хрома против хозяина типа EL4 или донорских бластов bm1 в качестве мишеней.(F) На 21 день после трансплантации CD3 + Т-клеток в системе C3H.SW → B6 подсчитывали CD8 + Т-клетки (данные, объединенные из 2 экспериментов, среднее значение ± стандартная ошибка среднего; n = 8 на группу), окрашивали на Granzyme B (среднее ± SEM; n = 4 на группу) или очищали сортировкой, затем использовали в качестве эффекторов в анализах высвобождения хрома против хозяина типа EL4 или донорских бластов C3H.SW в качестве мишеней (данные объединены из 2 экспериментов). (G) ЦТЛ in vivo действуют против B6.CD45.1 + и CFSE-меченного B6.IFNAR1 — / — (CD45.2 + ) мишени-хозяева на 12 день после трансплантации в системе C3H.SW → B6 (реципиенты GVHD получали BM и CD3 + Т-клетки, а реципиенты без GVHD получали только BM с истощенными Т-клетками). Отношение оставшихся мишеней B6.IFNAR1 — / — к B6.CD45.1 + в селезенке показано на репрезентативных графиках ( # P = 0,005, без РТПХ против РТПХ; данные объединены из 2 экспериментов. , среднее ± SEM; n = 7-10 на группу). (H) Экспрессия IFNAR1 на линиях опухолевых клеток P815, P210, A20, EL4 и 5GTM1.
Рисунок 5
Передача сигналов IFN типа I по-разному регулирует CD4 + и CD8 + T-клеточную GVHD в модели трансплантации BM, несовместимой с антигеном минорной гистосовместимости. Выживание смертельно облученных B6.WT или B6.IFNAR1 — / — мышей, которым трансплантировали 10 7 BM и либо (A) 3 × 10 6 CD4 Только Т-клетки + (* P <. 05, B6.IFNAR1 — / — по сравнению с реципиентами B6.WT; n = 13 в BM + T, n = 6 в контроле TCD), (B) 2 × 10 6 CD8 + только T-клетки (* P <.05, B6.IFNAR1 — / — по сравнению с реципиентами B6.WT, n = 16 в BM + T, n = 4 в сингенных контролях), или (C) CD3 + Т-клетки, содержащие 2 × 10 6 CD8 + Т-клетки ( # P <0,005, B6.IFNAR1 — / — против реципиентов B6.WT, n = 16 в BM + T, n = 8 в контроле TCD) от иммунизированных мышей C3HSW. (D) Клинические оценки смертельно облученных мышей B6.WT или B6.IFNAR1 — / — , которым была проведена трансплантация 5 × 10 6 BM и 5 × 10 6 CD3 + Т-клеток от доноров bm1 (* P <.05, ** P <0,01, # P <0,005, B6.IFNAR1 — / — по сравнению с получателями B6.WT, n = 16 в BM + T, n = 8 в контроле TCD, данные объединены из 2 экспериментов). (E) На 12-й день после трансплантации CD3 + Т-клеток в системе bm1 → B6 Т-клетки CD8 + очищали сортировкой и использовали в качестве эффекторов в анализах высвобождения хрома против хозяина типа EL4 или донорских бластов bm1 в качестве мишеней. (F) На 21 день после трансплантации CD3 + Т-клеток в C3H.Система SW → B6, CD8 + Т-клетки были подсчитаны (данные объединены из 2 экспериментов, среднее ± SEM; n = 8 на группу), окрашены на Granzyme B (среднее ± SEM; n = 4 на группу) или очищены сортировкой. затем использовались в качестве эффекторов в анализах высвобождения хрома против хозяина типа EL4 или донора C3H.SW в качестве мишеней (данные объединены из 2 экспериментов). (G) Функция CTL in vivo против мишеней-хозяев B6.CD45.1 + и CFSE-меченных B6.IFNAR1 — / — (CD45.2 + ) на 12-й день после трансплантации в C3H.Система SW → B6 (реципиенты GVHD получали Т-клетки BM и CD3 + , а реципиенты без GVHD получали только BM с истощенными Т-клетками). Отношение оставшихся мишеней B6.IFNAR1 — / — к B6.CD45.1 + в селезенке показано на репрезентативных графиках ( # P = 0,005, без РТПХ против РТПХ; данные объединены из 2 экспериментов. , среднее ± SEM; n = 7-10 на группу). (H) Экспрессия IFNAR1 на линиях опухолевых клеток P815, P210, A20, EL4 и 5GTM1.
Чтобы изучить механизм усиления этого типа I-IFN CD8-зависимой GVHD, мы исследовали функцию Т-клеток CD8 + после трансплантации, когда стали очевидными различия в клинических показателях (рис. 5D, данные для C3H не показаны.SW → B6 система). Удивительно, но цитотоксичность Т-клеток CD8 + донора была сходной в системе bm1 → B6, независимо от того, был ли реципиент B6.WT или B6.IFNAR1 — / — (фиг. 5E). В модели C3H.SW → B6 количество донорских CD8 + Т-клеток, экспрессия гранзима B и уровни цитотоксичности в отношении хозяина также были сходными у реципиентов B6.WT и B6.IFNAR1 — / — (рис. 5F). Поэтому мы исследовали возможность того, что передача сигналов IFN типа I в ткани реципиента делает ее более восприимчивой к цитотоксичности, опосредованной донорскими CD8 + Т-клетками, путем изучения способности аллореактивных Т-клеток дифференциально убивать WT и IFNAR1 — / — мишеней in vivo.Как показано на фиг. 5G, это действительно имело место с мишенями IFNAR1 — / — типа хозяина, которые преимущественно выживали по сравнению с мишенями WT при наличии ответа аллореактивных Т-клеток. Этот результат был также подтвержден в системе bm1 → B6, где мишени IFNAR1 — / — были в 2,26 раза более устойчивы к цитолизу, чем мишени WT (данные не показаны). Таким образом, передача сигналов типа I-IFN в ткани реципиента усиливает CD8-зависимую GVHD независимо от эффектов на донорский CD8 + эффекторный ответ Т-клеток и вместо этого увеличивает восприимчивость ткани-мишени хозяина к цитолитическому повреждению.Чтобы определить, может ли передача сигналов типа I-IFN также воздействовать непосредственно на опухоль, чтобы сделать ее более восприимчивой к уничтожению, мы проанализировали миелоидные (P815, P210), T- и B-лимфоидные (EL-4, A20) и плазматические клетки (5GTM1) опухоли. линий для экспрессии IFNAR1 и обнаружили, что это действительно так (рис. 5H). Следовательно, лечение IFN типа I может потенциально привести к повышенной чувствительности опухоли к опосредованному CD8 + T-клеточному уничтожению.
Чтобы исследовать роль передачи сигналов типа I-IFN через донорские клетки, мы использовали B6.WT или B6.IFNAR1 — / — доноров в модели B6 → B6D2F1 РТПХ. Эти исследования продемонстрировали, что, хотя выживаемость была одинаковой у обоих доноров, наблюдалось значительное снижение клинических показателей у реципиентов B6.IFNAR1 — / — трансплантатов после 30 дней (рис. 6A). До этого GVHD происходила с одинаковой пенетрантностью в обеих группах, так что у отдельных животных развивалась тяжелая GVHD (клиническая оценка 6 или выше). Поскольку улучшение GVL-ответов очень желательно после трансплантации, мы затем перешли к изучению роста клеток мастоцитомы P815, трансфицированных люциферазой хозяина, на этой модели.Реципиенты трансплантатов B6.IFNAR1 — / — имели пониженную GVL по сравнению с теми, кто получил трансплантаты B6.WT, что продемонстрировано выживаемостью и биофотонной визуализацией на 12 день (рис. 6B-C). Анализы цитотоксичности in vivo показали, что имело место значительное снижение гибели мишеней-хозяев у реципиентов трансплантатов B6.IFNAR1 — / — по сравнению с трансплантатами B6.WT, что согласуется с уменьшением GVL в этой группе (фигура 6D).
Рисунок 6
Ответы GVHD и GVL усиливаются за счет передачи сигналов типа I-IFN в донорских трансплантатах. (A) Выживаемость и клинические показатели у смертельно облученных мышей B6D2F1, которым трансплантировали 5 × 10 6 BM и 2 × 10 6 Т-клеток от B6.WT или B6.IFNAR1 — / — доноров ( # P <0,005, ** P <0,01, * P <0,05; объединенные данные из 3 экспериментов, n = 26-30 в группах BM + T, n = 13 в контроле TCD). (B) Смерть от лейкемии после введения опухоли P815 luc + , полученной из хозяина (5 × 10 3 ), с донорским трансплантатом (* P <.05, B6.WT против B6.IFNAR1 — / — доноров; объединенные данные из 2 экспериментов, n = 18 в группах BM + T, n = 8 в контрольных группах TCD). (C) Биолюминесценция на 12-й день после трансплантации опухоли P815 luc + (** P <0,01, B6.WT по сравнению с донорами B6.IFNAR1 — / — ; объединенные данные из 2 экспериментов, n = 18 на gp ) с показанными репрезентативными изображениями. (D) Индекс цитотоксичности in vivo на 12-й день после трансплантации BM (данные, объединенные из 2 экспериментов и выраженные как среднее ± SEM; * P <.05, B6.WT против B6.IFNAR1 — / — доноров, n = 7-11 на группу). (E) Смерть от лейкемии после трансплантации смертельно облученных мышей B6D2F1 комбинацией B6.WT или B6.IFNAR1 — / — BM с B6.WT или B6.IFNAR1 — / — T-клеток и P815 luc + опухоль (** P <0,01, * P <0,05, объединенные данные из 2 экспериментов, n = 16 в группах BM + T, n = 8 в TCD). (F) Реципиенты B6.WT были смертельно облучены и через 24 часа 10 7 BM и 10 6 CD8 + Т-клеток из C3H.Донорам SW пересажена опухоль 2,5 × 10 4 EL-4 luc + . После установления низкоуровневой опухоли, определяемой биолюминесценцией, рекомбинантный IFNα или физиологический раствор вводили через день, а опухолевую нагрузку оценивали через 1 неделю (данные объединены из 2 экспериментов и выражены как среднее ± SEM; ** P <0,01 физиологический раствор день 0 против дня 7).
Рисунок 6
Ответы GVHD и GVL усиливаются за счет передачи сигналов типа I-IFN в донорских трансплантатах. (A) Выживаемость и клинические показатели у смертельно облученных мышей B6D2F1, которым трансплантировали 5 × 10 6 BM и 2 × 10 6 Т-клеток от любого из B6.WT или B6.IFNAR1 — / — доноров ( # P <0,005, ** P <0,01, * P <0,05; объединенные данные из 3 экспериментов, n = 26-30 в группах BM + T, n = 13 в контроле TCD). (B) Смерть от лейкемии после введения полученной из хозяина опухоли P815 luc + (5 × 10 3 ) с донорским трансплантатом (* P <0,05, B6.WT по сравнению с донорами B6.IFNAR1 — / — ; объединенные данные из 2 экспериментов, n = 18 в группах BM + T, n = 8 в контрольных группах TCD).(C) Биолюминесценция на 12-й день после трансплантации опухоли P815 luc + (** P <0,01, B6.WT по сравнению с донорами B6.IFNAR1 — / — ; объединенные данные из 2 экспериментов, n = 18 на gp ) с показанными репрезентативными изображениями. (D) Индекс цитотоксичности in vivo на 12-й день после трансплантации BM (данные, объединенные из 2 экспериментов и выраженные как среднее ± SEM; * P <0,05, B6.WT по сравнению с донорами B6.IFNAR1 — / — , n = 7-11 в группе). (E) Смерть от лейкемии после трансплантации смертельно облученных мышей B6D2F1 комбинацией любого из B6.WT или B6.IFNAR1 — / — BM с B6.WT или B6.IFNAR1 — / — Т-лимфоцитами и опухолью P815 luc + (** P <0,01, * P <0,05, объединенные данные из 2 экспериментов, n = 16 в группах BM + T, n = 8 в TCD). (F) Реципиенты B6.WT были смертельно облучены и через 24 часа 10 7 BM и 10 6 CD8 + Т-клеток от доноров C3H.SW трансплантированы с опухолью 2,5 × 10 4 EL-4 luc + . После установления низкого уровня опухоли, определяемого биолюминесценцией, рекомбинантный IFNα или физиологический раствор вводили через день, а опухолевую нагрузку оценивали через 1 неделю (данные, объединенные из 2 экспериментов и выраженные как среднее значение ± SEM; ** P <.01 солевой раствор, день 0 против дня 7).
Поскольку компартменты ВМ и Т-клеток вносят вклад в презентацию антигена и последующее уничтожение опухоли хозяина после трансплантации ВМ, соответственно, мы затем исследовали, на какие типы донорских клеток типа I-IFN воздействовал, усиливая ответы GVL. Мы провели эксперименты по смешиванию с комбинациями B6.WT или B6.IFNAR1 — / — BM и B6.WT или B6.IFNAR1 — / — Т-клеточных трансплантатов.Это открытие подтвердило, что передача сигналов типа I-IFN непосредственно через донорские Т-клетки была ответственна за усиление ответов GVL (рис. 6E). Поскольку передача сигналов типа I-IFN внутри мишеней CTL увеличивает чувствительность к киллингу, тогда как передача сигналов внутри донорских Т-клеток одновременно усиливает эффекторный ответ CTL, мы исследовали, может ли экзогенный цитокин подавлять рост опухоли после аллогенной трансплантации костного мозга. Мы использовали систему C3H.SW → B6 в присутствии люциферазы, экспрессирующей лимфому EL-4 типа хозяина.Мы вводили рекомбинантный мышиный IFNα через день в течение 1 недели после того, как реципиенты показали низкие уровни опухолевой нагрузки, обнаруживаемые с помощью биолюминесцентного изображения, поскольку введение цитокина животным с высокими уровнями установленной опухоли было неэффективным (данные не показаны). Хотя бремя лимфомы значительно увеличилось у реципиентов физиологического раствора, как и ожидалось, этого не произошло у реципиентов, получавших IFNα (рис. 6F). Таким образом, введение экзогенного IFNα реципиентам в раннем рецидиве после трансплантации BM может модулировать рост опухоли.
Хотя защитная роль IFN типа I при вирусной инфекции хорошо известна, влияние цитокина на адаптивный иммунитет и, в частности, контроль аллоиммунитета изучено плохо. Рекомбинантный IFN-α обычно использовался для лечения пациентов с хроническим миелоидным лейкозом в эпоху преиматиниба, что приводило к цитогенетическим ответам, которые, как считается, в первую очередь связаны с антипролиферативными эффектами. 17-19 Способность цитокина модулировать GVHD и GVL после аллогенной трансплантации BM была описана в основном в серии отдельных случаев, и, хотя ее трудно интерпретировать, очевидны явные случаи контроля болезни. 20-22 В этом исследовании мы продемонстрировали, что передача сигналов типа I-IFN играет важную роль в ответах как GVHD, так и GVL. Важно отметить, что эффекты цитокина являются плейотропными, с различными эффектами на иммунные исходы, опосредованными донорскими CD4 + и CD8 + Т-клетками.Наши данные предполагают, что эффекты на донорские Т-клетки CD4 + , вероятно, опосредованы косвенно, предположительно реципиентными антиген-презентирующими клетками, тогда как прямые эффекты на донорские Т-клетки и их мишени контролируют результат в ответ на клеточные ответы, ограниченные МНС класса I.
Хотя большинство клеток могут продуцировать I-IFN в ответ на вирусную инфекцию, плазмацитоидные DC (pDC) обычно являются доминирующим источником этого цитокина. 23 Источник типа I-IFN в условиях трансплантации BM неясен, поскольку уровни I-IFN в сыворотке были ниже уровней, обнаруживаемых с помощью обычных анализов, таких как ELISA и анализы ингибирования вируса (данные не показаны). Однако явно измененный результат трансплантации в отсутствие передачи сигналов цитокинов демонстрирует его важность после трансплантации BM.
Влияние КПК на исход трансплантата несколько противоречиво. 24-26 После миелоаблативного кондиционирования это подмножество APC быстро истощается и кажется избыточным для прайминга донорских Т-клеток. 25 Дифференцировка донорских pDC нарушается в присутствии GVHD, и незрелые формы, производные от BM, оказываются супрессивными, 26 , хотя это не было связано с секрецией I-IFN. pDC экспрессируют TLR7 и TLR9, которые отвечают на одноцепочечную РНК и ДНК, богатую CpG, соответственно. 27 Введение CpG реципиентам трансплантации BM, начиная с дня 0, заметно ускоряет GVHD в несопоставимых (и CD4-доминантных) системах MHC посредством передачи сигналов через TLR9 и воздействия на APC и IFN-γ хозяина. 28
Хотя можно ожидать, что эта стратегия будет способствовать секреции IFN типа I, ускорение GVHD противоположно ранним защитным эффектам, наблюдаемым в наших исследованиях, что позволяет предположить, что эффекты CpG не зависят от типа I-IFN. В этих исследованиях агонисты TLR8 / 9 также увеличивали GVHD, что согласуется с эффектами после лигирования TLR4, которое также может инициировать продукцию типа I-IFN DC и макрофагами. 29 Таким образом, доминантный сигнал, индуцирующий секрецию IFN типа I в определенных типах клеток, неизвестен и потребует разработки более чувствительных реагентов для обеспечения информативного анализа.
Мы продемонстрировали, что передача сигналов типа I-IFN у реципиентов трансплантации BM обеспечивает защиту от CD4-зависимой GVHD. Хотя возможно, что тип I-IFN может усиливать отторжение трансплантата, исследования в модели родителя F1, где обычное отторжение отсутствует, продемонстрировали результаты, идентичные результатам, полученным в модели BALB / c → B6.Следовательно, передача сигналов типа I-IFN у реципиентов трансплантации BM изменяет способность клеток-хозяев вызывать дифференцировку донорских Т-клеток до аллоантигена. Пристрастие GVHD к толстой кишке в отсутствие передачи сигналов IFN типа I в ткани реципиента было неожиданным. Исследования на химерных реципиентах ясно демонстрируют, что это было из-за эффекта передачи сигналов в гемопоэтических клетках, а не в эпителии-мишени. Реципиентные клетки гемопоэтического происхождения традиционно считаются важными в качестве APC для инициации GVHD, хотя относительная важность конкретных субпопуляций APC хозяина в инициации GVHD в настоящее время неизвестна.Анализ сразу после облучения показал, что выживаемость реципиента cDC не различалась между реципиентами B6.WT и B6.IFNAR1 — / — . Однако остаточные кДК у реципиентов B6.IFNAR1 — / — были более эффективны в индукции пролиферации и эффекторной функции в аллодиспаратных CD4 + Т-клетках.
Интересно, что передача сигналов типа I-IFN, как было показано, ингибирует экспрессию остеопонтина в DC, что приводит к ингибированию секреции IL-27 и воспалительных реакций, опосредованных Th27. 30 Продемонстрированный вклад IL-17A в GVHD в этой модели предполагает, что эта регуляторная ось в DC хозяина может вносить вклад в защиту, опосредованную передачей сигналов типа I-IFN. Однако текущие парадигмы и данные, представленные здесь, предполагают, что дифференцировка Th2, а не Th27 является основным путем, ответственным за острую GVHD, и подавление первого, вероятно, отвечает за большинство эффектов, наблюдаемых I-IFN на ранней стадии. Трансплантация BM. Тем не менее, способность донорского IL-17A играть патогенную роль в GVHD согласуется с данными, опубликованными нами 31 и другими. 32,33 В сочетании с продемонстрированными эффектами передачи сигналов типа I-IFN на DC, также было показано, что передача сигналов в макрофагах приводит к ослаблению иммунных ответов и активации макрофагов липополисахаридом в присутствии I-IFN. индуцирует продукцию IL-10 для усиления этого регуляторного эффекта. 34 Таким образом, хотя тип клеток реципиента, происходящих из гемопоэза, сигнализируемый типом I-IFN о регуляции GVHD, еще предстоит определить, вероятно, это APC.
В отличие от подавления CD4-зависимой GVHD с помощью передачи сигналов типа I-IFN в ткани реципиента, наблюдалось парадоксальное увеличение CD8-опосредованной GVHD. Удивительно, но это не было связано с явными изменениями в функции Т-клеток CD8 + , как это было видно с ответами Т-клеток CD4 + . Напротив, передача сигналов типа I-IFN увеличивала восприимчивость ткани хозяина к повреждению CTL. После представления нашего исследования Ли и др. 35 сообщили только о незначительном снижении гистопатологии печеночной GVHD в модели C3HSW → B6 в отсутствие передачи сигналов IFN типа I в организме хозяина.Это, вероятно, отражает легкую и нелетальную природу РТПХ в этой системе в отсутствие донорской иммунизации, как это было предпринято в наших исследованиях. Повышенная восприимчивость различных субпопуляций иммунных клеток (CD4 + Т-клетки, макрофаги, клетки селезенки) к апоптозу была описана после передачи сигналов типа I-IFN во время инфицирования Listeria и Chlamydia . 36-38 Интересно, что клинические данные 1990-х годов также продемонстрировали пагубный эффект введения типа I-IFN в предтрансплантационный период с увеличением тяжелой РТПХ и связанной с трансплантацией смертности. 39,40 Это открытие согласуется с CD8-доминантной GVHD при клинической трансплантации BM, где донор и реципиент совпадают по локусам HLA. Также было показано, что тип I-IFN способствует апоптозу в нескольких линиях опухолевых клеток in vitro, включая множественную миелому и острый лимфобластный лейкоз. 41-43 Вместе с данными in vivo, представленными здесь, это дает обоснование для изучения экспрессии рецептора типа I-IFN при первичных злокачественных гемопоэтических опухолях человека. При рецептор-положительных злокачественных новообразованиях введение типа I-IFN после трансплантации BM может повысить чувствительность остаточных злокачественных новообразований к ответам GVL и может быть достойным изучения у пациентов с очень высоким риском или рецидивом (например, миелома, первичный рефрактерный острый миелоидный лейкоз. ).
Имея это в виду, мы также проанализировали влияние передачи сигналов типа I-IFN на донорский трансплантат после трансплантации BM. Эти исследования подтвердили, что цитокин усиливает активность CTL и, как следствие, GVL за счет прямого воздействия на донорские Т-клетки. Хотя эти результаты не согласуются с недавним исследованием, в котором авторы использовали модели кожного аллотрансплантата, которые показали, что передача сигналов типа I-IFN не способствует отторжению, опосредованному Т-клетками CD8 + , 44 авторы других исследований ясно показали продемонстрировали жизненно важную роль IFN типа I в расширении и дифференцировке эффекторных CTL и в активации стороннего наблюдателя. 45,46 Кроме того, в исследованиях на пациентах и экспериментальных моделях, в которых была достигнута толерантность, исследователи продемонстрировали, что передача сигналов типа I-IFN после вирусной инфекции или эндогенного введения может инициировать отторжение. 47,48 И наоборот, блокада типа I-IFN в сочетании с иммуносупрессией может продлить выживаемость аллотрансплантата. 49
Таким образом, хотя роль типа I-IFN после трансплантации твердого органа до сих пор остается спорной, большинство исследований свидетельствуют о том, что передача сигналов Усиливает аллореактивные ответы.Также было продемонстрировано, что повышенные уровни типа I-IFN увеличивают перекрестную презентацию Т-лимфоцитов CD8 + APC независимо от помощи Т-лимфоцитов CD4 + . 50 Хотя передача сигналов типа I-IFN в донорских APC, по-видимому, не способствует GVL в нашей системе, мы исследовали это, используя доноров, которые не могут отвечать на IFN типа I, и, следовательно, сравнили физиологические уровни передачи сигналов с его отсутствием. Напротив, Ле Бон и др. Индуцировали высокие уровни I-IFN как через вирусную инфекцию (вирус лимфоцитарного хориоменингита), так и за счет прямого введения IFNα, что улучшало перекрестное праймирование. 50 В сочетании с демонстрацией четкой роли передачи сигналов физиологического типа I-IFN в активности CTL, мы также подтвердили, что введение рекомбинантного IFNα может модулировать рост опухоли после аллогенной трансплантации BM. Ответы донорских NK-клеток также важны для ответов GVL и, что важно, ранние ответы опухоли NK зависят от передачи сигналов типа I-IFN. 12 Следовательно, усиление этих ответов в сочетании с CD8 + Т-клеточными ответами могло бы дополнительно улучшить GVL у реципиентов трансплантации BM с NK-чувствительными злокачественными новообразованиями.
Несмотря на то, что мы продемонстрировали потенциал как для предотвращения РТПХ, так и для улучшения GVL путем лечения типом I-IFN, наиболее эффективным терапевтическим применением этого цитокина, вероятно, было бы дополнительное лечение пациентов с очень высоким риском рецидива после трансплантации BM. в то время как опухолевые нагрузки низкие Если вводить до трансплантации, существует риск сделать ткань реципиента более восприимчивой к цитолитическому повреждению донора и, возможно, вызванному химиолучевой терапией.Напротив, способность IFN типа I делать остаточную злокачественную опухоль более восприимчивой к уничтожению при одновременном повышении клеточной цитотоксичности делает эту стратегию привлекательной для продвижения GVL в условиях высокого риска. Доступность новых пегилированных форм цитокина в клинической практике предполагает, что этот подход может быть пересмотрен в контролируемой и перспективной форме.
Анализ этой статьи Inside Blood помещен в начале этого выпуска.
Затраты на публикацию этой статьи были частично оплачены за счет оплаты страницы. Таким образом, и исключительно для того, чтобы указать на этот факт, данная статья помечена как «реклама» в соответствии с разделом 18 USC 1734.
Вклад: R.J.R. разрабатывал и проводил эксперименты и писал рукопись; E.K., R.D.K., Y.A.W., S.D.O., A.L.J.D., N.C.R., K.E.L., A.V., K.A.M. и M.K. проведенные эксперименты; N.A.D.W предоставила жизненно важные реагенты; A.D.C. выполнили все слепые гистологические анализы; П.Дж.Х. предоставлял жизненно важные реагенты и помогал разрабатывать эксперименты; К.П.А.М. разработал исследования и помог написать рукопись; и G.R.H. разработал исследования и помог написать рукопись.
Раскрытие информации о конфликте интересов: авторы заявляют об отсутствии конкурирующих финансовых интересов.
Для корреспонденции: Джеффри Хилл, Лаборатория трансплантации костного мозга, Институт медицинских исследований Квинсленда, 300 Herston Road, Herston, QLD, 4006 Australia; электронная почта: [email protected].
Дазатиниб может не подавлять эффект GVL инфузий донорских лимфоцитов для CML
Simula MP, Marktel S, Fozza C, Kaeda J, Szydlo RM, Nadal E et al .Ответ на инфузию донорских лимфоцитов при хроническом миелоидном лейкозе зависит от дозы: важность увеличения дозы клеток для максимальной терапевтической эффективности. Лейкемия 2007; 21 : 943–948.
CAS Статья Google ученый
Dazzi F, Szydlo RM, Craddock C, Cross NC, Kaeda J, Chase A et al . Сравнение схем инфузии донорских лимфоцитов при рецидиве после аллотрансплантации по поводу хронического миелоидного лейкоза. Кровь 2000; 95 : 67–71.
CAS PubMed PubMed Central Google ученый
Савани Б.Н., Монтеро А., Курландер Р., Чайлдс Р., Хенсель Н., Барретт А.Дж.. Иматиниб взаимодействует с инфузиями донорских лимфоцитов для достижения быстрой молекулярной ремиссии рецидива ХМЛ после трансплантации аллогенных стволовых клеток. Пересадка костного мозга 2005; 36 : 1009–1015.
CAS Статья Google ученый
Cwynarski K, Laylor R, Macchiarulo E, Goldman J, Lombardi G, Melo JV et al .Иматиниб подавляет активацию и пролиферацию нормальных Т-лимфоцитов in vitro . Leukemia 2004; 18 : 1332–1339.
CAS Статья Google ученый
Schade AE, Schieven GL, Townsend R, Jankowska AM, Susulic V, Zhang R et al . Дазатиниб, низкомолекулярный ингибитор протеинтирозинкиназы, подавляет активацию и пролиферацию Т-клеток. Кровь 2008; 111 : 1366–1377.
CAS Статья Google ученый
Weichsel R, Dix C, Wooldridge L, Clement M, Fenton-May A, Sewell AK et al . Глубокое подавление дазатинибом эффекторных функций антиген-специфических Т-клеток. Clin Cancer Res 2008; 14 : 2484–2491.
CAS Статья Google ученый
Блейк С.Дж., Брюс Л.А., Фрейзер К.К., Хейболл Д.Д., Хьюз Т.П.Дазатиниб подавляет цитотоксичность in vitro естественных клеток-киллеров . Кровь 2008; 111 : 4415–4416.
CAS Статья Google ученый
Фей Ф, Ю Й, Шмитт А., Роевски М.Т., Чен Б., Гоц М. и др. . Дазатиниб подавляет пролиферацию и функцию регуляторных Т-клеток CD4CD25. Br J Haematol 2009; 144 : 195–205.
CAS Статья Google ученый
Cortes J, Rousselot P, Kim DW, Ritchie E, Hamerschlak N, Coutre S et al .Дазатиниб вызывает полный гематологический и цитогенетический ответ у пациентов с иматиниб-резистентным или нетолерантным хроническим миелоидным лейкозом при бластном кризе. Кровь 2007; 109 : 3207–3213.
CAS Статья Google ученый
Надаль Э, Гарин М., Каеда Дж., Апперли Дж., Лехлер Р., Дацци Ф. Повышенная частота CD4 (+) CD25 (высокий) T (regs) коррелирует с рецидивом заболевания после трансплантации аллогенных стволовых клеток при хроническом миелоидном лейкозе. Лейкемия 2007; 21 : 472–479.
CAS Статья Google ученый
Истощение Т-лимфоцитов и отказ в презентации антигена приводят к устойчивости к эффекту трансплантат против лейкемии
Подчиненная система GVL
Для создания популяции отслеживаемых донорских клеток CD8, реактивных против miHA, экспрессируемых лейкозными клетками, мы вакцинировали Мыши C3H.SW (H-2 b ) или B6 (H-2 b ) против miHA H60 19 , ограниченных K b , с использованием антитела против DEC205, которое было модифицировано для экспрессии эпитопа H60 LTFNYRNL (DEC-H60) с агонистическим антителом против CD40 (FGK45) 18 .Клетками памяти CD8 (T M ), реактивными против H60 (T MH60 ), в основном были CD62L + CD44 + клетки центральной памяти (T CM ) с меньшим количеством CD62L — CD44 + эффекторных клеток памяти. (Т EM ). В большинстве экспериментов мышей B6.H60 (конгенных для H60 18 ) облучали и восстанавливали C3H.SW или B6 T-клеточно-истощенный BM (обозначаемый как BM), с CD8 + CD44 + T M из вакцинированного H60 C3H.Доноры SW или B6, с или без H60 + BC-CML 18 (далее BC-CML). Количество перенесенных CD8 + T M было скорректировано так, чтобы получить определенное количество T MH60 (от 3,5 до 10 × 10 3 ), но тетрамер-положительные по H60 (Tet H60 + ) клетки не были сортировать-очищенный. В то время как смесь клеток T CM и эффекторной памяти T EM Tet H60 + была перенесена, большая часть экспансии пришлась на клетки T CM Tet H60 + (дополнительный рис.1).
Клетки BC-CML опережают реакцию Т-клеток против H60
Для определения кинетики размножения Т-клеток BC-CML и Tet H60 + мы умерщвляли когорты через 7, 14 и 21 день после трансплантации в C3H. SW → Система B6.H60. Клетки Tet H60 + превосходили количество клеток BC-CML на +7 день и были примерно эквивалентны в день +14 (рис. 1). Не было дальнейшего увеличения Tet H60 + T-клеток после дня +14, с или без BC-CML, тогда как BC-CML клетки продолжали увеличиваться в селезенке и были стабильными в BM.Следовательно, несмотря на обилие антигена в форме клеток H60 + BC-CML, ответ Т-клеток против miHA выравнивается. Эти данные были совместимы с тем, что GVL ограничивалась появлением устойчивых к GVL клонов или отсутствием ответа Т-клеток.
Рис. 1. Клетки BC-CML выживают, несмотря на устойчивый ответ против H60 CD8.a Опытный образец. Мышей B6.H60 облучали и восстанавливали клетками C3H.SW BM и T MH60 (содержащими 10 4 CD8 + Tet H60 + клеток) с или без B6.H60 BC-CML. Когорты умерщвляли на 7, 14 и 21 день после трансплантации для подсчета клеток BC-CML и Tet H60 + в селезенке и BM. Типичное окрашивание тетрамера для экспрессии H60 (Tet H60 ) и NGFR (связанного с bcr-abl) и GFP (связанного с NUP98 / HOXA9) находится в b и c соответственно. Клетки Tet H60 + и BC-CML подсчитывали в селезенке ( d ) и BM ( e ). Панели ( d ) и ( e ) объединяются из двух повторов ( n = 8 на группу).Столбцы — это средние значения ± стандартное отклонение
Иммунный отбор не учитывает устойчивость к GVL.
Чтобы выяснить, селектирует ли аллоиммунитет устойчивые к GVL клетки BC-CML, мы выполнили анализы CTL in vivo на невыделенных BC-CML и рецидивирующих BC-CML (рис. 2a). Рецидивирующие клетки BC-CML собирали от мышей B6.H60, которым были трансплантированы клетки BC-CML и T MH60 за 25-28 дней до этого. Невыбранные клетки BC-CML собирали от мышей B6.H60, которым трансплантировали клетки BC-CML без T MH60 .Невыбранные (помеченные фиолетовым клеточным трекером), рецидивирующие (меченные DeepRed) и контрольные H60 — K b — / — (немеченые) клетки BC-CML вводили мышам B6, которые были или не были иммунизированы DEC- H60 и FGK45 за семь дней до этого. При анализе через 18 часов свежие и рецидивирующие клетки BC-CML были одинаково убиты анти-H60 эффекторами (рис. 2b, c).
Рис. 2: Прогрессирующий лейкоз не является следствием появления устойчивых к GVL лейкозных клеток.Невыбранные (свежие) BC-CML и BC-CML с рецидивом GVL получали, как описано в методах.Схема эксперимента ( a ). Для тестирования уничтожения, направленного против H60, свежие и рецидивирующие BC-CML были помечены CellTrace Violet (CTV) или CellTracker DeepRed (соответственно) и перенесены вместе с H60 — K b — / — BC-CML (немаркированы) в B6. мышей, у которых были или не были антитела к H60 CD8 + T eff , полученные вакцинацией. Через 18 часов мышей умерщвляли для подсчета клеток BC-CML в селезенке и BM. Показать репрезентативную проточную цитометрию спленоцитов мышей без и с H60 T eff ( b ) и отношения свежего или рецидивирующего GVL BC-CML к H60 — K b — / — BC-CML в селезенка и БМ ( c ). d , e Свежие и рецидивирующие клетки BC-CML, которые были либо без импульса, либо с импульсом SIINFEKL (меченный DeepRed), вводили мышам, засеянным или необработанным OT-1. Показаны репрезентативная проточная цитометрия спленоцитов ( d ) и соотношения SIINFEKL-импульсный / неимпульсный в селезенке и BM ( e ). b — e представляют два эксперимента с пятью мышами в группе на эксперимент. Для статистического анализа использовали парный двусторонний тест t (среднее ± стандартное отклонение). P = 0,562 и P = 0,0815 при сравнении соотношений свежих или рецидивирующих GVL BC-CML и H60 — K b — / — BC-CML в селезенке и BM, соответственно. P = 0,9709 и P = 0,9067 при сравнении соотношений SIINFEKL-импульсный / неимпульсный в селезенке и BM, соответственно.
Мы также сравнили уничтожение клеток BC-CML с импульсным воздействием SIINFEKL трансгенными Т-клетками OT-1, чтобы учесть возможный отбор лейкозов со сниженной экспрессией H60. Невыбранные и рецидивирующие клетки BC-CML в импульсном режиме и SIINFEKL переносили мышам B6, засеянным клетками OT-1 и вакцинированными антителом против DEC205, модифицированным для экспрессии овальбумина и FGK45 за семь дней до этого.Опять же, рецидивирующие клетки BC-CML не были устойчивы к уничтожению Т-клеток по сравнению с невыбранными клетками BC-CML (фиг. 2d, e). Эти данные показывают, что в нашей модели иммунный отбор не учитывает устойчивость GVL. Поэтому мы дополнительно исследовали ответ анти-H60 CD8.
Неэффективная презентация антигена ограничивает GVL
Поскольку H60 в основном экспрессируется гемопоэтическими клетками, эффективная презентация антигена может стать ограничивающей, поскольку гемопоэтические клетки хозяина погибают от радиации и убивают Т-клетки 15 .Напротив, H60 будет становиться все более доступным за счет увеличения клеток BC-CML; однако было неизвестно, насколько хорошо клетки BC-CML напрямую стимулируют Т-клетки и действительно ли их miHA перекрестно презентируются донорскими клетками. Чтобы измерить презентацию антигена на 14 день после трансплантации (когда Tet H60 + клеток пик; рис. 1), мы инфузировали конгенный CD45.1 + C3H.SW T MH60 через 14 дней после трансплантации мышей B6.H60 с C3H.SW BM и CD45.2 + T MH60 , с BC-CML или без него.В качестве положительного контроля способности 14-го дня (D14) T MH60 реагировать на H60 некоторых мышей также иммунизировали DEC-H60 и FGK45 (конструкция, фиг. 3a). К дню +21 CD45.1 + D14 T MH60 претерпел небольшое расширение, далеко не так, как у T MH60 , введенного в день 0 (рис. 3b, c). Иммунизация FGK45 + DEC-H60 увеличивала D14 CD45.1 + Tet H60 + потомства более чем в 10 раз (с BC-CML или без него), что указывает на то, что клетки D14 могут быть активированы с эффективной презентацией антигена.Важно отметить, что D14 T MH60 в сочетании с FGK45 + DEC-H60 снижал количество BC-CML в селезенке и BM по сравнению с инфузией только T MH60 (рис. 3d).
Рис. 3: T MH60 , введенный во время неудачной трансплантации из-за отсутствия эффективной презентации антигена.Схема эксперимента ( а ). Мышей B6.H60 облучали и восстанавливали с помощью C3H.SW BM, C3H.SW CD45.2 + T MH60 (содержащих 10 4 Tet H60 + клеток) с или без BC-CML.На 14 день после трансплантации инфузировали свежий C3H.SW CD45.1 + T MH60 (содержащий 10 4 Tet H60 + клеток). Некоторые мыши также получали DEC-H60 + FGK45 для дальнейшей активации H60-реактивных Т-клеток. Мышей умерщвляли на 21 день после трансплантации для анализа потомства BC-CML и T MH60 в селезенке и BM. b Репрезентативное окрашивание спленоцитов Tet H60 на 21-й день. Показаны клетки Tet H60 + с 0-го дня (CD45.2 + ) и производное от 14-го дня (CD45.1 + ) T MH60 . Количественная оценка потомства T MH60 в день 0 и день 14 в селезенке и BM находятся в c . Общее количество BC-CML в селезенке и BM составляет d . Типичная проточная цитометрия ( e ) и количественная оценка экспрессии IFN-γ ( f ) D14 CD45.1 + и D0 CD45.2 + Tet Клетки H60 + , собранные в день +21. Данные объединены из 3 независимых экспериментов с 14 мышами в группе ( d ) или представляют 3 независимых эксперимента (4–5 мышей в группе) с аналогичными результатами ( b , c , f ). г , ч Мышей трансплантировали, как на панели А. Через четырнадцать дней после трансплантации мышам вводили свежий C3H.SW CD45.1 T MH60 с DEC-H60 и FGK45 или только FGK45. Было подсчитано общее количество потомства T MH60 (CD45.2 + ) на 0 день и потомства T MH60 (CD45.1 + ) на 14 день в селезенке и BM ( г ), а также процентное соотношение из них, которые являются IFN-γ +, показаны в h . Данные представляют два независимых эксперимента с 4 мышами в группе.Мыши i B6.H60 были облучены и восстановлены с помощью B6 (CD45.2 + ) T MH60 (содержащего 10 4 Tet H60 + клеток) и донорского BM из B6 CD11c-DTR или B6 CD40 — / — мышей. В день +14 было введено 5 × 10 4 свежих B6 CD45.1 + T MH60 , с или без FGK45. Когорте реципиентов CD11c-DTR BM вводили DT через день с 10 по 20 день. Мышей умерщвляли на 21 день и определяли потомство T MH60 в селезенке и определяли BM ( n = 4 на группу) .Для всех панелей данные были проанализированы с помощью непарного двухстороннего теста Стьюдента t . Столбцы представляют собой средние значения ± SEM, * P <0,05; ** P <0,01; *** P <0,001; и нс не имеет значения.
Удивительно, но только FGK45 усиливал ответ против H60 даже в отсутствие BC-CML, указывая на то, что были источники H60, которые не были эффективно представлены (фиг. 3g, h). FGK45 в сочетании с D14 CD45.1 + T MH60 также улучшил GVL (дополнительный рис.2А). Стимулирование GVL с помощью FGK45 не было связано с прямым действием на клетки BC-CML, поскольку FGK45 не уменьшал количество BC-CML у мышей RAG2 — / — γc — / — , трансплантированных с клетками BC-CML и без Т-клеток ( Дополнительный рис. 2B).
Добавление DEC-H60 к FGK45 последовательно приводило к большему увеличению количества полученных из D14 клеток Tet H60 + в BM и увеличению количества клеток Tet H60 + , производных дня 0 (D0), подсчитанных на день +21 (фиг. 3г). Поэтому мы провели эксперименты, в которых трансплантированные мыши получали только D14 T MH60 , с DEC-H60 или с DEC-H60 + FGK45 (дополнительный рис.2С). Один только DEC-H60 увеличивал экспансию D14 T MH60 , хотя и не так эффективно, как FGK45 + DEC-H60, указывая на то, что и антиген, и субоптимальная активация APC ограничивают экспансию H60-реактивных Т-клеток.
Чтобы определить, действует ли FGK45 на донорские и / или остаточные производные от хозяина APC, мы сравнили его действие у мышей, трансплантированных диким типом (wt) или CD40 — / — BM с использованием системы B6 → B6.H60 в качестве C3H. Мыши SW CD40 — / — отсутствовали. Облученных мышей B6.H60 восстанавливали с помощью B6 или B6 CD40 — / — BM.В день +14 все мыши получали B6 CD45.1 T MH60 , и когорту из каждой группы лечили FGK45. FGK45 имел меньшее влияние на экспансию Tet H60 + у реципиентов B6 CD40 — / — BM, что указывает на то, что наибольшая активность FGK45 проявляется на донорских APC, перекрестно презентирующих H60 хозяина (дополнительный рис. 2D). Поскольку мыши не получали T MH60 в день 0, вероятно, существовало значительное количество остаточных APC реципиента, что может объяснять активность FGK45 у реципиентов CD40 — / — BM.
Чтобы определить, необходимы ли донорские дендритные клетки (ДК), мышам B6.H60 трансплантировали wt B6 CD45.2 T MH60 (для увеличения клиренса APC реципиента) и BM от мышей B6, которые экспрессируют рецептор дифтерийного токсина. (DTR) под контролем гена CD11c (CD11c-DTR 24 ) или B6 CD40 — / — BM. Начиная с дня +10, когорте реципиентов CD11c-DTR BM вводили дифтерийный токсин (DT) через день для истощения донорских ДК. На +14 день все мыши получили B6 CD45.1 + T MH60 , с FGK45 или без него (конструкция, дополнительный рис. 2E). FGK45 снова оказался менее эффективным у реципиентов B6 CD40 — / — BM (фиг. 3i). Важно отметить, что истощение донорских DC полностью предотвращает усиление FGK45 ответа Tet H60 , указывая на то, что донорские DC, которые перекрестно представляют реципиент H60, были основными мишенями для FGK45 (рис. 3i).
Влияние H60, происходящего от лейкемии, на ответ против H60
Было удивительно, что недостаточное представление H60 ограничивало активацию H60-реактивных Т-клеток у мышей с существенной нагрузкой H60 + BC-CML.Чтобы проверить, насколько эффективно перекрестно представлены miHA, происходящие от лейкемии, облученных мышей B6 восстанавливали клетками C3H.SW BM, C3H.SW T MH60 и B6 H60 + K b — / — BC-CML. На 13 день после трансплантации клеток Tet H60 + было немного по сравнению с аналогичным образом трансплантированными реципиентами B6.H60, и они были аналогичны контрольным мышам, которым трансплантировали клетки H60 — K b — / — BC-CML (фиг. 4a), свидетельствует о неэффективной перекрестной презентации.
Фиг.4. Апоптоз лейкемии способствует перекрестной презентации miHA.a – c Панели показывают экспериментальные планы, репрезентативную проточную цитометрию и количественный анализ клеток Tet H60 + . a Для проверки возможности перекрестной презентации H60, производного от BC-CML, мышей B6 облучали и восстанавливали с помощью C3H.SW BM, H60 + K b — / — BC-CML и C3H.SW T MH60 . В качестве положительного контроля для расширения Tet H60 + облученных мышей B6.H60 восстанавливали с помощью H60 + BC-CML с BM и T MH60 из C3H.Мыши SW или B6. В качестве отрицательного контроля облученных мышей B6 восстанавливали с помощью C3H.SW BM, H60 — K b — / — BC-CML и C3H.SW T MH60 . В день +13 несколько клеток Tet H60 + можно было обнаружить у реципиентов H60 + K b — / — BC-CML, и их количество было таким же, как у реципиентов H60 — K b− / — BC-CML. ( b ) Чтобы определить, может ли H60 + BC-CML непосредственно стимулировать T MH60 in vivo, облученный B6 β2M — / — был восстановлен с помощью B6 β2M — / — BM, B6 T MH60 и H60 + K b + / + BC-CML или H60 + K b — / — BC-CML в качестве отрицательного контроля.В качестве положительного контроля облученных мышей B6.H60 восстанавливали клетками B6 BM, B6 T MH60 и H60 + BC-CML. На +10 день клетки Tet H60 + не обнаруживались в крови у реципиентов K b + / + и K b — / — H60 + BC-CML. c Чтобы проверить, может ли GVL увеличивать перекрестную презентацию, облученных мышей B6 восстанавливали клетками C3H.SW BM, CD45.2 + C3H.SW CD4 и H60 + K b — / — BC-CML клетки.На +14 день после трансплантации клетки CD45.1 + C3H.SW CD8 + T MH60 клетки переносили реципиентам с FGK45 для стимулирования перекрестной презентации. Мышей умерщвляли на +21 день и подсчитывали клетки Tet H60 + CD45.1 + . В качестве положительного контроля облученный B6.H60 был восстановлен с помощью C3H.SW BM и K b + / + H60 + BC-CML с C3H.SW CD45.1 + T клеток MH60 и FGK45, введенным в день. +14. Для a — c данные являются репрезентативными для двух независимых экспериментов с 3-4 мышами в группе. d , e Design ( d ). Мышей B6 и B6 K b — / — облучали и восстанавливали с помощью C3H.SW BM и iCasp9 B6.H60K b — / — BC-CML. CID вводили на +12–14 дни, чтобы вызвать апоптоз BC-CML. В день +14 клеткам C3H.SW CD45.1 + T MH60 вводили FGK45. Мышей умерщвляли в день +21 и определяли количество клеток Tet H60 + в селезенке и BM ( e ). Данные объединены из двух экспериментов (7–9 мышей в группе).Для всех панелей данные были проанализированы с помощью непарного двухстороннего теста Стьюдента t . Столбцы — это средние значения ± SEM. * P <0,05; ** P <0,01.
Чтобы определить, насколько хорошо лейкозные клетки напрямую стимулируют аллореактивные Т-клетки, облученных мышей с дефицитом бета-2-микроглобулина B6 (β2M — / — ) восстанавливали с помощью B6 β2M — / — BM, wt H60 + BC -CML и B6 T MH60 . У таких мышей только клетки BC-CML были MHCI + и способны стимулировать T MH60 .На 10-й день после трансплантации мы не смогли обнаружить клетки CD8 + Tet H60 + , тогда как у контрольных реципиентов B6.H60 был большой ответ Tet H60 + (фиг. 4b).
Чтобы проверить, нужно ли убивать лейкозные клетки для перекрестной презентации их miHA, мы трансплантировали мышам B6 с CD45.2 + C3H.SW BM, K b — / — H60 + BC-CML вдоль с клетками CD4 C3H.SW, которые опосредуют GVL в этой модели 25 . На +14 день мышам вводили CD45.1 + T MH60 и FGK45. Несмотря на значительную CD4-опосредованную GVL, экспансия Tet H60 + была незначительной (фиг. 4c).
Возможно, что величина или время гибели Т-лимфоцитов CD4 + были неоптимальными для эффективной перекрестной презентации. Поэтому мы сконструировали клетки H60 + K b — / — BC-CML для экспрессии индуцибельной каспазы 9 (iCasp9) 26 . Лечение мышей с этими лейкозами AP20187 (химическая индуцированная димеризация; CID) быстро индуцировало апоптоз (дополнительный рис.3). Облученных мышей B6 или B6 K b — / — (для ограничения представления H60 донорскими клетками) восстанавливали с помощью C3H.SW BM и H60 + K b — / — iCasp9 BC-CML. Через 12-14 дней после трансплантации когорте вводили CID. На день +14 все мыши получали C3H.SW T MH60 и FGK45 (дизайн, фиг. 4d) для измерения перекрестного представления. На 21 день наблюдалось устойчивое увеличение Т-клеток Tet H60 + у получателей CID B6 и B6 K b — / — и значительное увеличение даже у необработанных мышей, вероятно, из-за спонтанной димеризации iCasp9 (рис.4д). Следовательно, антигены, происходящие от лейкемии, могут быть перекрестно презентованы донорскими APC, но только после значительного апоптоза лейкемии.
Истощение Т-клеток способствует отказу GVL
В то время как DEC-H60 и FGK45 индуцировали экспансию T MH60 , введенного в день +14, они менее эффективно стимулировали потомство T MH60 , введенное в день 0 (рис. 3c, грамм). Более того, меньшая фракция потомства T MH60 дня 0 продуцировала IFN-γ при рестимуляции пептидом (рис.3д, е, з), характерный для истощения Т-лимфоцитов. Поэтому мы дополнительно проанализировали потомство T MH60 от мышей B6.H60, которым трансплантировали C3H.SW BM и T MH60 , с или без H60 + BC-CML. К 21–25 дням клетки Tet H60 + из костного мозга и селезенки имели равномерно повышенную регуляцию PD-1, и большинство потомков экспрессировало Tim-3, TIGIT и LAG3, что все связано с истощением (рис. 5a, b и дополнительный рис. 4A). . У них также была снижена продукция IFN-γ по сравнению со свежим T MH60 и клетками Tet H60 + , собранными на +7 день после трансплантации (рис.5c и дополнительный рис. 4B, C).
Рис. 5: клетки H60 + BC-CML способствуют истощению через родственные взаимодействия.a – d B6.H60 Мышей облучали и восстанавливали с помощью C3H.SW BM, C3H.SW T MH60 , с или без B6.H60 BC-CML. Через 21-25 дней после трансплантации мышей умерщвляли для анализа. Экспрессия PD-1, Tim-3, TIGIT и LAG-3 на клетках Tet H60 + в селезенке и BM и фракция клеток Tet H60 + , экспрессирующих эти ингибирующие рецепторы по отдельности и в комбинации, составляет a и b соответственно. c Типичная проточная цитометрия (левые панели) и количественное определение экспрессии IFN-γ (правые панели). d Экспрессия Eomes и Blimp-1 в клетках Tet H60 + селезенки и BM. Панели и представляют три эксперимента с пятью мышами в группе. Мыши e , f B6.H60 были облучены и восстановлены с помощью C3H.SW BM, C3H.SW T MH60 , без BC-CML (пять мышей на группу в e ; четыре мыши на группу в ). f ), H60 + BC-CML (четыре мыши на группу в панелях e ; шесть мышей на группу в f ), H60 + K b — / — BC-CML (три мыши на группа в e , f ) или H60 + PD-L1 — / — PD-L2 — / — BC-CML (четыре мыши на группу в e и f ).Мышей умерщвляли в день +16 (для H60 + K b — / — BC-CML) и день +27 (для H60 + PD-L1 — / — PD-L2 — / — BC-CML). Клетки Tet H60 + анализировали на экспрессию TIGIT и продукцию IFN-γ. Данные представляют два эксперимента. г Мышей пересаживали, как в a — d . На 21 день после трансплантации клетки Tet H60 + анализировали на поглощение 2-NBDG и окрашивание MitoFM и TMRE. Показаны репрезентативные данные проточной цитометрии и средняя интенсивность флуоресценции (MFI).Данные представляют три эксперимента (4–5 мышей в группе). Для всех панелей данные были проанализированы с помощью непарного двухстороннего теста Стьюдента t . Столбцы — это средние значения ± SEM. * P <0,05; ** P <0,01; *** P <0,001.
Eomes и Blimp-1 были высоки в клетках Tet H60 + , что снова соответствует фенотипу истощения (фиг. 5d). Важно отметить, что по сравнению с мышами, которым трансплантировали без лейкемии, клетки Tet H60 + от мышей, которым трансплантировали BC-CML, имели больше характеристик истощения — увеличение экспрессии ингибирующих молекул, увеличение Blimp-1 и Eomes и снижение продукции IFN-γ, что указывает на то, что стимулирующие клетки BC-CML усиливают истощение (рис.5а – г). Этот эффект требовал контакта с родственным TCR: MHCI, поскольку K b — / — H60 + BC-CML не усиливал истощение (рис. 5e). H60 + PD-L1 / L2 — / — BC-CML вызывал такое же истощение, как и H60 + PD-ligand-intact BC-CML, указывая на то, что воздействие антигена, а не PD-лигандов, способствует истощению (рис. 5f) .
Клетки Tet H60 + , выделенные после трансплантации, имели метаболические характеристики истощения 27 . Свежевыделенный T MH60 имел низкий уровень поглощения 2-NBDG и низкую митохондриальную массу и митохондриальный мембранный потенциал, как и ожидалось для покоящихся клеток (дополнительный рис.4D, E). Напротив, на +7 день после трансплантации клетки селезенки и BM Tet H60 + имели повышенное поглощение глюкозы и митохондриальную массу, при этом большинство клеток также имели яркое окрашивание TMRE, что соответствовало активному дыханию (дополнительный рис. 4D, E). Однако к дню +21 клетки Tet H60 + потеряли митохондриальную массу, при этом некоторые из них были яркими по TMRE (рис. 5g и дополнительный рис. 4D, E). Присутствие BC-CML привело к умеренному увеличению митохондриальной массы, но без последовательного изменения митохондриальной деполяризации (рис.5г).
Ингибирование PD-1, но не Tim-3, LAG3 или TIGIT, улучшает GVL
Учитывая доказательства истощения Т-клеток, мы исследовали, улучшит ли посттрансплантационная блокада PD-1 эффективность T MH60 . Облученных мышей B6.H60 восстанавливали с помощью C3H.SW BM, C3H.SW T MH60 и B6.H60 BC-CML. α-PD1 или изотипический контроль начинали на +7 день, чтобы избежать побочных эффектов блокады PD-1 на раннюю активацию Т-клеток 28 . α-PD1 уменьшал процент клеток BC-CML в крови на +14 день и их количество в селезенке и BM на +21 день.α-PD1 также увеличивал количество клеток Tet H60 + в BM (рис. 6a, b). Важно отметить, что у мышей, обработанных α-PD1, клетки Tet H60 + продуцировали больше IFN-γ и имели пониженную экспрессию TIGIT (рис. 6b-d). Увеличение продукции IFN-γ при стимуляции in vitro отражало увеличение продукции IFN-γ in vivo, поскольку экспрессия MHCII на клетках BC-CML, которые регулируются IFN-γ 14 , была выше при блокаде PD-1 (рис. 6д).
Рис. 6. Лечение mAb против PD-1 увеличивает GVL, опосредованную T MH60 .мышей B6.H60 облучали и восстанавливали с помощью C3H.SW BM, B6.H60 BC-CML и C3H.SW T MH60 . С +7 до +19 дней после трансплантации мышей лечили α-PD1 или изотипическим контролем. Мышей умерщвляли на 21 день для анализа клеток BC-CML и Tet H60 + . Процент BC-CML в крови и общее количество клеток BC-CML в селезенке и BM на 21 день показаны в a . Общее количество Tet H60 + в селезенке и BM и процент из них, которые являются IFN-γ + в селезенке, составляют b . c , d Репрезентативные гистограммы потока ( c ) и количественная оценка экспрессии TIGIT на клетках Tet H60 + в селезенке и BM ( d ). ( e ) Процент клеток BC-CML, которые являются MHCII + . ( f ) Мышей трансплантировали, как в , — и , за исключением того, что мышей обрабатывали α-PD1, α-LAG3, обоими или изотипическим контролем. Общее количество Tet H60 + ( г, ) и процент из них, которые были IFN-γ + ( h ) в селезенке и BM.( i ) MFI Tim-3 и TIGIT на клетках Tet H60 + в селезенке и BM. Данные из ( a ) взяты из одного эксперимента. Дополнительные независимые эксперименты по сравнению блокады PD-1 с изотипом проводятся в экспериментах по анализу блокады LAG-3 ( f , g ) и блокады Tim-3 и TIGIT (дополнительный рисунок 5, b , h ). В целом, 22 мыши получали изотипический контроль, а 17 — только блокаду PD-1. Еще 14 мышей получили блокаду PD-1 другим блокирующим агентом.Эксперименты по проверке блокады Tim-3, TIGIT и LAG3 были единичными. Для всех панелей данные были проанализированы с помощью непарного двухстороннего теста Стьюдента t . Столбцы — это средние значения ± SEM. * P <0,05; ** P <0,01; и *** P <0,001.
Затем мы протестировали блокаду Tim-3, TIGIT и LAG3, отдельно или в комбинации с α-PD1 (дизайн, дополнительный рис. 5A). Во всех экспериментах α-PD1 улучшал GVL, увеличивал количество клеток BM Tet H60 + , процент клеток IFN-γ + Tet H60 + как в BM, так и в селезенке, а также снижал экспрессию Tim-3 и TIGIT ( Инжир.6f – i; Дополнительный рис. 5). Однако блокада LAG3 (рис. 6f), Tim-3 или TIGIT (дополнительный рис. 5B, F) не увеличивала GVL, даже в комбинации с α-PD1 в условиях, в которых α-PD1 был только частично эффективным. TIGIT-блокада уменьшала количество клеток Tet H60 + , одновременно увеличивая процент, который продуцирует IFN-γ (дополнительный рис. 5G, H), возможно, за счет истощения клеток с наивысшей экспрессией TIGIT. LAG3-блокада увеличивала процент клеток Tet H60 + , продуцирующих IFN-γ, но не подавляла повышающую регуляцию Tim-3 или TIGIT (рис.6h, i).
α-CD40 во время трансплантации улучшает GVL
Учитывая, насколько эффективно FGK45 способствует активации T MH60 , введенного на +14 день, мы протестировали FGK45 в сочетании с T MH60 , введенным в 0 день в C3H.SW → Система B6.H60. День 0 FGK45 резко снижал количество BC-CML в селезенке и BM в день +21, совпадая с увеличением количества клеток BM Tet H60 + (фиг. 7a, b). FGK45 увеличивал продукцию IFN-γ клетками Tet H60 + с меньшим количеством экспрессии высоких уровней TIGIT, PD-1 и Tim-3 (рис.7в, г). В соответствии с увеличением количества клеток IFN-γ + , экспрессия MHCII была выше в клетках BC-CML, собранных от мышей, обработанных FGK45 (фиг. 7e).
Фиг. 7. Обработка mAb против CD40 в день 0 увеличивает GVL, опосредованную T MH60 .( a — e ) Мышей B6.H60 облучали и восстанавливали с помощью B6 BM, B6.H60 BC-CML и B6 T MH60 , с введением FGK45 или без него на 0 день. Мышей умерщвляли на день +21 для анализа клеток BC-CML и Tet H60 + .Общее количество клеток BC-CML и их процентное содержание, которые являются MHCII + в селезенке и BM, составляют , и и , соответственно. Общее количество клеток Tet H60 + ( b ), процент клеток Tet H60 + , продуцирующих IFN-γ ( c ), и экспрессия PD-1, Tim-3 и TIGIT на Tet Показаны H60 + клеток ( d ) в селезенке и BM. Для a — c и e данные объединены из двух независимых экспериментов с 7-8 мышами в группе.Панель d представляет два эксперимента с 3-4 мышами в группе. ( f ) Тот же экспериментальный план, что и в ( a ), за исключением того, что донорская BM была от мышей B6 или CD40 — / — . Показано общее количество клеток BC-CML в селезенке и BM. Данные взяты из одного эксперимента (3-4 мыши в группе). ( г ) B6.H60 + B6 → B6 и B6.H60K b — / — + B6 → B6 Химеры BM были повторно облучены и восстановлены с помощью B6 CD40 — / — BM и B6 T MH60 с или без FGK45.Показаны процентные доли клеток Tet H60 + в крови на +14 день и общее количество Tet H60 + на +21 день в селезенке и BM. Данные представляют два эксперимента с 3-4 мышами в группе. ( ч ) B6.H60 CD11c.DTR + → B6 K b — / — BM Химеры были облучены и восстановлены с помощью B6 BM и B6 T MH60 с или без FGK45 в день 0 (необработанные; необработанные) . Мыши получали DT в день -2 и день 0 для истощения реципиентных DC, их умерщвляли через 7 дней после трансплантации и определяли количество Tet H60 + в селезенке и клетках ВМ.Данные являются репрезентативными для 2 экспериментов (4–5 мышей в группе). ( i — -1) Облученных мышей B6 actH60 восстанавливали с помощью B6.H60 BC-CML, C3H.SW BM и T MH60 , с FGK45 или без него. Мышей умерщвляли на 18 день. Показано количество клеток BC-CML ( i ) и клеток Tet H60 + ( j ) в селезенке и BM, частота клеток Tet H60 + , которые были IFN-γ . + ( k ) и TIGIT MFI ячеек Tet H60 + ( l ).Панели i – l взяты из однократного повторения с 3-4 мышами в группе. Для всех панелей данные были проанализированы с помощью непарного двухстороннего теста Стьюдента t . Столбцы представляют собой средние значения ± SEM, * P <0,05; ** P <0,01; и *** P <0,001.
FGK45 в первую очередь действовал на клетки-реципиенты, поскольку не было снижения GVL у реципиентов CD40 — / — BM (фиг. 7f). Возможно, что FGK45 увеличил прямое представление K b : LTFNYRNL; в качестве альтернативы или в дополнение это могло улучшить перекрестное представление.Чтобы решить эту проблему, мы создали смешанные химеры BM, в которых APC-получатели могли напрямую представлять H60 ([B6.H60 + B6] → B6 химеры) или только перекрестно присутствовать H60 ([B6.H60 K b — / — + B6] → B6 химеры). Через 8 недель эти химеры были повторно облучены и повторно трансплантированы с использованием B6 CD40 — / — BM и B6 T MH60 , с FGK45 или без него (конструкция, дополнительная фиг. 6A). FGK45 только усиливал ответ Tet H60 + в химерах (B6.H60 + B6) → B6, в которых H60 присутствовал напрямую, тогда как в (B6.H60 K b — / — + B6) → B6 химеры, где FGK45 может только способствовать перекрестной презентации H60 с помощью B6 K b -интактных APC (фиг. 7g). Тем не менее, клетки Tet H60 + в конечном итоге размножались даже в химерах (B6.H60 K b — / — + B6) → B6, подтверждая, что кросс-презентация действительно имеет место 16 . При перекрестном представлении только H60 маркеры истощения были снижены, что свидетельствует о том, что интенсивность воздействия miHA вызывает истощение (дополнительный рис. 6B, C).
Хотя реципиентные DC не требуются для GVHD в моделях, где необходимы гемопоэтические клетки хозяина 29,30 , возможно, что активность FGK45 зависела от DC.Чтобы проверить это, мы сначала скрестили мышей B6.H60 с мышами B6 CD11c-DTR 24 , а затем создали химеры B6.H60 CD11c-DTR → B6 K b — / — BM, в которых единственными клетками-хозяевами, которые могут представлять H60, являются происходит из B6.H60 CD11c-DTR BM. Эти химеры были обработаны DT или PBS, повторно облучены и трансплантированы с помощью C3H.SW BM и T MH60 , с FGK45 или без него. FGK45 усиливал ответ Tet H60 у мышей, получавших как PBS, так и DT (фиг. 7h). Тем не менее, DT-обработанные мыши, которые получали FGK45, генерировали умеренно меньше клеток Tet H60 + , что позволяет предположить, что DC, хотя и не требуемые, являются мишенями для FGK45.
Хотя идеальная мишень miHA должна быть ограничена гемопоэзом, как и H60, некоторые miHA могут также экспрессироваться в других тканях. Ранее мы показали, что T MH60 вызывает небольшую GVHD даже у B6 actH60 мышей, которые экспрессируют H60, повсеместно управляемые актиновым промотором 18 . Поэтому мы исследовали влияние FGK45 на T MH60 и на GVL у реципиентов actH60. Облученных мышей actH60 восстанавливали с помощью C3H.SW BM, C3H.SW T MH60 и B6.H60 BC-CML.Одну группу обрабатывали FGK45 в день 0, а мышей умерщвляли на 18 день. FGK45 резко снижал количество клеток BC-CML в BM и селезенке (фиг. 7i). Хотя количество клеток Tet H60 + не увеличивалось, наблюдалось увеличение фракции IFN-γ + в селезенке и снижение экспрессии TIGIT как в селезенке, так и в костном мозге, что свидетельствует об улучшении приспособленности Т-клеток (фиг. 7j). –L).
Далее мы сосредоточились на том, как день 0 FGK45 изменяет Tet H60 + активацию Т-клеток (дизайн, дополнительный рис.7А). К +3 дню клетки Tet H60 + от мышей, обработанных FGK45, имели повышенную экспрессию CD25, 4-1BB, GITR и OX40 (фиг. 8a). На день +4 большая фракция имела разбавленный CFSE (фиг. 8b). Однако большая часть клеток Tet H60 + от мышей, обработанных FGK45, была аннексином V + и 7-AAD + (фиг. 8c), что позволяет предположить, что повышенная пролиферация в первую очередь влияет на эффект FGK45. К +7 и +14 дням обработка FGK45 давала 5-10-кратное увеличение клеток Tet H60 + без изменения их продукции IFN-γ (рис.8г). Однако клетки Tet H60 + от мышей, обработанных FGK45, имели более низкую экспрессию PD-1, Tim-3 и TIGIT с увеличением Eomes low Tbet high клеток (фиг. 8e, f и дополнительный фиг. 7B). , C), которые, как сообщается, обладают большей пролиферативной способностью 31 .
Фиг. 8: Анти-CD40 усиливает стимулирующие и снижает ингибирующие рецепторы на клетках Tet H60 + CD8.a — c Мышей B6.H60 облучали и восстанавливали B6 BM и CFSE-меченный B6 T MH60 , с или без дня 0 FGK45.Когорты умерщвляли через 3 дня (, —, ) или через 7 и 14 дней после трансплантации (, —, f ) для оценки пролиферации, гибели и фенотипов клеток Tet H60 + в селезенке. FGK45 увеличивал экспрессию Tet H60 + Т-клетками 4-1BB, IL-2Rα, OX-40 и GITR ( a ) и их индекс деления ( b ), но увеличивал апоптоз ( c ). Общее количество клеток Tet H60 + и их процентное содержание, которые являются IFN-γ + в селезенке и BM, показаны в d .FGK45 снижал экспрессию PD-1, Tim-3 и TIGIT на +7 и +14 дни ( e ). FGK45 также увеличивал фракцию клеток, которые имели Tbet high и Eomes low ( f ). Панели a — d объединены из двух независимых экспериментов (7–9 мышей в группе). Панели e , f представляют два эксперимента (4–5 мышей на группу на эксперимент). Для всех панелей данные были проанализированы с помощью непарного двухстороннего теста Стьюдента t .Столбцы — это средние значения ± SEM. * P <0,05; ** P <0,01; и *** P <0,001.
Исчерпание наивного аллореактивного потомства
Мы использовали донор Т MH60 в наших экспериментах, чтобы мы могли отслеживать все GVL-индуцирующие Т-клетки. Хотя T CM имеет много общего с наивными Т-клетками (T N ), мы также исследовали истощение и влияние FGK45 на H60-реактивное потомство CD8 + T N . Облученных мышей B6.H60 восстанавливали с помощью C3H.SW BM и CD8 клетки от невакцинированных доноров. Одна группа получала FGK45 в день 0, а мышей умерщвляли в дни +7 и +14 для анализа. Хотя мы не отсортировали T N , спонтанный T M не дает ответа против H60 18 ; следовательно, все клетки Tet H60 + произошли от T N . К +7 суткам FGK45 увеличивал количество клеток Tet H60 + в селезенке и КМ примерно в 100 раз (рис. 9а, б). К +14 дню в селезенке было больше клеток Tet H60 + , но не в КМ (рис.9в). FGK45 уменьшал, но не предотвращал истощение аллореактивных Т-клеток. В селезенке продукция IFN-γ была одинаково низкой в обеих группах; однако в день +14 больше клеток IFN-γ + Tet H60 + присутствовало в костном мозге мышей, обработанных FGK45. В соответствии с этим FGK45 снижает экспрессию PD-1, TIGIT и Eomes на клетках Tet H60 + .
Рис. 9: Анти-CD40 усиливает ответ против miHA наивных клеток CD8.( a — c ) Облученный B6.Мышей H60 восстанавливали клетками C3H.SW BM и C3H.SW CD8 от неманипулированных доноров (называемых наивными Т-клетками; T N ), с введением FGK45 в день 0 или без него. Репрезентативное окрашивание Tet H60 находится в . Количество клеток Tet H60 + , процентные доли IFN-γ + и MFI PD-1, TIGIT и Eomes в дни +7 и +14 находятся в b , c соответственно. Панели a — c представляют 2 эксперимента ( n = 4 или 5 на группу). d FGK45 увеличивает T N CD8-опосредованную GVL. Мышей B6.H60 облучали и восстанавливали клетками BC-CML, B6 BM и B6 CD8 от неманипулированных доноров, с FGK45 или без него. Мышей умерщвляли на +16 день. Показаны количества клеток BC-CML, клеток Tet H60 + , процентное содержание Tet H60 + , которые были IFN-γ + , и MFI TIGIT, Tim-3, Eomes и Blimp-1 в селезенке и BM. Данные взяты из одного эксперимента (четыре мыши на группу). e FGK45 увеличивает GVL, нацеленный на другие miHA.Облученных мышей B6 восстанавливали клетками B6 BC-CML, C3H.SW BM и CD8 с FGK45 или без него. Мышей умерщвляли на 18-е сутки. Показаны количества клеток BC-CML, процент донорских клеток Ly9.1 + CD8 + , которые были IFN-γ + или PD-1 + Tim-3 + и MFI TIGIT и Eomes на донорских клетках CD8. Данные взяты из одного эксперимента (4–5 мышей в группе). Все панели были проанализированы с помощью непарного двухстороннего теста Стьюдента t . Столбцы — это средние значения ± SEM.* P ≤ 0,05; ** P ≤ 0,006; *** P ≤ 0,007.
FGK45 также оказал сильное влияние на клетки Tet H60- в реципиентах клеток CD8 от неманипулятивных доноров C3H.SW (дополнительная фигура 8). На +7 день FGK45 увеличил количество клеток Tet H60- CD8 как в BM, так и в селезенке более чем в 10 раз, что совпало с большим увеличением доли клеток, экспрессирующих PD-1, TIGIT и Tim-3. . К +14 дню количество клеток Tet H60- CD8 было более сходным у мышей, обработанных FGK45, и необработанных мышей, как и частота клеток, экспрессирующих PD-1, TIGIT и Tim-3.В контексте увеличения количества H60-реактивных клеток у тех же мышей, обработанных FGK45, эти данные предполагают, что FGK45 также ускоряет пролиферацию донорских клеток CD8, реактивных против miHA, отличных от H60.
FGK45 также способствовал GVL, опосредованному H60-реактивным потомством CD8 + T N . Чтобы гарантировать, что только H60-реактивные Т-клетки опосредуют GVL, мы использовали систему B6 → B6.H60. Облученных мышей B6.H60 восстанавливали клетками B6 BM и CD8 и B6.H60 BC-CML с или без FGK45.FGK45 уменьшал количество клеток BC-CML и увеличивал количество клеток Tet H60 + CD8 (фиг. 9d). FGK45 снижал экспрессию TIGIT и Eomes на клетках Tet H60 + , что свидетельствует об улучшении приспособленности Т-клеток. В то время как фракции клеток IFN-γ + Tet H60 + были сходными у необработанных и обработанных FGK45 мышей, экспрессия BC-CML MHCII была выше у мышей, обработанных FGK45, что свидетельствует о большей экспозиции IFN-γ in vivo.
FGK45 аналогичным образом улучшал GVL, опосредованный клетками CD8, реагирующими на miHA, отличные от H60.Облученных мышей B6 восстанавливали клетками B6 BC-CML и C3H.SW BM и CD8. Одной группе вводили FGK45 в день 0. На день +18 FGK45 снижал количество клеток BC-CML в селезенке и BM примерно в 100 раз. Хотя мы не могли отслеживать клетки CD8, нацеленные на конкретный miHA, FGK45 увеличивал долю IFN-γ + в клетках CD8 и снижал частоту клеток CD8 с фенотипом истощения (рис. 9e).
TOX
+ и TCF-1 + аллореактивные Т-клетки развиваются после трансплантацииМы также исследовали, индуцирует ли постоянная доступность аллоантигена в среде трансплантата экспрессию TOX, фактора транскрипции, который, как недавно было показано, способствует развитию Т-клеток. исчерпание 32,33,34,35,36,37 .Мы дополнительно исследовали, возникла ли субпопуляция TCF-1 + клеток Tet H60 + . Такие клетки были предложены как предшественники истощенных Т-клеток 32,34,35,36,37,38,39 .
Облученных мышей B6.H60 восстанавливали клетками C3H.SW BM и CD8 либо от неманипулированных доноров C3H.SW (обозначаемых как T N ), либо от T M от мышей C3H.SW, вакцинированных H60 (T N ). Когортам также вводили FGK45. TOX равномерно индуцировался во всех T N или T MH60 -производных клетках Tet H60 + в селезенке (рис.10а, б; Дополнительная фиг. 9A) и BM (дополнительная фиг. 9B) с более высокими значениями TOX MFI в потомстве T MH60 . Экспрессия TOX коррелировала с уровнями PD-1 и связыванием Tet H60 . FGK45 снижает MFI TOX, особенно в селезенке, и снижает частоту клеток Tet H60 + с высокими MFI как для TOX, так и для PD-1 (фиг. 10b и дополнительный фиг. 9B). Экспрессия TOX в T N -отрицательных клетках Tet H60 была бимодальной, с дискретными популяциями PD-1 high TOX high и PD-1 low TOX low клеток (дополнительный рис.9В, Г). FGK45 увеличивал частоту Tet H60- PD-1 high TOX high клеток в селезенке, возможно, за счет усиления размножения аллореактивных клеток CD8.
Рис. 10: Аллореактивные клетки TOX + и TCF-1 + развиваются после трансплантации.Облученных мышей B6.H60 восстанавливали с помощью C3H.SW BM и либо C3H.SW T MH60 (содержащего 10 4 T MH60 ), либо 10 6 клеток CD8 из неманипулированного C3H.SW-мыши. Реципиенты были умерщвлены для анализа на 8-й день. Типичная проточная цитометрия (стробирование по клеткам CD8 + Tet H60 + ) экспрессии TOX по сравнению с PD-1 и Tet H60 находится в a . TOX MFI был больше в Tet H60 + PD-1 high по сравнению с Tet H60 + PD-1 low (2 левых столбца) и Tet H60 с высоким по сравнению с Tet H60 low (2 правые столбцы) ). FGK45 снизил TOX MFI и процент потомков T N Tet H60 + , которые были как PD-1 high , так и TOX high .Эти данные количественно определены в b, и на дополнительном рисунке 8. c Экспрессия TCF-1 по сравнению с CD39, KLRG1, PD-1, Tim-3 и Ly-108 клеток Tet H60 + из селезенки. d Частота клеток Tet H60 + , которые были CD39 low TCF-1 + клеток в селезенке (слева) и BM (справа). Показанное в e является репрезентативным окрашиванием TCF-1 по сравнению с CD39, KLRG1, PD-1, Tim-3 и Ly-108 Tet H60 -отрицательных клеток селезенки и BM.Процент клеток Tet H60− , которые были CD39 low TCF-1 + в селезенке и BM, показаны в f . TOX MFI в b являются репрезентативными для двух независимых экспериментов (5-6 мышей в группе). Остальные панели в b , d и f объединены из двух независимых экспериментов ( n = 8 в необработанной группе; n = 12 в группе FGK45). Для всех панелей данные были проанализированы с помощью непарного двухстороннего теста Стьюдента t .Столбцы — это средние значения ± SEM. * P <0,05 ; ** P <0,005 ; *** P <0,0005.
Tet H60 + TCF-1 + клетки появлялись во всех группах к дню + 7 (фиг. 10c, d; дополнительный рисунок 9E, F). Это были CD39 low с более низкой экспрессией KLRG-1, Tim-3 и PD-1 и более высокой экспрессией Ly108 ( slamf6 ) по сравнению с клетками TCF-1 —. Этот фенотип близко соответствует фенотипу CD8 + Т-клеток, идентифицированных как предшественники истощенных Т-клеток при хронической инфекции LCMV и в моделях опухолей 34,35,36,37,39 .CD39 — Клетки TCF-1 + содержали меньшую фракцию потомства Tet H60 + T MH60 , чем Tet H60 + потомства клеток CD8 от невакцинированных доноров, и на эту частоту не влиял FGK45, что позволяет предположить что T N может быть более склонным к развитию в клетки TCF-1 + . Напротив, FGK45 уменьшал фракцию клеток Tet H60 + , производных T N , которые были CD39 — TCF-1 + , возможно, за счет уменьшения воздействия антигена за счет создания более эффективного ответа.В реципиентах T N значительная часть Tet H60 -отрицательных клеток также дифференцировалась в TCF-1 + CD39 low KLRG1 low TIM3 low Ly108 high PD-1 low клеток (Рис. 10д, е). Вероятно, что эти клетки были аллореактивными и что образование клеток TCF-1 + не ограничивается теми, которые реагируют на H60.
Ингибитор HIF-1α эхиномицин снижает острую реакцию «трансплантат против хозяина» и сохраняет эффект трансплантата против лейкемии | Journal of Translational Medicine
Мыши
Мыши C57BL / 6J и Balb / c дикого типа (самки в возрасте 6–8 недель) были приобретены у Joint Ventures Sipper BK Experimental Animal Co.(Шанхай, Китай). Мышей содержали в определенных условиях, свободных от патогенов, и все экспериментальные манипуляции проводились в соответствии с Руководством Национального института здравоохранения по уходу и использованию лабораторных животных, а также с одобрения Совета по научным исследованиям Народной больницы Шэньчжэня.
Линия клеток лейкемии
Клетки лейкемии A20 были любезным подарком доктора Кая Сун из Народной больницы провинции Хэнань. Клетки культивировали при 37 ° C в инкубаторе с 5% CO 2 в культуральной среде RPMI 1640 с добавлением 10% фетальной бычьей сыворотки (HyClone Laboratories, Южный Логан, Юта, США), пенициллина и стрептомицина.Для определения апоптоза клеток A20 клетки культивировали в трех экземплярах в 24-луночных планшетах в течение 24 часов в присутствии эхиномицина в указанных концентрациях с последующим окрашиванием по Приложению V и PI. Для анализа образования колоний клетки A20 культивировали в присутствии эхиномицина в указанных концентрациях в течение 24 часов. Затем клетки промывали для удаления эхиномицина и суспендировали в Methocult h5230 (STEMCELL Technologies, Ванкувер, Британская Колумбия, Канада) в концентрации 1 × 10 3 клеток / мл, высевали в 24-луночный планшет в трех повторностях и культивировали в течение 7–14 дней при 37 ° C в инкубаторе с 5% CO 2 .Подсчитывали количество колониеобразующих единиц (КОЕ) на лунку и делали репрезентативные изображения клеточных кластеров под обратным микроскопом DMI6000 (Leica Biosystems, Гейдельберг, Германия).
Получение дендритных клеток, происходящих из костного мозга
Дендритные клетки, полученные из костного мозга мыши (BMDC), получали, как описано ранее [25, 26]. Вкратце, мононуклеарные клетки костного мозга мыши получали из бедренных костей с последующим лизисом эритроцитов. Затем клетки костного мозга культивировали в течение 7 дней в культуральной среде RPMI 1640 с добавлением 10% фетальной бычьей сыворотки (HyClone Laboratories, Южный Логан, Юта, США), пенициллина и стрептомицина в присутствии 10 нг / мл мышиного GM-CSF и 1 нг / мл мышиного IL-4 (оба от Peprotech, Rocky Hill, NJ, USA).На 7 день BMDC стимулировали 100 нг / мл LPS (Sigma-Aldrich, Сент-Луис, Миссури, США) в течение 24 часов для ускорения созревания. Затем зрелые BMDC выделяли и промывали перед сокультивированием с Т-клетками.
Совместное культивирование BMDC с CD4 T-клетками
Набор для выделения CD4-отрицательных Т-клеток мыши (Miltenyi Biotech, Кембридж, Массачусетс, США) использовали для очистки CD4 T-клеток из суспензии одиночных клеток селезенки в соответствии с инструкциями производителя. Чистота очищенных Т-лимфоцитов CD4 обычно составляла от 90 до 95%, как определено анализом проточной цитометрии.После очистки 1 × 10 6 Т-клеток CD4 совместно культивировали с 1 × 10 5 аллогенных BMDC в трех повторностях в 24-луночных планшетах при 37 ° C в инкубаторе с 5% CO 2 в течение до 6 дней. Эхиномицин добавляли в среду один раз в день в конечной концентрации 1 нМ. Среды с добавлением ДМСО в том же объеме, что и в разведении эхиномицина, использовали в качестве контроля среды.
ELISA
В указанные моменты времени культивирования клеток супернатанты собирали и хранили при -20 ° C.Концентрации цитокинов в супернатантах культур определяли с использованием наборов ELISA для мышиных IL-2, IL-10, IL-17A и IFN-γ в соответствии с инструкциями производителя (все от R&D Systems, Миннеаполис, Миннесота, США).
Окрашивание и анализ проточной цитометрии
Если не указано иное, все реагенты для проточной цитометрии были приобретены у BD Biosciences (Сан-Хосе, Калифорния, США). Для внеклеточного окрашивания Т-клеток CD4 использовали антитела против h3Kb-FITC мыши, антитела против CD3-V450 мыши, против CD4-AF700 мыши и антитела против CD25-APC мыши.Использовали внеклеточное окрашивание BMDC, антимышиное MHC-II-AF700 (eBioscience, Сан-Диего, Калифорния, США), антимышиное CD86-APC и антимышиное CD40-FITC. Для внутриклеточного окрашивания Foxp3 использовали антитело против Foxp3-PE мыши после фиксации и пермеабилизации клеток с помощью набора буферов для окрашивания Foxp3 / фактора транскрипции от eBioscience (Сан-Диего, Калифорния, США). Для внутриклеточного окрашивания IL-17 и IFN-γ клетки культивировали в присутствии GolgiPlug (1: 400) в течение 5 часов перед сбором. После фиксации и пермеабилизации клетки окрашивали антителами против мышиного IL-17A-PE или против мышиного IFN-γ PE.Для анализа пролиферации Т-клеток очищенные Т-клетки CD4 окрашивали CFSE (5 мкМ; eBioscience, Сан-Диего, Калифорния, США) и культивировали отдельно или с аллогенными BMDC в течение 5 дней. Для определения апоптоза клеток A20 использовали набор для обнаружения апоптоза аннексина V (eBioscience, Сан-Диего, Калифорния, США). Клетки получали на проточном цитометре LSR II (BD Biosciences, Сан-Хосе, Калифорния, США). Данные были проанализированы с использованием программного обеспечения FlowJo версии 10 (TreeStar, Ashland, OR, США), за исключением анализа пролиферации Т-клеток CFSE, где программное обеспечение FlowJo версии 7.6.1 (TreeStar, Ashland, OR, USA).
Мышиные модели aGVHD и GVL
Для создания мышиной модели aGVHD мышей Balb / c смертельно облучали гамма-лучами 850 сГр. Сразу после облучения мышам вводили 5 × 10 6 клеток костного мозга с добавлением 1 × 10 6 Т-клеток селезенки от мышей C57BL / 6 через хвостовую вену. Для сингенного контроля HSCT вместо этого вводили идентичное количество клеток костного мозга и Т-клеток селезенки от мышей Balb / c. Набор для выделения Т-клеток мыши EasySep (STEMCELL Technologies, Ванкувер, Британская Колумбия, Канада) использовали для очистки Т-клеток селезенки в соответствии с инструкциями производителя.Для создания модели GVL мышей 1 × 10 6 клеток A20 добавляли к трансплантату костного мозга мышей Balb / c (сингенные) или C57BL / 6 (аллогенные), как упомянуто выше, и вводили смертельно облученным мышам Balb / c. Эхиномицин вводили внутрибрюшинно в дозе 5 мкг / кг один раз через день, начиная с 1 дня после ТГСК до смерти или до конца наблюдения. PBS с добавлением ДМСО в том же объеме, что и в разведении эхиномицина, использовали в качестве контроля носителя.После ТГСК мышей ежедневно контролировали по внешнему виду и массе тела. Оценка РТПХ давалась еженедельно на основании потери веса, осанки, активности, текстуры шерсти и целостности кожи, как описано ранее [27]. В экспериментах, показанных на фиг. 5d, мышей Balb / c сублетально облучали γ-лучами 500 сГр и вводили 1 × 10 6 клеток А20 через хвостовую вену для создания модели лейкемии мышей.
Статистический анализ
Двусторонний t-критерий Стьюдента использовался для статистического сравнения между двумя группами.Для сравнения кривых выживаемости использовали ранговый критерий Вилкоксона. Весь статистический анализ проводился с использованием программного обеспечения GraphPad Prism (версия 6.01; GraphPad Software, Ла-Холла, Калифорния, США). Значения P <0,05 считались статистически значимыми.
BJP GVL Narasimha Rao Press Meet LIVE (видео)
Главная »Политика» BJP GVL Narasimha Rao Press Meet LIVE (видео)
Автор: Социальные новости XYZ 21 января 2020 г.
Гунтупалли Венката Лакшми Нарасимха Рао - индийский политический деятель партии Бхаратия Джаната.Он является членом Раджья Сабха, верхней палаты индийского парламента, представляющей штат Уттар-Прадеш.
Смотрите в прямом эфире: https://goo.gl/w3aQde
Лучшие новости сегодня: https://goo.gl/5YuScD
►TV9 LIVE: https://bit.ly/2FJGPps
►Подпишитесь на Tv9 Telugu Live: https://goo.gl/lAjMru
►Подпишитесь на Tv9 Entertainment Live: https://bit.ly/2Rg6nzL
► Большие новости Большие дебаты: https://bit.ly/2sjc9Iu
►Встреча с Мурали Кришной: https: // bit.ly / 380Nvf5
► Загрузите приложение Tv9 для Android: http://goo.gl/T1ZHNJ
► Загрузите приложение Tv9 для iOS: https://goo.gl/abC1bS
► Поставьте нам лайк на Facebook: https://www.facebook.com/tv9telugu
► Следуйте за нами в Instagram: https://www.instagram.com/tv9telugu
► Следуйте за нами в Twitter: https://twitter.com / Tv9Telugu
О SocialNewsXYZ
Индо-американский новостной веб-сайт. Он охватывает сплетни, политику, фильмы, технологии и спортивные новости, а также фотогалереи и прямые трансляции событий через Youtube.Сайт создан в 2015 году и принадлежит AGK FIRE INC.
.Нравится:
Нравится Загрузка …
СвязанныеРезюме
Заголовок
BJP GVL Нарасимха Рао Пресс-встреча в прямом эфире (видео)
Описание
Гунтупалли Венката Лакшми Нарасимха Рао — индийский политический деятель партии Бхаратия Джаната. Он является членом Раджья Сабха, верхней палаты индийского парламента, представляющей штат Уттар-Прадеш.Смотрите в прямом эфире: https://goo.gl/w3aQde Главные новости дня: https://goo.gl/5YuScD ►TV9 в прямом эфире: https://bit.ly/2FJGPps ►Подпишитесь на Tv9 Telugu Live: https://goo.gl/lAjMru ►Подпишитесь на Tv9 Entertainment Live: https://bit.ly/2Rg6nzL ►Big News Big Debate: https://bit.ly/2sjc9Iu ►Встреча с Мурали Кришной: https://bit.ly/380Nvf5 ► Загрузите приложение Tv9 для Android: http://goo.gl/T1ZHNJ ► Загрузите приложение Tv9 для iOS: https://goo.gl/abC1bS ► Поставьте нам лайк на Facebook: https://www.facebook.com/tv9telugu ► Следуйте за нами в Instagram: https: // www.instagram.com/tv9telugu ► Следуйте за нами в Twitter: https://twitter.com/Tv9Telugu
.

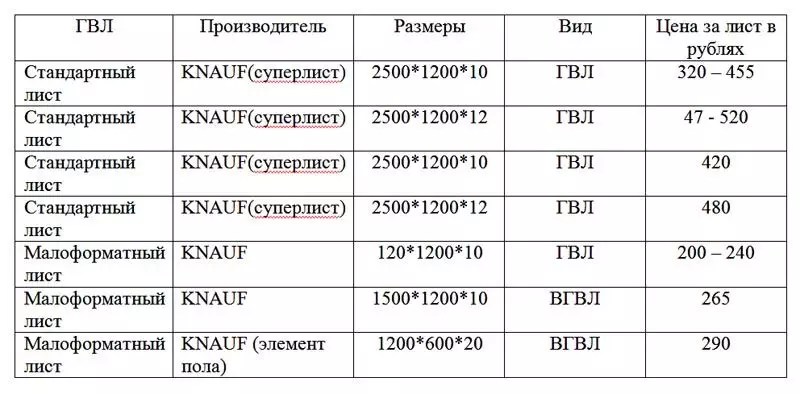
 Их можно отличить по серому цвету и синей маркировке.
Их можно отличить по серому цвету и синей маркировке.

