Замерзание растворов. Растворы замерзают при более низкой температуре чем чистый растворитель
Растворы кипят при более высокой температуре чем чистый растворитель;
Следствия из закона Рауля
Растворы, которые строго подчиняются закону Рауля, являются идеальными. Для реальных растворов неэлектролитов закон Рауля соблюдается тем точнее, чем более разбавленным является этот раствор. По мере повышения концентрации растворенного вещества для большинства растворов наблюдаются отклонения от закона Рауля.
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
Не подчиняются закону Рауля растворы электролитов (кислот, оснований, солей). Причем, даже в тех случаях, когда они являются разбавленными. Причина этого явления будет нами рассмотрена позже.
Из закона Рауля вытекают два важных следствия:
Рассмотрим их более подробно.
Кипение является физическим процессом перехода жидкости в газообразное состояние или пар, при котором пузырьки газа образуются по всему объему жидкости.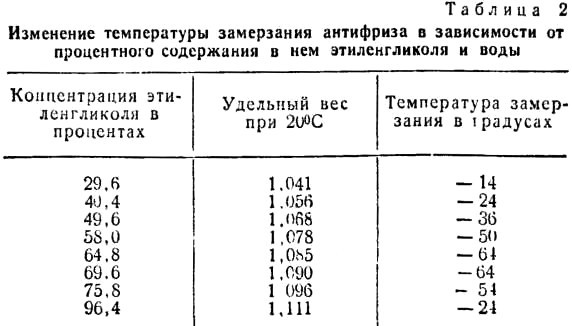
Жидкость закипает, когда давление ее насыщенного пара становится равным внешнему давлению. Если внешнее давление (например, атмосферное) не изменяется, а сама жидкость является индивидуальным и химически чистым веществом, то кипение ее в открытом подогреваемом сосуде происходит при постоянной температуре до тех пор, пока полностью не исчезнет жидкая фаза.
Так при атмосферном давлении равном 101,325 кПа температура кипения очищенной (дистиллированной) воды равна 100 о С или 373,16 K.
Если же в Н 2 О растворить какое-нибудь нелетучее вещество, то давление ее насыщенного пара понизится. Чтобы получившийся раствор закипел, необходимо нагреть его до температуры выше, чем 373,16 K, т.к., только при таких условиях давление насыщенного пара растворителя снова станет равным атмосферному.
Замерзание или кристаллизация представляет собой физическое явление, сопровождающееся превращением жидкости в твердое вещество. Причем кристаллические структуры образуются во всем объеме жидкости.
Процесс замерзания начинается, если давление насыщенного пара над жидкостью становится равным давлению насыщенного пара над ее твердыми кристалликами.
Если внешнее (атмосферное) давление остается постоянным, а жидкость не содержит посторонних примесей, то в процессе кристаллизации температура охлаждаемой жидкости будет оставаться постоянной до тех пор, пока жидкая фаза полностью не превратится в твердую.
При атмосферном давлении равном 101,325 кПа дистиллированная вода замерзает при 0 о С (273,16 K). Давление насыщенного пара воды надо льдом и жидкостью в этом случае равно 613,3 Па.
Для водного раствора давление насыщенного пара растворителя при 0 о С будет меньше чем 613,3 Па, а надо льдом остается неизменным. Опущенный в такой раствор лед будет быстро таять, вследствие конденсации над ним избыточного количества пара.
Лишь при понижении температуры снова можно уравнять давление насыщенного пара над жидкой и твердой фазой и вызвать процесс кристаллизации.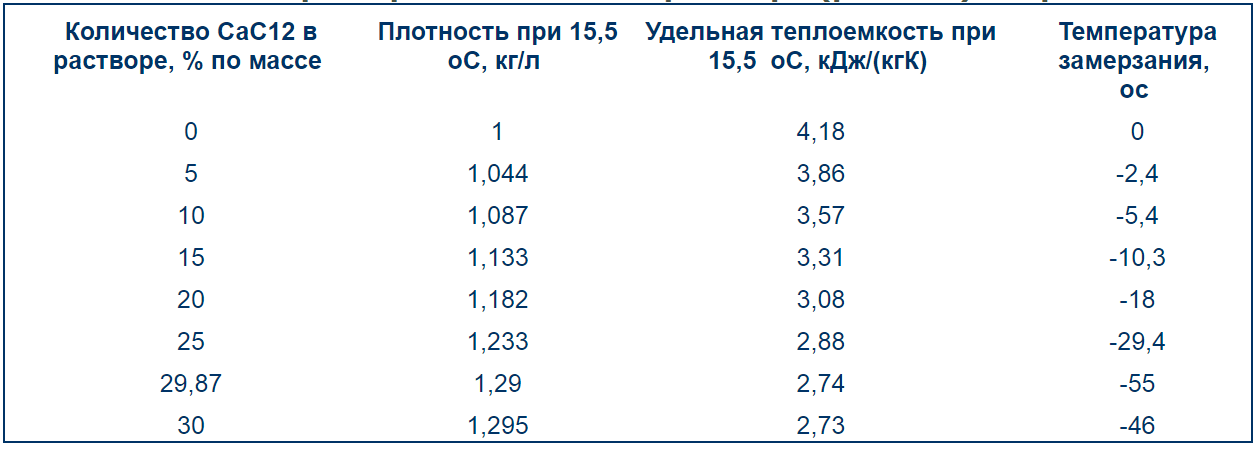
Опытным путем было установлено, что повышение температуры кипения (Dt кип.) и понижение температуры замерзания раствора (Dt зам.) по сравнению с чистым растворителем прямо пропорционально моляльной концентрации растворенного вещества. Математически это можно записать следующим образом:
t кип. р-ра – t кип. р-теля = Dt кип. = Em
t зам. р-теля – t зам. р-ра = Dt зам. = Km
где m – моляльная концентрация растворенного вещества; E и K – соответственно, эбуллиоскопическая (лат. ebbulio – выкипаю) и криоскопическая (греч. «криос» — холод) константы, значения которых зависят только от природы растворителя (табл. 7).
Таблица 7. Эбуллиоскопические E и криоскопические K константы некоторых растворителей (град/моль)
Рис. 7.12. Понижение давления пара воды над раствором
Сплошные линии выражают границы фазовых полей для чистой воды. Напомним, что линия 1 отображает равновесие “жидкость — пар”. После добавления к воде нелетучего растворённого вещества давление пара над раствором (пунктирная линия 2 ) понижается при любой температуре.
Любая жидкость будет замерзать (отвердевать) тогда, когда давление пара над ней сравнивается с давлением пара над твёрдой фазой (в случае воды — надо льдом). Поэтому и температура замерзания раствора Т зам будет меньше, чем температура замерзания Т о зам чистого растворителя — воды.
Ф.М.Рауль (1883) опытным путём установил, что понижение температуры замерзания (иначе —
DT зам = Т о зам — Т зам ,
вызываемое разными растворёнными веществами, взятыми в одинаковых молярных количествах, одинаково для данного растворителя. Так, для 0,1m водных растворов некоторых веществ наблюдаются следующие температуры затвердевания:
Вещество T зам , o C
Пероксид водорода H 2 O 2 — 0,186
Метиловый спирт CH 3 OH — 0,181
Этиловый спирт C 2 H 5 OH — 0,183
Сахароза C 12 H 22 O 11 — 0,186
Декстроза C 6 H 12 O 6 — 0,188
При различных концентрациях растворённых веществ DT зам пропорционально их моляльной концентрации m :
DT зам = К кр m (7. 1)
1)
Коэффициент пропорциональности К кр в уравнении (7.1), называемый криоскопической константой , представляет собой молярное понижение температуры замерзания. Эта величина численно равна понижению температуры замерзания раствора, содержащего 1 моль растворённого вещества в 1 килограмме растворителя при условии, что раствор обладает свойствами идеального. Криоскопическая константа является характеристикой растворителя, её величина не зависит от природы растворённого вещества.
Моляльная концентрацияможет быть выражена через массы растворённого вещества (b) и растворителя (а) в граммах (см. п. 7.3):
где М — молярная масса растворённого вещества (г/моль). Подставляя это выражение в уравнение (7.1), получим
Из этого уравнения следует одно очень важное обстоятельство, а именно: зная точный состав разбавленного раствора и измеряя температуры замерзания чистого растворителя и раствора, можно рассчитать молярную массу растворённого вещества:
Уравнение (7.
Принцип его заключается в следующем. Вначале измеряется температура плавления (или замерзания) точной навески а выбранного растворителя. Затем к растворителю добавляется точная навеска исследуемого вещества b и измеряется температура плавления полученной смеси (или температура замерзания, если вещество, выбранное в качестве растворителя, имеет низкую температуру плавления). Навеска растворённого вещества должна быть намного меньше, чем навеска растворителя, чтобы раствор получился разбавленным. Полученное значение DT зам подставляется в уравнение (7.2) и с его помощью вычисляется молярная масса исследуемого вещества. В простейшем случае в качестве растворителя может быть взята дистиллированная вода.
Вещество Т пл о С Криоскопическая
константа
Бензол 5,5 5,12
Уксусная кислота 16,8 3,90
Циклогексан 6,5 20
Камфора 178,5 39,7
Криоскопический метод используется и для определения чистоты веществ. Это основано на том, что присутствие даже небольшой примеси снижает температуру плавления образца исследуемого вещества. Поэтому в химии (а также и в фармации) одним из критериев чистоты вещества является достижение максимальной температуры плавления, не возрастающей более после дополнительных операций очистки.
Поэтому в химии (а также и в фармации) одним из критериев чистоты вещества является достижение максимальной температуры плавления, не возрастающей более после дополнительных операций очистки.
Ещё одно важное применение криоскопического эффекта — приготовление охлаждающих смесей. При определённом соотношении воды (или снега) и некоторых неорганических солей можно получить низкие температуры, удерживающиеся в течение достаточно длительного времени. Например, смесь, состоящая из 100 г снега и 143 г CaCl 2 ·6Н 2 О, позволяет получить температуру -55 о С.
В районах с холодным климатом в воду, используемую в автомобильных радиаторах, для предотвращения её замерзания зимой добавляются антифризы — такие вещества как спирт, глицерин или этиленгликоль. Лёд, намёрзший на проезжей части дорог и на тротуарах, легко плавится, когда его посыпают поваренной солью или золой, что тоже основано на криоскопическом эффекте. Следует только помнить, что неумеренное применение в этих целях соли может вызвать засоление близлежащих водоёмов и почв на их берегах и, как следствие, экологические нарушения.
Замерзание представляет собой фазовый переход, при котором происходит превращение жидкости в твердое вещество. Температурой замерзания 9кристаллизации) жидкости называют ту температуру, при которой давление насыщенного пара над жидкостью равно давлению насыщенного пара над выпадающими из нее кристаллами твердой фазы.
При этой температуре и соответствующем ей давлении насыщенного пара скорость кристаллизации равна скорости плавления и обе эти фазы могут сосуществовать в течение длительного времени.
Еще М.В. Ломоносов заметил, что разбавленный раствор замерзает при температуре более низкой, чем чистый растворитель. Так, морская вода замерзает не при 273 К, а при несколько более низкой температуре. Многочисленные эксперименты показали, что такое изменение температуры замерзания раствора можно рассматривать как общее правило.
Процессы замерзания и кипения были детально изучены Раулем и представлены в виде закона, который в последствии был назван вторым законом Рауля.
рассмотрим простейший вывод этого закона. На рис.2 показана диаграмма, выражающая зависимость давления насыщенног пара от температуры над чистым растворителем и над раствором.
Кривая 0А – зависимость давления насыщенного пара чистой воды от температуры.
Кривая ВС, ДЕ – зависимость давления насыщенного пара воды над растворами с различными концентрациями растворенного вещества
0Д – выражает температурную зависимость давления насыщенного пара воды над льдом.
Из рис.2 видно, что давление пара над раствором при 273 К ниже, чем над водой, но оно не равно давлению пара над льдом при той же температуре. Лишь при температуре ниже 273 К (Т’з) давление пара над раствором уменьшается настолько, что становится равным давлению пара над льдом. Этому соответствует точка В. При более высоких концентрациях раствора кривые, выражающие зависимость давления пара воды над раствором от температуры, располагаются ниже кривой ВС, но параллельно ей.
Введем следующий обозначения:
Р 0 А – давление пара над чистым растворителем при 273 К
Р А – давление пара над раствором при температуре его замерзания Т’ з
Из прямоугольного треугольника ВОК определяем
Из рисунка 2 видно, что , где — понижение температуры замерзания раствора.
Подставляя эти значения в выше записанное уравнение, получим
(3)
Из первого закона Рауля для сильно разбавленных растворов имеем
и (4)
где n А, n В, m А сохраняют ранее присвоенные обозначения (см. выше). Если через М 0 А обозначить молярную массу растворителя, то
При подстановке этого выражения в уравнение (4) получим
Умножим и разделим правую часть этого выражения на 1000, тогда
(5)
Объединим все постоянные величины в уравнении (5) в одну постоянную К (), получим следующее выражение
(6)
Выражение представляет собой моляльность раствора Св.
Подставив это выражение в уравнение (6), получим окончательное уравнение.
(7)
Это и есть математическое выражение второго закона Рауля: понижение температуры замерзания или повышение температуры кипения растворов прямо пропорционально его моляльной концентрации.
Коэффициент К в уравнении (7) носит название криоскопической постоянной, показывает молярное понижение температуры замерзания раствора, является индивидуальной характеристикой растворителя (К Н2О =1,86º) и имеет ту же размерность, что и Е (Кº·кг·моль -1)
Метод исследования, основанный на измерении понижения температуры замерзания растворов, называется криоскопическим.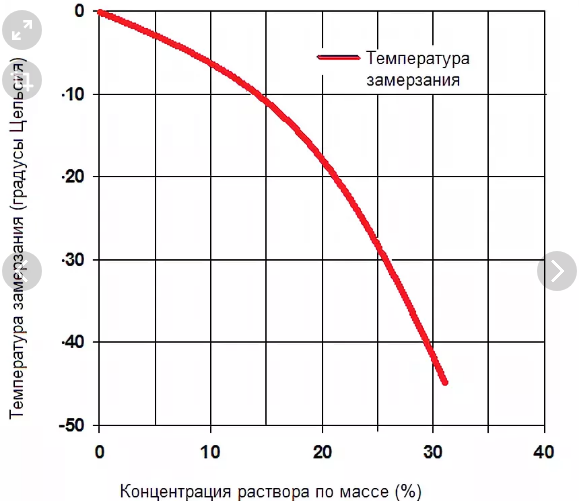 Он также, как и эбуллиоскопический позволяет вычислить молярную массу растворенного вещества
Он также, как и эбуллиоскопический позволяет вычислить молярную массу растворенного вещества
На рис.3 изображен прибор, предназначенный для измерения температуры замерзания растворов.
ОСМОС И ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ .
Весьма важным в биологическом отношении свойством растворов является осмос.
В природе часто растворы отделяются от растворителя мембранами, проницаемыми лишь дл я частиц растворителя. В этом случае растворенное вещество диффундировать в растворитель не может, и будет наблюдаться только переход растворителя в в раствор, т.е. растворитель будет перемещаться в обоих направлениях, но все же в раствор его будет переходить немного больше, чем в обратном направлении.
Механизм осмоса легко представить на основе изотермической перегонки. Пусть полупроницаемая мембрана, имеющая микропоры, разделяет растворитель и раствор с концентрацией С в (рис.4)
В пору, ограниченную с одной стороны растворителем, а с другой раствором, идет испарение. Вследствие повышения по закону Рауля упругости насыщенного пара со стороны растворителя из парообразной фазы концентрируется, переходя в раствор.
Вследствие повышения по закону Рауля упругости насыщенного пара со стороны растворителя из парообразной фазы концентрируется, переходя в раствор.
В результате осмоса увеличивается объем раствора, и его концентрация постепенно снижается; проникающий через мембрану в раствор растворитель увеличивает столб жидкости h и, следовательно, повышает гидростатическое давление (см. рис.5). Одновременно будет возрастать число молекул растворителя, перемещающихся через мембрану в обратном направлении, т.е. из раствора в растворитель. постепенно гидростатическое давление и разбавление раствора достигнут величин, при которых количество молекул растворителя, перемещающихся в обоих направлениях, уравняется и наступит осмотическое равновесие. Развившееся в результате осмоса избыточное гидростатичекое давление, измеряемое столбом раствора высотой h, при котором устанавливается осмотическое равновесие, называют осмотическим давлением.
рис. 5
Полупроницаемыми для многих растворов являются мембраны из коллодия, целлофана, железистосинеродистой меди и др.
ЗАКОНЫ ОСМОТИЧЕСКОГО ДАВЛЕНИЯ .
Изучение законов осмотического давления выявило их полную аналогию с газовыми законами. Для разбавленных растворов неэлектролитов их можно сформулировать так:
при постоянной температуре осмотическое давление прямо пропорционально молярной концентрации растворенного вещества (аналогия с законом Бойля-Мариотта):
при постоянной молярной концентрации осмотическое давление прямо пропорционально абсолютной температуре (аналогия с законом Гей-Люссака):
Из двух этих законов следует, что при одинаковых молярных концентрациях и температуре растворы разных неэлектролитов создают одинаковое осмотическое давление, т.е. эквимолярные растворы неэлектролитов изотоничны (аналогия с законом Авогадро).
Вант-Гоффом был предложен объединенный закон для осмотического давления в растворах (аналогично объединенного газовому закону Менделеева-Клайперона): Осмотическое давление разбавленных растворов неэлектролитов прямо пропорционально молярной концентрации, коэффициенту пропорциональности и абсолютной температуре:
так как с=n/V, где n – число молей неэлектролита, а V – объем раствора, то или
Разбавленные растворы неэлектролитов.
Коллигативные свойства расвторов
Давление насыщенного пара
Равновесие “индивидуальная жидкость-пар” описывается константой равновесия
K p =p о нас. пара /a о ж (1)
Отсюда, поскольку активность индивидуальной жидкости а о ж =1, то давление насыщенного пара равно
p о пара = K p (2)
и зависит только от температуры.
Поскольку активность растворителя равна произведению a о ж на его молярную долю N 1 или же на (1 — N 2), где N 2 – молярная доля растворённого вещества, то константа равновесия равна:
K p =p 1 о =(p 1 /a о ж N 1)=(p 1 /1-N 2) (3)
Отсюда получаем закон Рауля (1886):
p 1 =p 1 о (1-N 2)=p 1 о N 1 (4)
(p 1 о -p 1)/p 1 о)=N 2 (5)
Давление насыщенного пара раствора равно его давлению над чистым растворителем, умноженному на мольную долю растворителя.
Относительное понижение давления насыщенного пара растворителя над чистым раствором равно мольной доле растворённого вещества.
Таким образом, давление пара уже зависит от содержания растворенного вещества. Закон Рауля можно использовать для определения молярной массы растворённого вещества:
Dp/p 1 ° =N 2 =n 2 /n 1 +n 2 ≈m 2 M 1 /m 1 M 2 (6)
Температура кипения растворов
Жидкость кипит, когда давление насыщенного пара становится равным внешнему давлению. Так как, по закону Рауля, давление пара над раствором меньше давления пара над чистым растворителем, то температура кипения раствора выше температуры кипения чистого растворителя.
Эксперименты показали, что для разбавленных растворов неэлектролитов:
где DТ — повышение температуры кипения раствора по сравнению с чистым растворителем, b — моляльность ([E]=К. Кг/моль) E- эбулиоскопическая постоянная (от ebbulio (лат.)- выкипать), зависящая только от свойств растворителя (его температуры кипения T о и удельная теплота испарения L 1):
E=RT о 2 /1000L 1 (8)
Температура кипения чистого растворителя имеет определённое значение при фиксированном внешнем давлении.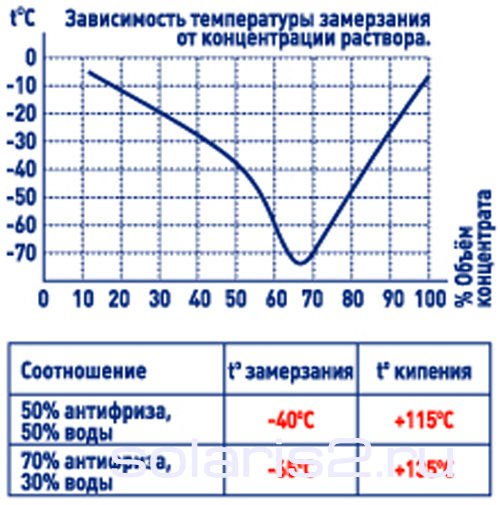 Температура кипения раствора не постоянна — она растёт по мере кипения, так как за счёт испарения растворителя концентрация раствора увеличивается. При этом давление насыщенного пара всё время уменьшается. Поэтому температурой кипения раствора принято считать температуру, отвечающую появлению в нём первого пузырька пара.
Температура кипения раствора не постоянна — она растёт по мере кипения, так как за счёт испарения растворителя концентрация раствора увеличивается. При этом давление насыщенного пара всё время уменьшается. Поэтому температурой кипения раствора принято считать температуру, отвечающую появлению в нём первого пузырька пара.
Температура замерзания растворов
Над раствором давление пара растворителя ниже, чем давление пара над чистым растворителем. Давление пара над твёрдой и жидкой фазами тоже будет меньше. Это может быть только при более низкой температуре замерзания раствора по сравнению с чистым растворителем. Понижение температуры замерзания растворов неэлектролитов по отношению к температуре замерзания чистого растворителя пропорционально моляльности раствора:
где К- криоскопическая постоянная (от греч. “криос”- холод), зависящая только от свойств растворителя:
К=RT о 2 /1000L 1 , (10)
где T о, L * 1 — температура замерзания и удельная теплота плавления чистого растворителя.
Поскольку с затвердеванием растворителя возрастает концентрация растворённого вещества, то температура замерзания раствора непостоянна и уменьшается в ходе процесса. Поэтому за температуру замерзания раствора принимают температуру образования первого кристаллика.
В таблице 2 приведены значения Е и К для некоторых растворителей.
Таблица 2.
Кристаллы растворителя будут находиться в равновесии с раствором только тогда, когда давление насыщенного пара над кристаллами и над раствором одинаково. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, температура, отвечающая этому условию, всегда будет более низкой, чем температура замерзания чистого растворителя. При этом понижение температуры замерзания раствора ΔT зам не зависит от природы растворенного вещества и определяется лишь соотношением числа частиц растворителя и растворенного вещества.
Можно показать, что понижение температуры замерзания раствора ΔT зам прямо пропорционально моляльной концентрации раствора:
Второй закон Рауля : Повышение Ткип и понижение Тзам р-ра пропорциональны числу частиц растворенного вещества и не зависят от его природы.
Конец работы —
Эта тема принадлежит разделу:
Лекция № 5. Фазовые равновесия. Растворы неэлектролитов
Газообразное состояние вещества характеризуется слабым взаимодействием между частицами и большими расстояниями между ними Поэтому газы смешиваются… Общее давление газовой смеси равно сумме парциальных давлений всех входящих в…
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
Все темы данного раздела:
Лекция № 5. Фазовые равновесия. Растворы неэлектролитов.
Фазовые равновесия.
На прошлой лекции мы рассмотрели химическое равновесие, константу равновесия, ее связь с т.д. величинами и факторы, влияющие на сдвиг равновесия.
Двухкомпонентные системы.
Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения её свойс
Образование раствора
Образование раствора является сложным физико-химическим процессом.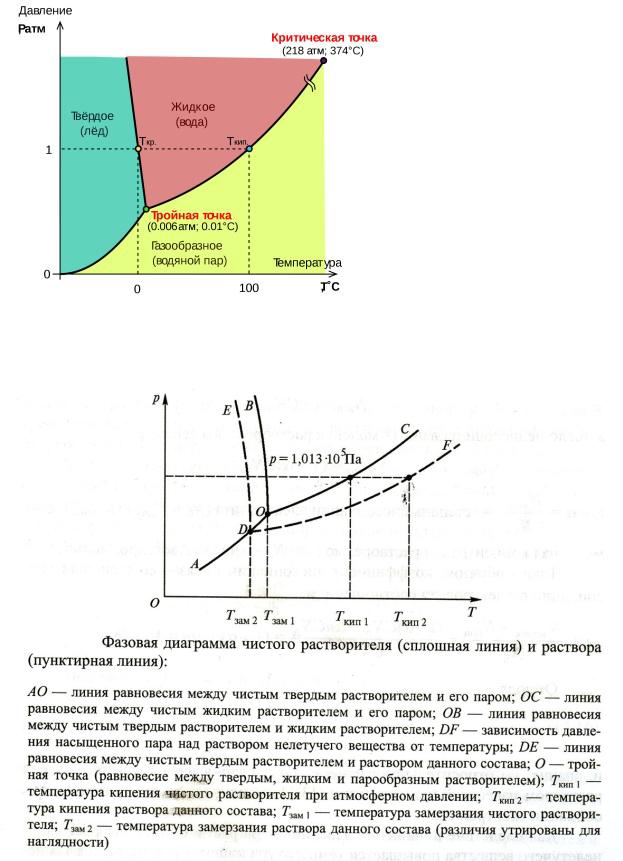 Процесс растворения всегда сопровождается увеличением энтропии системы; при образовании растворов часто имеет место выделение либо
Процесс растворения всегда сопровождается увеличением энтропии системы; при образовании растворов часто имеет место выделение либо
Растворимость
Процесс растворения связан с диффузией, т. е. с самопроизвольным распределением частиц одного вещества между частицами другого. При внесении растворяемого вещества в растворитель процесс растворени
Растворимость газов в жидкостях
Растворимость газов в жидкостях зависит от ряда факторов: природы газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ (особенно сильно влияет на растворимость газов
Растворы неэлектролитов.
Свойства растворов рассматривают на примере разбавленных растворов, при образовании которых тепловой и объемный эффекты равны 0 (идеальные растворы). В таких растворах частица находятся на большом
Относительное понижение давления насыщенного пара над раствором равно мольной доле растворенного вещества.
Любая жидкость начинает кипеть при температуре, при которой давление ее насыщенного пара достигает величины внешнего давления. Т кип – Т, при которой давление пара= 101,3 кПа.Вода кипит при 100 С,
Т кип – Т, при которой давление пара= 101,3 кПа.Вода кипит при 100 С,
Осмотическое давление
Если разделить два раствора с различной концентрацией полупроницаемой перегородкой, пропускающей молекулы растворителя, но препятствующей переходу частиц растворённого вещества, будет наблюдаться я
Температура замерзания раствора — Справочник химика 21
Жидкие растворы по своей природе, свойствам, характеру взаимодействий между частицами очень разнообразны, в связи с чем трудно создать единую количественную теорию, описывающую поведение различных растворов в широкой области концентраций. Наука о растворах —одна из наиболее старых областей естествознания, в развитие которой сделан вклад многими исследователями. В ходе развития учения о растворах были высказаны две точки зрения на природу растворов —физическая и химическая. Физическая теория растворов, возникшая главным образом на основе трудов Вант-Гоффа, Аррениуса и Оствальда, опиралась на экспериментальное изучение коллигативных свойств разбавленных растворов (осмотическое давление, новышение температуры кипения, понижение температуры замерзания раствора и т.
 п.), зависящих главным образом от концентрации растворенного вещества, а не от его природы. Количественные законы (законы Вант-Гоффа, Рауля) были открыты в предположении, что в разбавленных растворах молекулы растворенного вещества подобны молекулам идеального газа. Отступления от этих законов, наблюдаемые для растворов электролитов, были объяснены на основе теории электролитической диссоциации Аррениуса. Простота представлений физической теории и успешное применение ее как для объяснения свойств растворов электролитов, так и для количественного изучения электрической проводимости растворов обеспечили быстрый успех этой теории. Химическая теория растворов, созданная преимущественно Менделеевым и его последователями, рассматривала процесс образования раствора как разновидность химического процесса, характеризующегося взаимодействием частиц смешивающихся компонентов. Менделеев рассматривал растворы как системы, образованные частицами растворителя, растворенного вещества и неустойчивых химических соединений, которые образуются между ними и находятся в состоянии частичной диссоциации.
п.), зависящих главным образом от концентрации растворенного вещества, а не от его природы. Количественные законы (законы Вант-Гоффа, Рауля) были открыты в предположении, что в разбавленных растворах молекулы растворенного вещества подобны молекулам идеального газа. Отступления от этих законов, наблюдаемые для растворов электролитов, были объяснены на основе теории электролитической диссоциации Аррениуса. Простота представлений физической теории и успешное применение ее как для объяснения свойств растворов электролитов, так и для количественного изучения электрической проводимости растворов обеспечили быстрый успех этой теории. Химическая теория растворов, созданная преимущественно Менделеевым и его последователями, рассматривала процесс образования раствора как разновидность химического процесса, характеризующегося взаимодействием частиц смешивающихся компонентов. Менделеев рассматривал растворы как системы, образованные частицами растворителя, растворенного вещества и неустойчивых химических соединений, которые образуются между ними и находятся в состоянии частичной диссоциации. В классических трудах Менделеева четко сформулированы основные положения теории растворов. Менделеев указывал на необходимость использования всей суммы химических и физических сведений о свойствах частиц, [c.344]
В классических трудах Менделеева четко сформулированы основные положения теории растворов. Менделеев указывал на необходимость использования всей суммы химических и физических сведений о свойствах частиц, [c.344]Жидкость затвердевает, когда давление ее пара становится равным давлению пара соответствующей твердой фазы. На рис. 78 видно, ч то давление пара льда достигается у раствора при более низкой температуре 4, чем чистой воды Понижение температуры замерзания растворов было впервые установлено М. В. Ломоносовым (17481. [c.131]
Обозначим через Р осмотическое давление раствора, через А/кип—повышение температуры кипения, А/зам — понижение температуры замерзания раствора, не подчиняющегося законам Вант-Гоффа и Рауля, а через Р, А/кип и А/зам — значения тех же величии, вычисленные теоретически по концентрации раствора. Поскольку и осмотическое давление, и изменения температур замерзания и кипения пропорциональны числу находящихся в растворе частиц растворенного вещества, то коэффициент i можно выразить отношениями [c. 231]
231]
Понижение температуры замерзания раствора [c.142]
В ходе этих исследований Рауль измерял температуры замерзания растворов. Как выяснилось, температура замерзания раствора всегда была ниже температуры замерзания чистого растворителя. Раулю удалось показать, что понижение температуры замерзания пропорционально числу частиц растворенного в ества, присутствующих в растворе. [c.119]
Какова температура замерзания раствора глюкозы, описанного в примере 4 [c.143]
Тироксин (гормон, регулирующий скорость метаболизма в организме человека) может быть вьщелен из щитовидной железы. При растворении 0,455 г тироксина в 10,0 г бензола температура замерзания раствора становится равной 5,144°С чистый бензол замерзает при 5,444°С. Какова молекулярная масса тироксина [c.154]
Чем объясняется повышение температуры кипения раствора при введении в него небольшого количества нелетучего растворенного вещества Чем объяснить происходящее при этом понижение температуры замерзания раствора [c. 151]
151]
Температура замерзания чистой уксусной кислоты равна 16,60°С, а температура замерзания раствора, полученного растворением 0,400 г неизвестного углеводорода в 25,0 г уксусной кислоты, понижается до 16,15°С. Моляльная константа понижения температуры замерзания для уксусной кислоты равна 3,60 град моль» . Какова молекулярная масса исследуемого углеводорода Химический анализ показал, что оно содержит 93,76 вес.% углерода и 6,25 вес.% водорода. Какова его молекулярная формула [c.154]
На основании данных о понижении температуры замерзания раствора или повыщения температуры кипения нельзя установить молекулярную массу макромолекул, но для определения ее может использоваться четвертое и последнее коллигативное свойство растворов, осмотическое давление. [c.145]
Температура замерзания раствора, содержащего 2,6152 10 кг эфира этиленгликоля в 0,1 кг воды, ниже температуры замерзания воды на 0,5535°. Определите молекулярную массу эфира, если теплота плавления воды 6029 Дж/моль. [c.194]
[c.194]
Расчет активности растворителя по понижению температуры замерзания раствора [c.240]
Разность между температурами кипения раствора и чистого растворителя называют повышением температуры кипения раствора (А/кнп). Разность между температурами замерзания чистого растворителя и раствора называют пони ж е п п е м температуры замерзания раствора (А/зам). Обозначая температуры кипения и замерзания раствора /кип и / м> а те [c.228]
Понижение температуры замерзания раствора можно объяснить подобно тому, как мы объясняли повышение температуры кипения. На рис. [c.142]
Указать правильное соотношение между температурами замерзания растворов цианида аммония Nh5 N (ii) и уксусного альдегида СН3СНО (/о), каждый из которых содержит 5 г растворенного вещества в 100 г воды а) f] = б) ii > 2 в) t] [c.132]
Соединение, имеющее молекулярную массу 329,3, растворено в воде раствор содержит 300 мг (300 1 0 г) соединения в 10 см воды.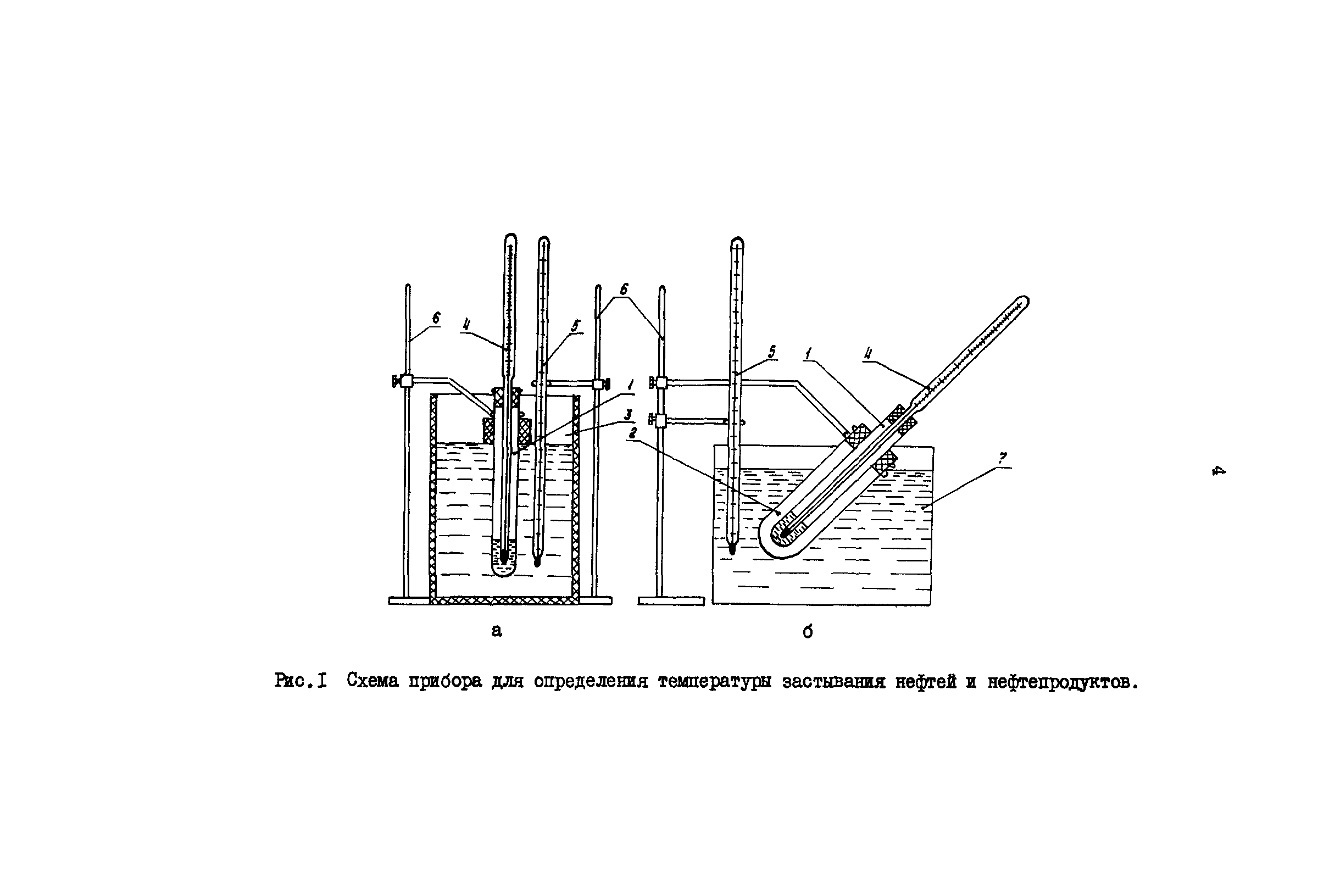 Какова температура замерзания раствора [c.144]
Какова температура замерзания раствора [c.144]
Жидкость начинает затвердевать (рис. 118), когда давление пара над твердым растворителем и жидкостью будет одинаковым — температура замерзания чистого растворителя). Давление пара над раствором в соответствии с законом Рауля будет меньше, чем над чистым растворителем, и температура замерзания раствора сместится в область более низких температур (П — температура замерзания раствора). Разность Т —Тг= называется понижением тем- [c.357]
Опыт показывает, что разбавленный раствор замерзает при температуре более низкой, чем чистый растворитель. Так, морская вода замерзает не при 0°С, а при несколько более низкой температуре. Такое изменение температуры замерзания раствора можно рассматривать как общее правило (отклонения из него мы рассмотрим позднее). Введем для характеристики температур замерзания растворов величину понижения температуры замерзания АГд, определяя ее как разность между температурами замерзания чистого растворителя Та и раствора Т . [c.301]
[c.301]
В табл. 53 приведены данные по температурам замерзания растворов соляной кислоты и хлоридов элементов главной подгруппы I группы. Поставьте как можно больше вопросов к этим данным. Обработайте необходимым образом данные. Сделайте, максимальное число выводов. [c.151]
По понижению температуры замерзания раствора можно определить молекулярную массу вещества [c.184]
Что вы можете сказать, изучив данные по температурам замерзания растворов (табл. 58). [c.156]
Не рассматривая здесь систем, в которых происходит образование твердых растворов, можно сказать, что температурой начала кристаллизации раствора называется температура, при которой кристаллы растворителя находятся в равновесии с раствором данного состава. Температуру начала кристаллизации называют также температурой замерзания раствора, обычно в тех случаях, когда эта температура не выше комнатной. [c.301]
Эти соотношения дают возможность определять степень диссоциации путем измерения различных свойств раствора. Значения коэффициента 1 (или степени диссоциации а), получаемые в результате измерения осмотического давления, измерения температур замерзания растворов, а также путем измерений электропроводности для слабых электролитов, находятся в хорошем согласии между собой. [c.391]
Значения коэффициента 1 (или степени диссоциации а), получаемые в результате измерения осмотического давления, измерения температур замерзания растворов, а также путем измерений электропроводности для слабых электролитов, находятся в хорошем согласии между собой. [c.391]
Вывод выражения, описывающего понижение температуры замерзания раствора, аналогичен выводу выражения для повьпнения температуры кипения. В новом положении равновесия влияние разбавления и понижения температуры на способность молекул растворителя переходить в другую фазу должно в точности уравниваться. Результирующее выражение имеет такой же вид, как приведенное выше для повышения температуры кипения раствора [c.143]
Распад электролитов на ионы объясняет отклонения от законов Вант-Гоффа и Рауля, о которых говорилось в начале этой главы, В качестве примера мы приводили понижение температуры замерзания раствора Na l. Теперь нетрудно понять, почему понижение температуры замерзания этого раствора столь велико. Хлорид натрия переходит в раствор в виде ионов Na+ и С1 . При этом из одного моля Na l получается не 6,02-10 частиц, а вдвое большее их число. Поэтому и понижение температуры замерзания в растворе Na l должно быть вдвое больше, чем в растворе неэлектролита той же концентрации. [c.234]
Хлорид натрия переходит в раствор в виде ионов Na+ и С1 . При этом из одного моля Na l получается не 6,02-10 частиц, а вдвое большее их число. Поэтому и понижение температуры замерзания в растворе Na l должно быть вдвое больше, чем в растворе неэлектролита той же концентрации. [c.234]
Расчет активности растворенного вещества по изменению температуры замерзания раствора [c.241]
Повышение температуры кппенпя и поиажонне температуры замерзания растворов соответствуют принципу Ле Шателье. Рассмотрим в этом плане замерзание раствора. Пусть имеется равновесие между жидкостью и твердой фазой, например, )авиовесие вода — лед при О С. Его можно выразить уравнением [c.229]
Различные методы определения активности и коэффициентов активности основаны на применении термодинамических уравнений к опытным данным (давление пара, понижение температуры замерзания растворов и т. п.). [c.369]
Вычислите температуру замерзания раствора, содержащего 7,30Я 10″ кг хлорида натрия в 0,250 кг воды, если при 291 К осмош-ческое давление этого раствора 2,1077 10 Па, плотность 1. 10 кг/м , / л = 333,48 10 Дж/кг. [c.194]
10 кг/м , / л = 333,48 10 Дж/кг. [c.194]
По уравнению (133.1) и экспериментальным данным о понижении температуры замерзания раствора рассчитывается активность растворителя. Аналогично может быть рассчитана активность растворителя из данных по повышению температуры кипения растворов. [c.369]
Вычислите температуру замерзания раствора, полученного растворением 1,00 г Na I в 10,0 г воды. Повторите вычисления для раствора, полученного растворением 1,00 г a lj в таком же количестве воды. Какая из этих солей представляет собой лучший антифриз, если судить по их молекулярным массам [c.154]
В дайной работе следует определить молекулярный вес растворенного вещества по температурам замерзания раствора и рас 1вор1пеля. [c.187]
Последовательность выполнения работы. 1. Налить в стакан 20 Л1 воды и взвесить его на технических весах. Взвешивание произвести пять раз. 2. Вылить воду в сосуд для определения температуры замерзания и вновь взвесить пустой стакан пять раз. 3. Определить по термометру Бекмана температуру замерзания растворителя. Определение произвести пять раз. 4. Взвесить бюкс на технических весах, добавить в него примерно 0,2 г карбамида. Взвесить бюкс с карбамидом на аналитических весах. Взвенпшание произвести пять раз. 5. Внести карбамид в сосуд для определения температуры замерзания, 6 Взвесить пустой бюкс па аналитических весах пять раз, 7, Определить температуру замерзания раствора пять раз, 8, Рассчитать относительные ошибки веса карбамида, воды и ДГ замерзания раствора. 9. Рассчитать относительную и абсолютную ошибки при определении молекулярного веса карбамида. [c.461]
3. Определить по термометру Бекмана температуру замерзания растворителя. Определение произвести пять раз. 4. Взвесить бюкс на технических весах, добавить в него примерно 0,2 г карбамида. Взвесить бюкс с карбамидом на аналитических весах. Взвенпшание произвести пять раз. 5. Внести карбамид в сосуд для определения температуры замерзания, 6 Взвесить пустой бюкс па аналитических весах пять раз, 7, Определить температуру замерзания раствора пять раз, 8, Рассчитать относительные ошибки веса карбамида, воды и ДГ замерзания раствора. 9. Рассчитать относительную и абсолютную ошибки при определении молекулярного веса карбамида. [c.461]
Часто при помощи простых физических измерений можно получить грубую оценку молекулярной массы вещества. Это удается сделагь по плотности газа (гл. 3), по понижению температуры замерзания раствора или путем измерения его осмотического давления (гл. 18). При наличии такой приближенной оценки молекулярной массы ею можно воспользоваться, чтобы на основании имеющейся эмпирической формулы решить вопрос [c. 68]
68]
Соотношение, ог ределяющее понижение температуры замерзания раствора, дает -0,189 = — 1,8бшд, откуда тд = 0,102 моль-кг [c.144]
В эксперименте, описанном в примере 8, истинная, наблюдаемая температура замерзания раствора оказа. лсь равной — 0,676°С, а не — 0,169°С, как ожидалось. О каком явлении, происходящем при растворении соединения, свидетельствует згот факт [Соединение представляет собой феррицианид калия, KзFe( N),.] [c.144]
Понижение температуры замерзания раствора оказалось вчетверо больше ожидаемого это указывает, что 1 моль соединения дает в растворе 4 моля частиц. Следовательно, феррициан1щ калия растворяется с образованием четырех ионов [c.144]
Сколько граммов метанола, СН3ОН, следует добавить к 10,0 кг воды, чтобы понизить температуру замерзания раствора до 263 К Какова нормальная температура кипения этого раствора [c.154]
Вычислите молекулярную массу вещества, если температура замерзания раствора, содержащего 100 г бензола и 0,2 г исследуемого вещес»ва, на 0,17 К ниже температуры замерзания бензола. Криоскопическая константа К р = 5,16 град/моль. [c.188]
Криоскопическая константа К р = 5,16 град/моль. [c.188]
И. Определите процентный состав и молекулярную массу углево-дороца на основании следующих данных из 0,2 — 10″ кг вещества образуется 0,687 10 кг СОг и 0,1125 10 кг НаО температура замерзания раствора, содержащего 0,0925 10 кг вещества в 0,01 кг бензола, ниже температуры замерзания бензола на 0,354 . Крирскопичес-кая постоянная К для бензола 5,16°. [c.194]
Второй закон Рауля и температура замерзания
Некоторые автолюбители, насколько мне известно, предпочитают зимой заливать в бачок стеклоочистителя водку. Водка зимой не замерзает, а почему и вплоть до какой температуры? Ответ на этот вопрос даст нам химия.
Начнем с определений.
Как известно, водка — это раствор этилового спирта в воде.
А что такое раствор? Это однородная смесь не менее двух компонентов, один из которых называется растворителем, а другой растворимым веществом. Растворитель, это компонент, агрегатное состояние которого не изменилось при образовании раствора (например, сахар в воде переходит из твердой фазы в жидкую, вода — растворитель) либо, в случае веществ, находящихся в одной и той же фазе, компонент, которого больше. Растворы бывают твердые, жидкие и газообразные (воздух, как смесь газов — газообразный раствор).
Растворы бывают твердые, жидкие и газообразные (воздух, как смесь газов — газообразный раствор).
С химической точки зрения, раствор — это дисперсная система, т.е., система, в которой два или несколько веществ находятся в раздробленном состоянии, и частицы их равномерно распределены относительно друг друга и взаимодействуют между собой.
Разница здесь есть в степени дисперсности.
Если размеры частиц веществ, составляющих систему, равны или меньше (размер атомов, молекул и ионов), то это молекулярно-дисперсная система, или истинный раствор.
Если размеры частиц веществ имеют размеры , то это коллоидно-дисперсная система, или коллоидный раствор.
Если же размеры частиц больше , то это грубодисперсная система.
Среди истинных растворов, в свою очередь выделяют два класса — растворы электролитов (ионов), которые проводят электрический ток, и растворы не электролитов (молекул).
Смешавшиеся в растворе частицы веществ могут взаимодействовать между собой. В связи с наличием или отсутствием взаимодействия частиц раствора между собой растворы можно разделить на реальные и идеальные. В реальных растворах изменяются свойства исходных молекул из-за межмолекулярного и химического взаимодействия частиц в растворе. В идеальных растворах взаимодействие частиц практически отсутствует, и растворяемое вещество сохраняет свои свойства. Идеальными при любых концентрациях являются растворы, компоненты которых очень близки по физическим и химическим свойствам, и образование которых не сопровождается изменением объема и выделением либо поглощением теплоты.
В связи с наличием или отсутствием взаимодействия частиц раствора между собой растворы можно разделить на реальные и идеальные. В реальных растворах изменяются свойства исходных молекул из-за межмолекулярного и химического взаимодействия частиц в растворе. В идеальных растворах взаимодействие частиц практически отсутствует, и растворяемое вещество сохраняет свои свойства. Идеальными при любых концентрациях являются растворы, компоненты которых очень близки по физическим и химическим свойствам, и образование которых не сопровождается изменением объема и выделением либо поглощением теплоты.
В 1887 году французский химик Франсуа Мари Рауль (1830-1901), изучая понижение температуры кристаллизации (замерзания), а также понижение давления пара (или повышения температуры кипения) растворителя при введении в него растворенного вещества, открыл ряд законов, называемых ныне законы Рауля. Это количественные закономерности, описывающие коллигативные, то есть зависящие от концентрации, но не от природы растворенного вещества, свойства растворов. Эти законы и описывают поведение идеальных растворов.
Эти законы и описывают поведение идеальных растворов.
Первый закон Рауля гласит (см. Закон Рауля), что
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
Либо, в случае двухкомпонентного раствора, что
Относительное понижение парциального давления пара растворителя (A) над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе.
Из этого закона есть два следствия, которые называют вторым законом Рауля.
Второй закон Рауля гласит, что
Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора.
и
Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
Коэффициенты пропорциональности K и E в этих уравнениях — криоскопическая и эбулиоскопическая постоянные растворителя, имеющие физический смысл температуры кристаллизации и повышения температуры кипения раствора с моляльной концентрацией 1 моль/кг. Растворы с такой концентрацией — 1 моль/кг, вообще говоря, никак не назвать бесконечно разбавленными, так что при определении этих постоянных речь идет об экстраполяции зависимости из области малых концентраций. Напомним, что моляльная концентрация (не путать с молярной) — это отношение количества растворенного вещества в молях к массе растворителя.
Растворы с такой концентрацией — 1 моль/кг, вообще говоря, никак не назвать бесконечно разбавленными, так что при определении этих постоянных речь идет об экстраполяции зависимости из области малых концентраций. Напомним, что моляльная концентрация (не путать с молярной) — это отношение количества растворенного вещества в молях к массе растворителя.
Если какой-либо раствор подчиняется законам идеальных растворов при любых концентрациях, то его называют совершенный раствор. Если раствор начинает подчиняться законам идеальных растворов только при достаточно большом разведении, то это бесконечно разбавленный раствор (концентрация растворенного вещества стремится к нулю). Во всех прочих случаях раствор считается реальным.
Все растворы электролитов — реальные растворы, так как растворяемое вещество в них диссоциирует на ионы. Законы Рауля для этих растворов не выполняются, даже в случае бесконечно разбавленных растворов.
В случае растворов не электролитов — чем более разбавлен раствор, тем ближе его свойства к идеальному. Однородные смеси неполярных веществ (углеводородов) близки к идеальным растворам при всех концентрациях.
Однородные смеси неполярных веществ (углеводородов) близки к идеальным растворам при всех концентрациях.
Теперь вернемся к водке.
———————-Обновление————————
Так вот, благодаря пытливым пользователям (смотри комментарии к калькулятору), автору пришлось выяснить, что второй закон Рауля не имеет к водке никакого отношения. Дело в том, что в законах Рауля речь идет о растворах нелетучих веществ (ну там, соль, например), которые уменьшают давление пара растворителя над раствором, а спирт — вещество вполне себе летучее и также создает давление пара над раствором. Для кипения водки применимы законы Коновалова, и выкипать спирт из водки начинает при температуре кипения спирта (как я понимаю).
Впрочем, в нескольких местах в Интернете я встречал использование второго закона Рауля для оценки температуры замерзания водки. Ничего точного на счет замерзания водки и применимости к этому второго закона Рауля я так и не нашел (химика бы сюда), однако полученные данные довольно близки к табличным, поэтому весь расчет ниже я оставлю без изменений, для иллюстрации использования калькулятора, однако с оговоркой, что температура кипения водки по второму закону Рауля не определяется, и замерзания, возможно, тоже.
———————Конец обновления————————
Водка, это раствор углеводорода в воде, поэтому применим второй закон Рауля для определения температуры замерзания водки.
Растворителем в данном случае является вода. Криоскопическая и эбулиоскопическая константы для нее приведены в справочнике Эбулиоскопические и криоскопические константы растворителей. Процентное соотнощение спирта и воды известно — 40%. Из этого можно определить моляльную концентрацию водки.
Определим, сколько спирта (m1) надо добавить в килограмм воды (m2), чтобы получить 40% соотношение (K)
,
следовательно
Таким образом, чтобы получить 40% раствор, в 1 кг воды надо влить примерно 666,6(6) грамм спирта (чем не повод отказаться от ее употребления).
Теперь осталось определить, сколько это молей вещества. Для этого надо знать молярную массу спирта. С учетом того, что формула этилового спирта известна всем , то воспользовавшись калькулятором Молярная масса соединений, находим, что молярная масса спирта 46 г/моль. Поделив массу спирта на его молярную массу находим что на килограмм растворителя приходится 14,49 моль спирта.
Поделив массу спирта на его молярную массу находим что на килограмм растворителя приходится 14,49 моль спирта.
Далее умножением на криоскопическую константу мы находим изменение температуры замерзания. Уменьшив температуру кристаллизации (замерзания) растворителя — воды, на полученную величину, мы и найдем температуру кристаллизации (-27) водки.
Впрочем, применительно к растворам, не говорят о «температуре кристаллизации раствора» и «температуре кипения раствора». Говорят так — «температура начала кристаллизации» и «температура начала кипения».
Дело в том, что как при кипении (испаряется растворитель), так и при кристаллизации (выделяются кристаллы растворителя) в оставшемся растворе увеличивается концентрация растворенного вещества, а следовательно, происходит дальнейшее уменьшение температуры кристаллизации либо увеличение температуры кипения.
На этом эффекте основаны методы очистки веществ, то есть очистки растворителя, например, воды — от примесей, которые нельзя удалить обычной фильтрацией. Кристаллизирующийся растворитель (особенно в начале кристаллизации), содержит меньше примесей (растворенных веществ), чем в остающемся растворе. Многократно повторяя кристаллизацию раствора и удаляя каждый раз обогащенный примесями остаток раствора, можно добиться значительной степени очистки (метод перекристаллизации). Тоже самое происходит и при кипячении — пар содержит меньше примесей по сравнению с остающимся раствором. Полученный пар заново конденсируют и снова испаряют, добиваясь очистки от примесей (метод дистилляции).
Кристаллизирующийся растворитель (особенно в начале кристаллизации), содержит меньше примесей (растворенных веществ), чем в остающемся растворе. Многократно повторяя кристаллизацию раствора и удаляя каждый раз обогащенный примесями остаток раствора, можно добиться значительной степени очистки (метод перекристаллизации). Тоже самое происходит и при кипячении — пар содержит меньше примесей по сравнению с остающимся раствором. Полученный пар заново конденсируют и снова испаряют, добиваясь очистки от примесей (метод дистилляции).
Ниже приведен калькулятор для определения температур начала замерзания и кипения растворов, повторяющий вышеприведенные расчеты.
Значения по умолчанию как раз соответствуют случаю водки.
Температура начала кипения и кристаллизации (замерзания) растворов не электролитов
Доля растворенного вещества, проценты
Молярная масса растворенного вещества, г/моль
РастворительОбновление…Точность вычисленияЗнаков после запятой: 1
Температура начала кристаллизации (замерзания)
Температура начала кипения
content_copy Ссылка save Сохранить extension Виджет
Кстати сказать, второй закон Рауля также используется для экспериментального определения молярной массы неизвестных веществ. Для этого некоторую массу исследуемого вещества растворяют в подходящем растворителе и замеряют понижение температуры начала кристаллизации или повышение температуры начала кипения раствора.
Для этого некоторую массу исследуемого вещества растворяют в подходящем растворителе и замеряют понижение температуры начала кристаллизации или повышение температуры начала кипения раствора.
Дальше расчет идет обратно приведенному выше. Исходя из полученной разницы температур и известных эбулиоскопических и криоскопических постоянных растворителя, определяется моляльная концентрация растворенного вещества в растворе, и соответственно, его молярная масса.
Следствия из закона Рауля
Из закона Рауля вытекают два важных следствия:
1) Растворы кипят при более высокой температуре, чем чистый растворитель;
2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
Рассмотрим их более подробно.
Кипение является физическим процессом
перехода жидкости в газообразное
состояние или пар, при котором пузырьки
газа образуются по всему объему жидкости.
Жидкость закипает, когда давление ее насыщенного пара становится равным внешнему давлению. Если внешнее давление (например, атмосферное) не изменяется, а сама жидкость является индивидуальным и химически чистым веществом, то кипение ее в открытом подогреваемом сосуде происходит при постоянной температуре до тех пор, пока полностью не исчезнет жидкая фаза.
Так, при атмосферном давлении равном 101,325 кПа, температура кипения очищенной (дистиллированной) воды равна 100оС или 373,16K.
Если же в Н2О растворить какое-нибудь нелетучее вещество, то давление ее насыщенного пара понизится. Чтобы получившийся раствор закипел, необходимо нагреть его до температуры выше, чем 373,16K, т.к., только при таких условиях давление насыщенного пара растворителя снова станет равным атмосферному.
Замерзание или кристаллизация представляет собой физическое явление,
сопровождающееся превращением жидкости
в твердое вещество. Причем кристаллические
структуры образуются во всем объеме
жидкости.
Причем кристаллические
структуры образуются во всем объеме
жидкости.
Процесс замерзания начинается, если давление насыщенного пара над жидкостью становится равным давлению насыщенного пара над ее твердыми кристалликами.
Если внешнее (атмосферное) давление остается постоянным, а жидкость не содержит посторонних примесей, то в процессе кристаллизации температура охлаждаемой жидкости будет оставаться постоянной до тех пор, пока жидкая фаза полностью не превратится в твердую.
При атмосферном давлении, равном 101,325 кПа, дистиллированная вода замерзает при 0оС (273,16K). Давление насыщенного пара воды надо льдом и жидкостью в этом случае равно 613,3 Па.
Для водного раствора давление насыщенного
пара растворителя при 0оС будет
меньше, чем 613,3 Па, а надо льдом остается
неизменным. Опущенный в такой раствор
лед будет быстро таять вследствие
конденсации над ним избыточного
количества пара.
Лишь при понижении температуры снова можно уравнять давление насыщенного пара над жидкой и твердой фазой и вызвать процесс кристаллизации.
Опытным путем было установлено, что повышение температуры кипения (tкип.) и понижение температуры замерзания раствора (tзам.) по сравнению с чистым растворителем, прямо пропорционально моляльной концентрации растворенного вещества. Математически это можно записать следующим образом:
tкип. р-ра –tкип. р-теля =tкип.=Em
tзам. р-теля–tзам. р-ра =tзам.=Km
где m – моляльная концентрация растворенного
вещества; E и K,
соответственно, эбуллиоскопическая
(лат. ebbulio – выкипаю)
и криоскопическая (греч. «криос» — холод)
константы, значения которых зависят
только от природы растворителя
(табл. 7).
«криос» — холод)
константы, значения которых зависят
только от природы растворителя
(табл. 7).
Таблица 7.ЭбуллиоскопическиеEи криоскопическиеKконстанты некоторых растворителей (град/моль)
Растворитель | Е | K |
1. Вода | 0,516 | 1,86 |
2. Этиловый спирт | 1,23 | — |
3. Бензол | 2,57 | 5,12 |
4. Уксусная кислота | 3,1 | 3,9 |
5. | 3,69 | 5,87 |
Эбуллиоскопическая и криоскопическая константы растворителя показывают, на сколько градусов повышается температура кипения и понижается температура замерзания раствора, полученного при растворении в одном килограмме растворителя одного моля неэлектролита (m = 1 моль/кг).
Для определения значений EиKсперва опытным путем определяютtкип. иtзам.сильно разбавленных растворов (m<< 1), а затем полученные данные пересчитывают или экстраполируют для растворов сm= 1 моль/кг.
Значения EиKможно рассчитать и теоретически с помощью соотношения Вант-Гоффа:
где R – универсальная газовая постоянная; T – температура кипения растворителя; — удельная теплота испарения растворителя.
где T – температура плавления растворителя; l – удельная теплота плавления растворителя.
Таким образом, растворы разных по своей природе веществ, но с одинаковой моляльной концентрацией будут кипеть и замерзать при одной и той же температуре.
Следует обратить внимание на важное
отличие раствора от чистого
растворителя. Если последний кипит и
замерзает при постоянной температуре,
то растворы делают это в интервале температур, т.е. в процессе их
выкипания температура все время
повышается, а при замерзании –
уменьшается. Это связано с тем, что
удаление из жидкой фазы растворителя
в виде пара или твердых кристаллов
приводит к увеличению моляльной
концентрации раствора, т.к. растворенное
вещество в процессе кипения и замерзания
в неизменном количестве остается в
жидкой фазе (вплоть до ее полного
выкипания или замерзания), а масса
жидкого растворителя уменьшается.
При практических измерениях температуры замерзания или кипения раствора фиксируют момент появления в нем первых твердых кристаллов(для tзам.) или пузырьков газа (для tкип.).
Свойство растворов понижать температуру замерзания позволяет использовать их в роли хладоносителей.
Так, растворы некоторых органических и неорганических веществ используют в качестве антифризов для охлаждения двигателей внутреннего сгорания при работе их в самых разных климатических условиях.
Понижение температуры
замерзания растворов имеет
большое значение для живых организмов.
Так, жидкость в их клетках представляет
собой раствор различных неорганических
и органических веществ. Его температура
замерзания лежит ниже 0оС
(273,16 K),
поэтому клетки не погибают в условиях
переохлаждения.
Благодаря данному явлению, растения сохраняются в зимний период. Причем, чем выше концентрация веществ в клеточной жидкости, тем более низкие внешние температуры может переносить растение.
При этом для понижения температуры замерзания раствора в охлаждаемых клетках усиливается процесс гидролиза более высокомолекулярных соединений до низкомолекулярных (например, углеводов – до глюкозы).
Температуры кипения и замерзания растворов (Курсовая работа)
Содержание:
- Свойства растворов электролитов
- Замерзание и кипение растворов
- Вывод:
| Предмет: | Химия |
| Тип работы: | Курсовая работа |
| Язык: | Русский |
| Дата добавления: | 15.04. 2019 2019 |
- Данный тип работы не является научным трудом, не является готовой выпускной квалификационной работой!
- Данный тип работы представляет собой готовый результат обработки, структурирования и форматирования собранной информации, предназначенной для использования в качестве источника материала для самостоятельной подготовки учебной работы.
Если вам тяжело разобраться в данной теме напишите мне в whatsapp разберём вашу тему, согласуем сроки и я вам помогу!
По этой ссылке вы сможете найти много готовых курсовых работ по химии:
Посмотрите похожие темы возможно они вам могут быть полезны:
Введение:
Температура кипения и замерзания растворов зависит от давления паров над растворами.
Жидкость кипит при такой температуре, что давление насыщенного пара равно внешнему давлению. Но из-за снижения давления паров над раствором температура кипения раствора всегда выше, чем у чистого растворителя.
Жидкость замерзает при той же температуре, при которой давление паров вещества в твердом состоянии становится равным давлению паров над раствором, раствор замерзает при более низкой температуре, чем чистый растворитель.
Второе следствие закона Рауля. По мере увеличения концентрации раствора температура кипения возрастает, а температура замерзания уменьшается прямо пропорционально его молярности.
Криоскопические и эбуллиоскопические константы зависят только от природы растворителя и не зависят от природы растворенного вещества.
Свойства растворов электролитов
Электролиты — это вещества, растворы или расплавы, которые проводят электрический ток.
Электролиты — это кислоты, основания и соли. По сравнению с металлами, которые проявляют электронную проводимость и являются проводниками первого типа, электролиты классифицируются как проводники второго типа.
Электропроводность растворов и расплавов электролитов обусловлена наличием в них положительно и отрицательно заряженных ионов, которые образуются из молекул или кристаллических веществ в результате их разложения при растворении в воде или расплавлении.
Электролитическая диссоциация — расщепление электролита на ионы в водных растворах или расплавах.
Причиной разложения растворенного вещества на ионы является интенсивное взаимодействие ионов с молекулами растворителя, то есть сольватация ионов. Частным случаем сольватации ионов является гидратация, то есть их взаимодействие с водой.
Концепция гидратации ионов впервые была введена Д.И. Менделеев в своей химической теории растворов. Дальнейшие исследования И.А. Каблуков и В.А. Кистяковский, а также теория электролитической диссоциации С. Аррениуса позволили объяснить свойства растворов электролитов.
Основные положения теории электролитической диссоциации для водных растворов:
- При растворении в воде молекулы электролита диссоциируют (распадаются) на положительно и отрицательно заряженные ионы. Ионы могут образовываться из одного атома — простых ионов и нескольких атомов — комплексных ионов.
- Диссоциация является обратимым процессом. Как правило, он не течет до конца, но в системе устанавливается динамическое равновесие, то есть состояние, в котором скорость диссоциации равна скорости обратного процесса образования исходных молекул.
Количественная характеристика равновесного состояния диссоциации слабого электролита также может быть получена с использованием степени диссоциации b, которая показывает, сколько молекул электролита в растворе распалось на ионы.
Степень диссоциации электролита зависит от разбавления. Если растворитель удаляется из раствора, концентрация электролита увеличивается, а ионы снова объединяются, образуя недиссоциированные молекулы. Наоборот, при разбавлении степень диссоциации увеличивается. При бесконечном разбавлении раствора (т.е. при концентрации, близкой к нулю), электролиты полностью разлагаются на ионы
Ионы в водном растворе находятся в хаотическом движении. Если электроды опускаются в раствор электролита и на них подается электрическое напряжение, то ионы приобретают направленное движение: положительные ионы движутся к катоду (отрицательный электрод), а отрицательные ионы движутся к аноду (положительный электрод). В результате были названы ионы: положительные — катионы, отрицательные — анионы.
Замерзание и кипение растворов
Все чистые вещества характеризуются строго определенными температурами (или точками) замерзания и кипения. Таким образом, чистая вода при нормальном атмосферном давлении замерзает при 0 ° и кипит при 100 °; бензол замерзает при 5,5 °, кипит при 80,1 ° и так далее. Эти температуры остаются неизменными, пока вся жидкость не замерзнет или не превратится в пар.
С решениями ситуация иная. Присутствие растворенного вещества повышает температуру кипения и понижает температуру замерзания растворителя, и чем сильнее, тем более концентрированный раствор. Поэтому растворы замерзают при более низких температурах и кипят при более высоких температурах, чем чистые растворители. Нетрудно доказать, что это является прямым следствием снижения давления паров растворов.
Как известно, любая жидкость начинает кипеть при температуре, при которой давление ее насыщенного пара достигает значения внешнего давления. Например, вода под давлением 760 мм рт. Искусство. кипит при 100 °, потому что при этой температуре давление водяного пара составляет ровно 760 мм. Если вы растворите какое-либо вещество в воде, то давление его пара уменьшится. Чтобы довести давление пара полученного раствора до 760 мм, очевидно, необходимо нагревать раствор выше 100 °. Отсюда следует, что температура кипения раствора всегда будет выше температуры кипения чистого растворителя.
Более низкая температура замерзания раствора по сравнению с чистым растворителем объясняется тем, что температура замерзания — это температура, при которой могут существовать одновременно твердые и жидкие фазы ожидаемого вещества (стр. 218). Однако для этого необходимо, чтобы давление паров твердой и жидкой фаз было одинаковым, иначе пар будет переходить из одной фазы в другую до полного исчезновения той фазы, выше которой давление пара больше. Лед и вода могут существовать вместе бесконечно при 0 °, потому что при 0 ° давление пара льда (4,6 мм) равно давлению пара воды. Эта температура является точкой замерзания чистой воды.
Если взять не чистую воду, а какой-то раствор, то давление ее пара при 0 ° будет меньше 4,6 мм; следовательно, лед, погруженный в такой раствор, быстро тает. Одновременное существование льда и раствора будет возможно только при температурах ниже 0 °, и именно при таких, при которых давление их паров станет одинаковым. Другими словами, раствор замерзнет при более низкой температуре, чем чистый растворитель.
Все эти соотношения станут особенно понятными, если вы изобразите их графически, построив кривые изменения давления пара с температурой. Линия aa1 показывает кривую давления пара чистой воды, а линия bb1 — кривая давления пара раствора. Поскольку при любой температуре давление пара раствора меньше, чем давление пара чистой воды, линия bb1 лежит ниже линии аа. Для определения из этих кривых точки кипения воды и раствора при некотором давлении, например, при 760 мм, нарисуйте из соответствующей точки на ординате прямую линию, параллельную абсциссе. Из точек a1 и b1 пересечения этой прямой с кривыми давления пара выпадем перпендикуляры к оси абсцисс. Температуры T и T1 будут соответствовать точкам кипения воды и раствора, поскольку при этих температурах давление их паров одинаково. Мы видим, что точка кипения раствора лежит выше точки кипения чистой воды.
Мы уже говорили, что в точке замерзания давление паров твердой и жидкой фаз растворителя или твердого растворителя и раствора должно быть одинаковым. Это условие выполняется точками a и b пересечения кривых aa1 и bb1 с кривой ac. Точки замерзания воды и раствора определяются как проекция точек a и b на ось абсцисс. В этом случае, как видно из рисунка, температуры T и T1 расположены в обратном порядке, то есть точка замерзания раствора меньше, чем точка замерзания воды.
Когда разбавленные растворы замерзают, чистый растворитель первоначально высвобождается в твердой форме, например, в случае водного раствора, чистого льда. Поскольку концентрация раствора увеличивается с выделением льда, температура замерзания не остается постоянной, а постепенно уменьшается. Однако высвобождение льда и снижение температуры замерзания происходят только до тех пор, пока концентрация раствора не достигнет определенного значения, характерного для данного вещества, при котором весь раствор затвердевает в непрерывную массу. Под микроскопом видно, что он состоит из тонких слоев льда и растворенного вещества в твердой форме. Эта масса называется эвтектикой. Температура, при которой происходит его образование, называется эвтектикой, а температура — соответствующей концентрацией раствора, называется концентрацией эвтектики.
Возьмите, например, 10% раствор хлорида натрия и начните его охлаждать. Первое появление кристаллов льда наблюдается при температуре около -7 °. Когда лед отделяется, концентрация оставшегося раствора увеличивается, а температура замерзания падает все ниже и ниже. Наконец, когда концентрация NaCl достигает 24,42%, весь раствор затвердевает в твердую белую массу — эвтектику. Это происходит при температуре -21,2 °, которая, таким образом, является эвтектической температурой для раствора хлорида натрия.
Аналогичная картина наблюдается при охлаждении насыщенных растворов, то есть таких растворов, в которых концентрация растворенного вещества выше, чем эвтектика. Различие в поведении этих растворов заключается в том, что при их охлаждении в первую очередь выделяется не лед, а растворенное вещество в твердой форме. Например, из раствора хлорида натрия, насыщенного при 20 °, содержащего 26,4% NaCl, соль выделяется при охлаждении. По мере высвобождения соли концентрация раствора уменьшается, и когда она становится равной 24,42%, образуется эвтектика (при температуре -21,2 °). Таким образом, когда какой-либо насыщенный раствор охлаждается, после выделения определенного количества кристаллов в конечном итоге образуется эвтектика.
Показана кривая замерзания растворов хлорида натрия различных концентраций. На рисунке видно, что с увеличением концентрации температура замерзания уменьшается. Самая низкая точка кривой соответствует эвтектической температуре –21,2 ° и эвтектической концентрации NaCl 24,42%. При дальнейшем увеличении концентрации точка замерзания (то есть температура, при которой твердая фаза начинает осаждаться) снова повышается, но теперь из раствора в твердой форме высвобождается не вода, а поваренная соль.
Температура эвтектики самая низкая из всех возможных: температура замерзания растворов данного вещества. Это очень разные для разных веществ. Так, например, для: нитрата калия температура эвтектики составляет всего — 2,9 ° (при эвтектической концентрации 10,9% KNO3), для поваренной соли — 21,2 °, для хлорида кальция — 55 °, для серной кислоты — 75 ° и и т.п.
Низкая эвтектическая температура поваренной соли объясняет таяние обсыпанного солью льда. Лед и соль не могут существовать вместе при температуре выше -21,2 ° C; поэтому при смешивании с солью лед сразу же начинает таять. Способность льда поглощать большое количество тепла во время таяния используется для приготовления охлаждающих смесей, открытых Бойлем в 1665 году и особенно тщательно изученных Т.Е. Lovitsm. В 1792 году, смешивая снег с хлористым кальцием, Ловиц впервые достиг охлаждения до -50 °. Понятно, что таким способом невозможно получить температуру ниже эвтектики.
Подобно тому, как разбавленные растворы замерзают, осажденная твердая фаза состоит из чистого растворителя, поэтому, когда растворы твердых веществ кипят в жидкостях, образующиеся пары состоят из чистого растворителя. Следовательно, когда жидкость выкипает, концентрация раствора увеличивается и температура кипения увеличивается, пока раствор не станет насыщенным и не начнется кристаллизация. Как только начинается кристаллизация, концентрация раствора перестает изменяться и температура кипения становится постоянной.
С количественной стороны явления замораживания и кипения растворов были изучены Раулем, который экспериментально установил следующие положения, известные как законы Рауля.
Понижение точки замерзания пропорционально количеству вещества, растворенного в данном весовом количестве растворителя.
Например, раствор, содержащий 5 г сахара в 100 г воды, замерзает при минус 0,27 ° и содержит 10 г при минус 0,54 ° и т. д.
Эквимолекулярные количества различных веществ, растворенных в одном и том же весовом количестве данного растворителя, понижают его температуру замерзания на то же число градусов.
Например, когда 0,1 г сахара (34,2 г) растворяют в 1000 г воды, температура замерзания уменьшается на 0,186 °. Такое же снижение дает 0,1 г молекулы глюкозы (18 г), 0,1 г перекиси водорода (3,4 г) и т. д.
Понижение точки замерзания, соответствующее (по расчету) растворению 1 грамма вещества в 1000 г растворителя (молекулярное понижение), является постоянной величиной для данного растворителя. Это называется криоскопической константой растворителя. Криоскопические константы различны для разных растворителей. Ниже приведены некоторые из них.
Рауль установил довольно похожие законы в отношении повышения температуры кипения. Молекулярное повышение температуры кипения, то есть увеличение, вызванное растворением 1 грамма вещества в 1000 г растворителя, называется константой эбулиоскопического растворителя.
где ∆t — понижение температуры замерзания или повышение температуры кипения растворителя; С — число молей растворенного вещества на 1000 г растворителя; K — коэффициент пропорциональности, равный криоскопической или эбулиоскопической константе растворителя соответственно (при C = 1 ∆t = K). Поскольку число молей вещества равно его массе в граммах (т), деленной на молекулярную массу (М), то, заменяя в предыдущем
Законы Рауля применяются с теми же ограничениями, о которых мы говорили при изложении закона Вант-Хоффа: концентрированные растворы и растворы электролитов сильно отклоняются от этих законов.
Теоретическое обоснование законов Рауля было дано Вант Хоффом, который указал на их связь с законом осмотического давления и производными уравнениями, которые позволяют рассчитывать осмотическое давление путем понижения точки замерзания или повышения температуры кипения решение.
Вывод:
Очень удобные методы определения молекулярных масс растворенных веществ основаны на законах Рауля. Чтобы определить, возьмите образец испытуемого вещества, растворите его в определенном количестве растворителя и установите снижение температуры замерзания или повышение температуры кипения, вызванное этим. Из этих данных легко рассчитать молекулярную массу растворенного вещества, если известна константа криоскопического или эбулиоскопического растворителя. И наоборот, зная молекулярную массу растворенного вещества, таким же образом, вы можете определить криоскопическую или эбулиоскопическую константу.
Метод определения молекулярной массы путем понижения точки замерзания растворителя называется криоскопическим, а за счет увеличения кипения утки — эбулиоскопическим.
Оба метода широко используются в химии, поскольку, используя различные растворители, можно определить молекулярные массы широкого спектра веществ. Понижая точку затвердевания растворов одних металлов в других, определяли молекулярную массу ряда металлов.
5.5. Коллигативные свойства растворов — СтудИзба
5.5. Коллигативные свойства растворов.
Коллигативные свойства растворов — свойства раствора связанные друг с другом и обусловленные общими причинами, главным из которых является число растворенных частиц в растворе.
Добавление растворимого вещества к растворителю влияет на изменение физико-химических свойств не только растворенного вещества, но и самого растворителя. Изменение свойств растворенного вещества обусловлено образованием сольватов. Это выражается в изменении цвета, объема и т. п. Основной причиной изменения свойств растворителя является уменьшение концентрации его свободных молекул. В первую очередь изменяются такие свойства, как давление насыщенного пара растворителя, температуры замерзания и кипения раствора, а также осмотическое давление. Перечисленные свойства относятся к коллигативным свойствам растворов.
I закон Рауля
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворимого вещества.
Математическим выражением закона Рауля является уравнение:
(Ро – Р)/Ро = N2,
где N2 – мольная доля растворенного вещества;
Р0 — давление насыщенного пара растворителя над чистым растворителем;
Р — давление насыщенного пара растворителя над раствором.
Давление насыщенного пара растворителя над раствором всегда ниже, чем, над чистым растворителем (Р0>P). Явление понижения давления насыщенного пара над раствором вытекает из принципа Ле Шателье. Представим себе равновесие между жидкостью, например, водой и ее паром. Это равновесие, которому отвечает определенное давление насыщенного пара, можно выразить уравнением
(Н2О)жидк ó (Н2О)пар
Если теперь растворить в воде некоторое количество какого-либо вещества, то концентрация молекул воды в воде понизится и пойдет процесс, увеличивающий ее, — конденсация пара. Новое равновесие установится при более низком давлении насыщенного пара.
Рассмотрим следствия, вытекающие из этого утверждения. На фазовой диаграмме однокомпонентной системы линия О*В* зависимости давления пара растворителя над раствором расположится ниже аналогичной кривой ОВ для чистого растворителя (рис. 5.2).
Отсюда вытекает первое следствие понижения давления насыщенного пара растворителя над раствором:
Раствор всегда кипит при температуре выше температуры кипения чистого растворителя.
Жидкость закипает тогда, когда давление насыщенного пара над ней становится равным внешнему давлению. Из рис. 5.2 видно, что температура кипения раствора больше, чем температура кипения чистого растворителя, т. к. давление насыщенного пара растворителя достигает внешнего давления при более высокой температуре.
Рис. 5.2. Зависимость давления насыщенного пара растворителя над раствором и чистым растворителем.
Начало кристаллизации жидкости начинается, когда сравниваются давления насыщенных паров над твердой и жидкой фазой. На рис. 5.2. видно, что это происходит для раствора при более низкой температуре, чем для чистого растворителя. Следовательно:
Раствор начинает замерзать при более низкой температуре, чем чистый растворитель.
Этим свойством растворов широко пользуются дворники для очистки тротуаров ото льда зимой. Если ко льду добавить соль, то образуется раствор, температура замерзания которого ниже температуры окружающей среды, и лед тает.
Чем выше концентрация раствора, тем давление насыщенного пара растворителя над ним будет ниже, и раствор будет закипать при более высоких температурах, а замерзать при более низких. Отсюда:
II закон Рауля
Повышение температуры кипения или понижение температуры кристаллизации раствора прямо пропорционально моляльной концентрации растворенного вещества.
∆tкип = КЭ·сm; ∆tкрист = КК·сm, (5.1)
где сm– моляльная концентрация раствора; КЭ – эбуллиоскопическая константа растворителя; КК – криоскопическая константа растворителя.
Моляльная концентрация в уравнениях, являющихся математическим выражением второго закона Рауля, применяется вследствие того, что во всех других способах выражения концентраций количество растворителя зависит от количества растворенного вещества, а в моляльной концентрации фиксировано количество растворителя (1000 граммов). Так что изменение температур плавления и кипения раствора будет зависеть лишь от количества частиц растворенного в нем вещества.
Физический смысл констант КЭ и КК легко сформулировать, допустив, что концентрация равна единице. Отсюда следует, что
эбуллиоскопическая постоянная равна моляльному повышению температуры кипения, а криоскопическая постоянная равна моляльному понижению температуры замерзания раствора.
Если в растворе растворено п граммов вещества в т граммах растворителя, то легко рассчитать моляльную концентрацию раствора. Для этого надо поделить массу растворенного вещества на М — его молекулярную массу, умножить на 1000 и разделить на массу растворителя. Получим, что
сm = 1000n/Mm.
Подставив полученное выражение концентрации в уравнения (5.1), получим уравнения для вычисления изменений температур плавления и кипения растворов:
∆tкип = КЭ· 1000n/Mm ; ∆tкрист = КК·1000n/Mm. (5.2)
Способность понижать температуру плавления или повышать температуру кипения растворов используют для определения молекулярных масс новых соединений. Массы неизвестного вещества и растворителя можно определить точно. Эбуллиоскопические и криоскопические постоянные определены с большой точностью для большого числа растворителей, и их значения можно найти в справочниках. Разность между температурами кипения чистого растворителя и раствора легко измеряется. Тогда в уравнениях (5.2) единственной неизвестной величиной является молекулярная масса, которую можно таким образом определить очень точно. Эти методы применимы только для соединений, не диссоциирующих в выбранном растворителе.
Методами эбуллиоскопии и криоскопии можно вычислять и среднюю степень полимеризации, так как с их помощью находят среднюю молекулярную массу полимера, а молекулярная масса мономера известна.
Осмос. Осмотическое давление.
Одним из свойств растворов, связанных с изменением количества свободных молекул растворителя, является осмос. Осмотические явления возникают на границе двух растворов различной концентрации, разделенных полупроницаемой перегородкой. Полупроницаемая перегородка пропускает только молекулы растворителя и препятствует проникновению через нее частиц растворенного вещества.
Сущность явления осмоса состоит в том, что происходит выравнивание концентраций соприкасающихся растворов за счет самопроизвольного перехода молекул растворителя через полупроницаемую перегородку из одного раствора в другой под влиянием разницы их концентраций.
Возьмем сосуд, в котором два раствора разделены гибкой полупроницаемой перегородкой (рис. 5.3).
При равенстве концентраций растворов число молекул растворителя, проходящих из одного раствора в другой в единицу времени, будет одинаковым, вследствие чего объемы растворов не будут изменяться. Когда же концентрации растворов разные (см. рис. 5.3, Ci> C2), то скорость перехода молекул растворителя из менее концентрированного раствора выше,
Рис.5.3. Схема возникновения явления осмоса
чем из более концентрированного. Это приводит в данном случае к увеличению объема правого раствора и уменьшению левого. Осмос прекращается, когда концентрации в обоих растворах сравняются. Количественно это явление можно охарактеризовать величиной давления, которое нужно приложить к раствору, чтобы прекратилось проникновение молекул растворителя в раствор с большей концентрацией соли из более разбавленного. Такое давление называется осмотическим давлением.
Рассчитать величину осмотического давления можно по формуле:
π=Cм RT, (5.3)
где π — осмотическое давление, См — молярная концентрация раствора (моль/л), R — универсальная газовая постоянная, Т — температура в К.
Если выразить концентрацию через количество вещества и объем в литрах: n/V и подставить это отношение в уравнение (5.3), получим выражение:
π V =n RT/V, (5.4)
напоминающее уравнение Менделеева-Клайперона для идеального газа.
Используя уравнение (5.4), сформулируем физический смысл осмотического давления:
Осмотическое давление — это такое давление, которое создавало бы растворенное вещество в количестве n молей, если бы оно находилось в объеме раствора в газообразном состоянии при данной температуре.
Явление осмоса играет большую роль в биологии, так как свойствами полупроницаемых перегородок обладает большинство тканей организмов. Процессы обмена веществ, усвоение пищи тесно связаны с этим явлением. Резь в глазах, возникающая у человека при нырянии, также обуславливается различной проницаемостью молекул воды через глазные ткани. Этим же объясняется невозможность существования пресноводных рыб в морской воде.
Замерзание растворов — Энциклопедия по машиностроению XXL
Понижение температуры замерзания раствора. Если растворенное в жидкой фазе вещество не переходит в твердую фазу (т. е. нерастворимо в ней), то для температуры замерзания будет справедливо соотношение, вполне аналогичное выражению (14.10), т. е. [c.504]Этот вывод может быть получен также на основании принципа смещения равновесия. Так как твердая фаза раствора состоит из чистого растворителя, то количество переходящего в данных условиях в твердую фазу вещества растворителя будет согласно принципу смещения равновесия меньше, чем при отсутствии растворенного вещества. Поэтому для того, чтобы перевести весь растворитель в твердую фазу, необходимо охладить раствор до более низкой температуры, что и означает понижение температуры замерзания раствора по сравнению с температурой чистого растворителя. [c.505]
Жидкие растворы. С помощью диаграммы состояния удобно исследовать процесс кипения и замерзания раствора любых концентраций. [c.509]
Температура замерзания раствора Т, определяемая из (2.61), есть температура, при которой, раствор становится насыщенным относительно одного из веществ. Согласно (2.61) температура затвердевания каждого компонента уменьшается при увеличении его концентрации в растворе . Таким образом, если чистое вещество плавится при температуре 7о1, то из раствора оно выделяется при более низкой температуре Т[c.44]
В процессе кристаллизации теплота выделяется, т. е. Гц температура замерзания раствора понижается по сравнению с температурой чистого растворителя. [c.492]
На основании измерения температуры плавления (замерзания) растворов, сопровождающегося образованием только твердой фазы растворителя (табл. 7.5). Вычисление активности растворителя проводят по уравнению [c.246]
Понижение температуры замерзания раствора, соответствующее (по расчету) растворению [c.267]
Более низкая температура замерзания раствора по сравнению с чистой водой объясняется тем, что именно при этой температуре могут сосуществовать твердая и жидкая фаза данного вещества. Однако для этого необходимо, чтобы давление пара твердой и жидкой фаз было одинаковым, иначе пар будет переходить из одной фазы в другую до исчезновения той из них, над которой давление выше. [c.21]
Кривые зависимости температуры замерзания и кипения растворов от концентрации солей показаны на рис. 1-7 и 1-8, Соли, более гидратированные при одинаковой мольной концентрации, вызывают большее повышение температуры кипения и снижения температуры замерзания раствора, чем менее гидратированные. [c.21]
ДАВЛЕНИЕ ПАРА, ТОЧКА КИПЕНИЯ И ТОЧКА ЗАМЕРЗАНИЯ РАСТВОРА [c.114]Давление пара, точка кипения и точка замерзания раствора не такие, как для чистого растворителя. Этот факт очень важен с практической точки зрения, потому что, как будет показано ниже, изменения в точках кипения и замерзания, по крайней мере для разбавленных растворов, пропорциональны молярным концентрациям растворенных веществ. Измерение зтих изменений дает очень удобный метод определения молярной концентрации раствора. [c.114]
Давление пара, точка кипения и точка замерзания раствора 117 [c.117]
Ту же формулу (1Ё0) можно также использовать для того, чтобы определить изменение точки замерзания раствора. Разница заключается лишь в том, что вместо парообразной фазы мы имеем здесь твердую фазу. Величина Л в данном случае представляет теплоту, поглощенную одним молем растворителя при изотермическом переходе через точку замерзания из жидкого состояния в твердое. Эта теплота отрицательна и равна —А, где Л — теплота плавления одного моля растворителя. В случае замерзания уравнение (190) удобно записать так [c.119]
Данные по растворимости солей и температурам замерзания растворов лежат в основе различных технологических схем галургических производств. Поэтому они имеют первостепенное значение среди других свойств. [c.60]
Фнг. 271. Температура замерзания раствора хлористого кальция. [c.239]
Таким образом, в зависимости от содержания в растворе воды изменяется и температура замерзания раствора. Так, при содержании воды в растворе О, 10, 20, 30, 33, 40, 50, 60% температура замерзания раствора соответственно составит минус 12, 29, 48, 68, 75, 55, 34,24°С. [c.260]
Следует иметь в виду, что во время использования антифриза в системе охлаждения из него испаряется вода, что приводит к понижению температуры замерзания раствора. [c.260]
Точка замерзания раствора 9 С-1,858 х(0,001313—количество молей растворенного вещества в 1000 г воды). [c.334]
Для выявления сквозных дефектов, нарушающих герметичность сварного соединения, применяют также метод обдува воздухом. В этом случае одну сторону сварного шва промазывают мыльным раствором (0,1 кг хозяйственного мыла на 1 л воды), а другую сторону шва обдувают сжатым воздухом под давлением около 0,4—0,5 МПа. Струю сжатого воздуха направляют из шланга перпендикулярно поверхности шва, причем расстояние между наконечником шланга и изделием не должно превышать 5 см. Если испытание проводится при низких температурах (ниже 0°С), то в мыльный раствор добавляют спирт, чтобы избежать замерзания раствора. Если в шве имеются сквозные дефекты, то они обнаруживаются по появлению мыльных пузырей. [c.188]
Исследование процесса кипения и замерзания раствора любых концентраций гдобно производить при помощи диаграммы состояния раствора, на которой по осям координат откладываются значения температуры Т и состава (концентрации с или 2) раствора при p= onst. [c.324]
Электролитич. диссоциация приводит к увеличению общего числа частиц в растворе, поэто.му свойства разбавленных растворов Э. отличаются от свойств обычных разбавленных растворов. Так, происходит увеличение осмотич. давления раствора и отклонение от ур-ния Вант-Гоффа (см. Осмос), понижение давления пара растворителя над раствором и его отклонение от Рауля закона, возрастание темп-ры кипения и снижение темп-ры замерзания раствора Э. [c.536]
В тех системах, где вода является одним из компонентов, эвтектическая точка называется криогидратной. Она характеризует состав системы при одновременной кристаллизации льда и соли В и также обладает наиболее низкой температурой замерзания раствора. Постоянство температуры плавления криогидратной смеси и соответственно температуры замерзания раствора состава Е приводили к ошибочному толкованию криогидратов как химических соединений. На самом деле крио- [c.54]
Давление пара, точка кипепия и точка замерзания раствора 115 [c.115]
Определите осмотическое давлепие и изменение точек кипения и замерзания раствора, содержавшего 30 г Na l в 1 л воды. [c.120]
Температуры замерзания растворов разного состава характеризуют линии растворимости льда и, таким образом, являются составной частью политерм растворимости водно-солевых и других систем. [c.61]
Исследование процессов кипения и замерзания растворов любых концентраций удобно производить при помощи диаграмм состояния растворов, на которых но осям координат откладываются значения температуры t и состава (концентрация с или z) раствора при р == onst. В дальнейшем мы будем рас-матривать только растворы двух жидкостей, мешивающихся друг с другом во всех отношениях. [c.191]
Передвижная штукатурная станция ПШСФ-2 (рис. П1) предназначена для механизации производственных процессов при проведении штукатурных работ в жилых и производственных зданиях. Станция установлена на подкатном шасси. Для предотвращения замерзания раствора в зимнее время внутри станции установлены электронагреватели — ТЭНы. [c.192]
В гл. 7, очень неоднородной по содержанию, рассматриваются следующие темы равновесие фаз правило фаз уравнение Дюпре — Ренкина химические константы Нернста тепловая теорема Нернста теоре.ма Нернста в случае газовой реакции теорема Нернста в случае неоднородной химической реакции теплоемкость газов и твердых тел теория разбавленных растворов случай реакции в газовой смеси случай испарения чистого растворителя испарепие и замерзание раствора нелетучих веществ осмотическое давление теплота растворителя в насыщенном растворе соотношение между теплотой и электрической энергией соотношение между электровозбудитель-ной силой и эффекта.ми Томсона и Пельтье лучистая теплота соотношение между лучеиспусканием и поглощение.м давление тепловых лучей закон Стефана закон смещений. [c.207]
В зимнее время до понижения температуры замерзания растворов в их состав вводят противоморозные добавки поташ и нитрит натрия в виде 15 %-ного водного раствора. [c.234]
Антифриз В-2 — светлая жидкость без механических примесей с удельным весом 1,055—1,080 и температурой замерзания минус 40°. При иных, чем в стандартном антифризе В-2, соотношениях воды и этиленгликоля изменяются и температуры замерзания раствора. Наиболее низкую температл ру замерзания — (минус 75°) водные растворы этиленгликоля будут иметь при содержании ЗЗР/о воды и 67о/о этиленгликоля. При дальнейшем увеличении содержания этиленглиголя, а также и при его уменьшении температура замерзания смеси будет повышаться в сторону плюса. [c.112]
Действие хлористых солей основано на низкой температуре замерзания их растворов. Если соли применяют при температуре выше, чем температура замерзания раствора, то соли поглощают влагу льда, образуют незамерзающий раствор, разры.хляя лед до кашеобразного состояния. В таком виде лед необходимо немедленно удалить механическими плугами и щетками. [c.142]
Насыш.ение воды воздухом. Подробные результаты вычисления удельных электропроводностей, состава и точек замерзания растворов, насыщенных воздухом при различных температурах и давлениях, приводятся в табл. 2 и 3 и резюмируются в табл. 4. В основу вычислений были положены уравнение состояния идеальных газов, законы идеальных растворов и законы Дальтона и Генри. Вводимые при этом предположения, повидимому, не вносят ошибки, превышающей 0,5%. Содержание углекислоты в воздухе определялось три раза полученные значения находились между 0,034—0,036 мол.%. [c.334]
На рис. 117 ириведен график изменения температуры замерзания растворов хлористого кальция. [c.200]
Депрессия точки замерзания | Введение в химию
Цель обучения
- Обсудить влияние растворенного вещества на точку замерзания растворителя
Ключевые моменты
- Понижение точки замерзания можно рассчитать, используя точку замерзания чистого растворителя и моляльность раствора.
- В точке замерзания давление паров твердой и жидкой формы соединения должно быть одинаковым.
- Точка замерзания вещества — это температура, при которой твердая и жидкая формы находятся в равновесии.
- Для восстановления равновесия температура замерзания смеси растворенного вещества и растворителя понижается по сравнению с исходным чистым растворителем.
Условия
- Понижение точки замерзания Добавление растворенного вещества к растворителю снижает температуру, при которой жидкий растворитель становится твердым.
- давление пара: Давление, которое оказывает пар, или парциальное давление, если он смешивается с другими газами.
- Фактор Ван ‘т Гоффа Мера влияния растворенного вещества на коллигативные свойства.
- точка замерзания Температура, при которой жидкость замерзает, а твердая и жидкая фазы находятся в равновесии; обычно такая же, как температура плавления.
Понижение точки замерзания — это явление, которое описывает, почему добавление растворенного вещества к растворителю приводит к снижению точки замерзания растворителя. Когда вещество начинает замерзать, молекулы замедляются из-за снижения температуры, и начинают действовать межмолекулярные силы.Затем молекулы образуют узор и, таким образом, превращаются в твердое тело. Например, когда вода охлаждается до точки замерзания, ее молекулы становятся медленнее, а водородные связи начинают больше «прилипать», в конечном итоге создавая твердое тело. Если в воду добавляется соль, ионы Na + и Cl — притягиваются к молекулам воды и препятствуют образованию крупной твердой сетки, известной как лед. Чтобы добиться твердого состояния, раствор необходимо охладить до еще более низкой температуры.
Понижение температуры замерзания можно также объяснить с точки зрения давления пара. Добавление растворенного вещества в растворитель будет существенно разбавлять молекулы растворителя, и, согласно закону Рауля, это приводит к снижению давления пара. Принимая во внимание тот факт, что давление пара твердой и жидкой форм должно быть одинаковым в точке замерзания, поскольку в противном случае система не была бы в равновесии, снижение давления пара приводит к понижению температуры, при которой давление пара жидкая и замороженная формы раствора будут равны.
Влияние растворенных веществ на физические свойства Трехфазная диаграмма, которая показывает давление и температуру при нормальных точках кипения и замерзания растворителя (зеленые линии), а также точки кипения и замерзания раствора (фиолетовые линии). Обратите внимание, что при давлении 1 атм точка замерзания была понижена (обозначена цифрами 2 и 4).Понижение температуры замерзания можно рассчитать по формуле:
[латекс] \ Delta T_f = i \ times K_f \ times моляльность [/ латекс]
В этом уравнении [латекс] \ Delta T_f [/ latex] — это депрессия точки замерзания, Kf — константа депрессии точки замерзания, а i — фактор Ван ‘т Хоффа.Постоянная депрессии точки замерзания изменяется в зависимости от растворителя, а коэффициент ван т Хоффа учитывает количество частиц, которые растворяющееся вещество создает в растворе.
Пример
Какова точка замерзания водного раствора при добавлении достаточного количества NaCl для создания 0,25 м раствора? Значение K f для воды составляет 1,858 o C / м.
Чтобы решить эту проблему, вы должны помнить, что NaCl распадается на два иона, Na + и Cl —, когда он растворяется в воде.oC [/ латекс]
Может показаться, что проблема решена, но это не так. Значение 0,93 o C — это изменение точки замерзания. Новая точка замерзания воды, которая обычно составляет 0 o C, равна: 0 — 0,93 = -0,93 o C.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Депрессия точки замерзания | Химия для неосновных
Цели обучения
- Определите депрессию точки замерзания.
- Рассчитайте точку замерзания раствора при заданной константе депрессии молярной точки замерзания.
Почему соленые обледенелые дороги?
Коллигативные свойства находят практическое применение, например, при засолке дорог в холодном климате. При нанесении соли на обледеневшую дорогу температура плавления льда снижается, и лед тает быстрее, что делает вождение более безопасным. Чаще всего используются хлорид натрия (NaCl) и хлорид кальция (CaCl 2 ) или хлорид магния (MgCl 2 ) по отдельности или в смеси.Хлорид натрия — наименее дорогой вариант, но он менее эффективен, поскольку диссоциирует только на два иона вместо трех.
Депрессия точки замерзания
На рисунке ниже показана фазовая диаграмма для чистого растворителя и ее изменение при добавлении в него растворенного вещества. Растворенное вещество снижает давление пара растворителя, что приводит к снижению точки замерзания раствора по сравнению с растворителем. Понижение точки замерзания представляет собой разницу температур между точкой замерзания чистого растворителя и температурой раствора.На графике депрессия точки замерзания представлена значком.
Рис. 1. Давление пара раствора (синий) ниже, чем давление пара чистого растворителя (розовый). В результате температура замерзания растворителя снижается, когда в нем растворяется любое растворенное вещество. Рисунок из фонда CK-12 — Кристофер Ауён.
Когда чистый растворитель замерзает, его частицы становятся более упорядоченными, поскольку межмолекулярные силы, действующие между молекулами, становятся постоянными.В случае воды водородные связи образуют гексагональную сеть молекул, которая характеризует структуру льда. При растворении растворенного вещества в жидком растворителе этот процесс упорядочивания нарушается. В результате из раствора необходимо отобрать больше энергии, чтобы заморозить его, а температура замерзания раствора ниже, чем у чистого растворителя.
Величина понижения точки замерзания прямо пропорциональна моляльности раствора. Уравнение:
Константа пропорциональности, называется константой депрессии молярной точки замерзания .Это константа, которая равна изменению точки замерзания для 1-моляльного раствора нелетучих молекулярных растворенных веществ. Для воды значение составляет -1,86 ° C / м . Таким образом, температура замерзания 1-моляльного водного раствора любого нелетучего молекулярного растворенного вещества составляет -1,86 ° C. Каждый растворитель имеет уникальную константу депрессии молярной точки замерзания. Они показаны ниже в таблице вместе с соответствующим значением точки кипения, называемым .
| Растворитель | Нормальная точка замерзания (° C) | Константа депрессии мольной точки замерзания, K f (° C / м ) | Нормальная температура кипения (° C) | Постоянная превышения мольной точки кипения, Кб (° C / м ) |
| Уксусная кислота | 16.6 | -3,90 | 117,9 | 3,07 |
| Камфора | 178,8 | -39,7 | 207,4 | 5,61 |
| Нафталин | 80,2 | -6,94 | 217,7 | 5,80 |
| Фенол | 40,9 | -7,40 | 181,8 | 3,60 |
| Вода | 0,00 | -1,86 | 100,00 | 0.512 |
Проблема с образцом: точка замерзания неэлектролита
Этиленгликоль (C 2 H 6 O 2 ) представляет собой молекулярное соединение, которое используется во многих коммерческих антифризах. Водный раствор этиленгликоля используется в радиаторах транспортных средств, чтобы снизить температуру замерзания и, таким образом, предотвратить замерзание воды в радиаторе. Рассчитайте температуру замерзания раствора 400 г этиленгликоля в 500 г воды.
Шаг 1. Составьте список известных количеств и спланируйте проблему.
Известный
- масса C 2 H 6 O 2 = 400. г
- молярная масса C 2 H 6 O 2 = 62,08 г / моль
- масса H 2 O = 500,0 г = 0,500 кг
Неизвестно
Это трехэтапная задача. Сначала рассчитайте количество молей этиленгликоля. Затем рассчитайте молярность раствора.Наконец, рассчитайте депрессию точки замерзания.
Шаг 2: Решить.
Нормальная температура замерзания воды составляет 0,0 ° C. Следовательно, поскольку точка замерзания снижается на 24,0 ° C, температура замерзания раствора составляет -24,0 ° C.
Шаг 3. Подумайте о своем результате.
Температура замерзания воды значительно снижается, защищая радиатор от повреждений из-за расширения воды при замерзании. В результате получается три значащих цифры.
Сводка
- Определено понижение точки замерзания.
- Описаны расчеты с понижением температуры замерзания.
Практика
Решите проблемы на сайте ниже:
http://home.comcast.net/~cochranjim/PDFS3/COLIGWS1A.pdf
Обзор
- Как растворенное вещество влияет на замерзание воды?
- Сколько молей глюкозы потребуется для понижения точки замерзания одного кг воды 3.72 ° С?
- Сколько молей NaCl потребуется, чтобы произвести такое же понижение температуры?
Глоссарий
- Депрессия точки замерзания: Разница температур между точкой замерзания чистого растворителя и температуры раствора.
- молярная константа депрессии точки замерзания: Константа, которая равна изменению точки замерзания для 1-моляльного раствора нелетучего молекулярного растворенного вещества.
Депрессия точки замерзания
Депрессия точки замерзания Депрессия точки замерзанияТемпература замерзания раствора ниже точки замерзания чистого растворителя. Это означает, что раствор необходимо охладить до температуры ниже, чем у чистого растворителя, чтобы произошло замерзание.
Температура замерзания растворителя в растворе изменяется по мере изменения концентрации растворенного вещества в растворе (но это не зависит от идентичности растворителя или частиц растворенного вещества (типа, размера или заряда) в растворе. ).
Нелетучие растворенные вещества
Температура замерзания растворителя в растворе будет ниже точки замерзания чистого растворителя, независимо от того, содержит ли раствор нелетучие растворенные вещества или летучие растворенные вещества. Однако для простоты здесь будут рассматриваться только нелетучие растворенные вещества.
Экспериментально известно, что изменение точки замерзания растворителя в растворе по сравнению с точкой замерзания чистого растворителя прямо пропорционально молярной концентрации растворенного вещества:
T = K f mгде:
T — изменение точки замерзания растворителя,
K b — молярная константа депрессии точки замерзания и
m — молярная концентрация растворенного вещества в растворе.
Обратите внимание, что молярная константа понижения точки замерзания, K f , имеет конкретное значение в зависимости от типа растворителя.
| растворитель | нормальная точка замерзания, o C | К b , o C м -1 |
| вода | 0,0 | 1,86 |
| уксусная кислота | 16.6 | 3,9 |
| бензол | 5,5 | 5,12 |
| хлороформ | -63,5 | 4,68 |
| нитробензол | 5,67 | 8,1 |
На следующем графике показана нормальная точка замерзания воды (растворителя) как функция моляльности в нескольких растворах, содержащих сахарозу (нелетучие растворенные вещества).Обратите внимание, что нормальная точка замерзания воды снижается с увеличением концентрации сахарозы.
Что вызывает более низкую точку замерзания?
Два вида изменений, химические и физические, могут повлиять на точку замерзания вещества. Вы можете снизить температуру замерзания некоторых жидкостей, добавив в них второе, растворимое вещество; именно так дорожная соль предотвращает повторное замерзание талой воды при низких температурах. Физический подход, изменение давления, также может снизить температуру замерзания жидкости; Он также может производить необычные твердые формы вещества, невидимые при нормальном атмосферном давлении.
TL; DR (слишком долго; не читал)
Антифриз снижает точку замерзания воды, сохраняя ее жидкую при низких температурах. И сахар, и соль тоже подойдут, хотя и в меньшей степени.
Когда молекулы замерзают
Электрические силы между молекулами определяют температуры, при которых вещество замерзает и закипает; чем сильнее силы, тем выше температура. Например, многие металлы связаны сильными силами; температура плавления железа составляет 1535 градусов по Цельсию (2797 градусов по Фаренгейту).Силы между молекулами воды значительно слабее; вода замерзает при нуле градусов Цельсия (32 градуса по Фаренгейту). Смеси растворителей и колебания давления уменьшают силы между молекулами, понижая температуру замерзания жидкостей.
Смешивание
Смешивая одну жидкость с другим совместимым веществом, вы понижаете точку замерзания жидкости. Вещества должны быть совместимы, чтобы гарантировать полное смешивание; например, масло и вода разделяются и не изменяют температуру замерзания.Смесь поваренной соли и воды имеет более низкую температуру замерзания, как и водно-спиртовая смесь. Химики могут предсказать разницу температур точки замерзания, применив формулу, которая учитывает количество вещества и константу, связанную со вторым веществом. Например, если вы рассчитываете для воды и хлорида натрия и результат равен -2, это означает, что точка замерзания смеси на 2 градуса Цельсия (3,6 градуса F) ниже, чем для чистой воды.
Снятие давления
Изменения давления могут повысить или понизить точку замерзания вещества.Обычно давление ниже 1 атмосферы ниже температуры замерзания вещества, но для воды более высокое давление дает более низкую точку замерзания. Сила изменения давления входит в молекулярные силы, уже действующие в веществе. Для воды при низком давлении пар напрямую превращается в лед, не превращаясь в жидкость.
Amazing Hot Ice
Вода состоит из нескольких твердых фаз, каждая из которых наблюдается при разном давлении. Стандартный лед, который ученые называют «Лед I», существует при атмосферном давлении и имеет характерную гексагональную кристаллическую структуру.При температуре ниже минус 80 градусов Цельсия (минус 112 градусов по Фаренгейту) кубические кристаллы льда могут образовываться из пара при давлении в 1 атмосферу. При высоких давлениях образуются экзотические виды льда; ученые идентифицируют их как от льда II до льда XV. Эти формы льда могут оставаться твердыми при температуре, превышающей 100 градусов по Цельсию (212 градусов по Фаренгейту) — точка кипения воды при давлении в 1 атмосферу.
11.4 Коллигативные свойства — химия
Цели обучения
К концу этого раздела вы сможете:
- Выразите концентрации компонентов раствора с помощью мольной доли и моляльности
- Опишите влияние концентрации растворенного вещества на различные свойства раствора (давление пара, точку кипения, точку замерзания и осмотическое давление)
- Выполнение расчетов с использованием математических уравнений, описывающих эти различные коллигативные эффекты
- Опишите процесс дистилляции и его практическое применение
- Объясните процесс осмоса и опишите, как он применяется в промышленности и в природе
Свойства раствора отличаются от свойств чистых растворенных веществ или растворителей.Многие свойства раствора зависят от химической идентичности растворенного вещества. По сравнению с чистой водой раствор хлороводорода более кислый, раствор аммиака более щелочной, раствор хлорида натрия более плотный, раствор сахарозы более вязкий. Однако есть несколько свойств раствора, которые зависят только только от общей концентрации растворенных веществ, независимо от их идентичности. Эти объединяющие свойства включают снижение давления пара, повышение точки кипения, снижение точки замерзания и осмотическое давление.Этот небольшой набор свойств имеет центральное значение для многих природных явлений и технологических приложений, как будет описано в этом модуле.
Несколько единиц, обычно используемых для выражения концентраций компонентов раствора, были представлены в предыдущей главе этого текста, каждая из которых обеспечивает определенные преимущества для использования в различных приложениях. Например, молярность ( M ) является удобной единицей для использования в стехиометрических расчетах, поскольку она определяется в терминах молярных количеств растворенных веществ:
[латекс] M = \ frac {\ text {mol \; solute}} {\ text {L \; solution}} [/ latex]
Поскольку объемы раствора меняются в зависимости от температуры, молярные концентрации также изменяются.При выражении в виде молярности концентрация раствора с одинаковым количеством растворенных веществ и разновидностей растворителя будет различной при разных температурах из-за сжатия / расширения раствора. Для расчетов, включающих многие коллигативные свойства, более подходящими являются мольные единицы концентрации, значения которых не зависят от температуры. Двумя такими единицами являются молярная доля (введенная в предыдущей главе о газах) и молярность .
Мольная доля компонента X представляет собой отношение его молярного количества к общему количеству молей всех компонентов раствора:
[латекс] X _ {\ text {A}} = \ frac {\ text {mol \; A}} {\ text {total \; mol \; of \; all \; components}} [/ latex]
Моляльность — единица концентрации, определяемая как отношение количества молей растворенного вещества к массе растворителя в килограммах:
[латекс] m = \ frac {\ text {mol \; solute}} {\ text {kg \; растворитель}} [/ латекс]
Поскольку эти единицы вычисляются с использованием только массы и молярных количеств, они не меняются с температурой и, таким образом, лучше подходят для приложений, требующих не зависящих от температуры концентраций, включая несколько коллигативных свойств, как будет описано в модуле этой главы.
Пример 1
Расчет мольной доли и моляльности
Антифриз в большинстве автомобильных радиаторов представляет собой смесь равных объемов этиленгликоля и воды с небольшими количествами других присадок, предотвращающих коррозию. Каковы (а) мольная доля и (б) молярность этиленгликоля, C 2 H 4 (OH) 2 , в растворе, приготовленном из 2,22 × 10 3 г этилена гликоль и 2,00 × 10 3 г воды (примерно 2 л гликоля и 2 л воды)?
Раствор
(a) Мольную долю этиленгликоля можно вычислить, сначала вычислив молярные количества обоих компонентов раствора, а затем подставив эти количества в определение единицы.
[латекс] \ text {mol \; C} _2 \ text {H} _4 (\ text {OH}) _ 2 = 2220 \; \ text {g} \; \ times \; \ frac {1 \; \ text {mol \; C} _2 \ text {H} _4 (\ text {OH}) _ 2} {62.07 \; \ text {g \; C} _2 \ text {H} _4 (\ text {OH}) _ 2} = 35,8 \; \ text {mol \; C} _2 \ text {H} _4 (\ text {OH}) _ 2 [/ latex]
[латекс] \ text {mol \; H} _2 \ text {O} = 2000 \; \ text {g} \; \ times \; \ frac {1 \; \ text {mol \; H} _2 \ text {O}} {18.02 \; \ text {g \; H} _2 \ text {O}} = 11.1 \; \ text {mol \; H} _2 \ text {O} [/ latex]
[латекс] X _ {\ text {этилен \; гликоль}} = \ frac {35.8 \; \ text {mol \; C} _2 \ text {H} _4 (\ text {OH}) _ 2} {(35.8 \; + \; 11.1) \; \ text {mol \; total}} = 0,763 [/ латекс]
Обратите внимание, что мольная доля — это безразмерное свойство, представляющее собой соотношение свойств с идентичными единицами (молями).
(b) Чтобы определить моляльность, нам нужно знать количество молей растворенного вещества и массу растворителя (в кг).
Сначала используйте данную массу этиленгликоля и его молярную массу, чтобы найти моль растворенного вещества:
[латекс] 2220 \; \ text {g \; C} _2 \ text {H} _4 (\ text {OH}) _ 2 \; (\ frac {\ text {mol \; C} _2 \ text {H} _2 (\ text {OH}) _ 2} {62.07 \; \ text {g}}) = 35.8 \; \ text {mol \; C} _2 \ text {H} _4 (\ text {OH}) _ 2 [/ latex]
Затем переведем массу воды из граммов в килограммы:
[латекс] 2000 \; \ text {g \; H} _2 \ text {O} \; (\ frac {1 \; \ text {kg}} {1000 \; \ text {g}}) = 2 \ ; \ text {kg \; H} _2 \ text {O} [/ latex]
Наконец, рассчитайте молярность по ее определению:
[латекс] \ begin {array} {r @ {{} = {}} l} \ text {molality} & \ frac {\ text {mol \; solute}} {\ text {kg \; Solute}} \ \ [1em] \ text {molality} & \ frac {35.8 \; \ text {mol \; C} _2 \ text {H} _4 (\ text {OH}) _ 2} {2 \; \ text {kg \; H} _2 \ text {O}} \\ [1em] \ text {molality} & 17.9 \; m \ end {array} [/ latex]
Проверьте свои знания
Каковы молярная доля и моляльность раствора, содержащего 0,850 г аммиака, NH 3 , растворенного в 125 г воды?
Ответ:
7,14 × 10 −3 ; 0,399 м
Пример 2
Преобразование мольной доли и молярных концентраций
Рассчитайте мольную долю растворенного вещества и растворителя в 3,0 м растворе хлорида натрия .
Решение
Преобразование одной единицы концентрации в другую выполняется путем сравнения двух определений единиц. В этом случае обе единицы имеют один и тот же числитель (моль растворенного вещества), но разные знаменатели. Указанная молярная концентрация может быть записана как:
[латекс] \ frac {3.0 \; \ text {mol \; NaCl}} {1.0 \; \ text {kg \; H} _2 \ text {O}} [/ латекс]
Числитель мольной доли этого раствора, следовательно, равен 3,0 моль NaCl. Знаменатель можно вычислить, вычислив молярное количество воды, соответствующее 1.0 кг
[латекс] 1.0 \; \ text {kg \; H} _2 \ text {O} \; (\ frac {1000 \; \ text {g}} {1 \; \ text {kg}}) (\ frac {\ text {mol \; H} _2 \ text {O}} {18.02 \; \ text {g}}) = 55 \; \ text {mol \; H} _2 \ text {O} [/ latex]
, а затем подставив эти молярные количества в определение мольной доли.
[латекс] \ begin {array} {r @ {{} = {}} l} X _ {\ text {H} _2 \ text {O}} & \ frac {\ text {mol \; H} _2 \ text {O}} {\ text {mol \; NaCl} \; + \; \ text {mol \; H} _2 \ text {O}} \\ [0.75em] X _ {\ text {H} _2 \ text { O}} & \ frac {55 \; \ text {mol \; H} _2 \ text {O}} {3.0 \; \ text {mol \; NaCl} \; + \; 55 \; \ text {mol \; H} _2 \ text {O}} \\ [0.75em] X _ {\ text {H} _2 \ text {O}} & 0.95 \\ [0.75em] X _ {\ text {NaCl}} & \ frac {\ text {mol \; NaCl}} {\ text {mol \; NaCl} \; + \; \ text { моль \; H} _2 \ text {O}} \\ [0,75em] X _ {\ text {NaCl}} & \ frac {3.0 \; \ text {mol \; NaCl}} {3.0 \; \ text {mol \; NaCl} \; + \; 55 \; \ text {mol \; H} _2 \ text {O}} \\ [0.75em] X _ {\ text {NaCl}} & 0.052 \ end {array} [/ латекс]
Проверьте свои знания
Мольная доля йода, I 2 , растворенного в дихлорметане, CH 2 Cl 2 , равна 0.115. Какова молярная концентрация йода в этом растворе, m ?
Как описано в главе, посвященной жидкостям и твердым телам, равновесное давление пара жидкости — это давление, оказываемое ее газовой фазой, когда испарение и конденсация происходят с равными скоростями:
[латекс] \ text {жидкость} \; {\ leftrightharpoons} \; \ text {gas} [/ latex]
Растворение нелетучего вещества в летучей жидкости приводит к снижению давления паров жидкости.Это явление можно объяснить, рассмотрев влияние добавленных молекул растворенного вещества на процессы испарения и конденсации жидкости. Для испарения молекулы растворителя должны присутствовать на поверхности раствора. Присутствие растворенного вещества уменьшает площадь поверхности, доступную для молекул растворителя, и тем самым снижает скорость испарения растворителя. Поскольку на скорость конденсации не влияет присутствие растворенного вещества, конечный результат состоит в том, что равновесие испарения-конденсации достигается с меньшим количеством молекул растворителя в паровой фазе (т.е.е., при более низком давлении пара) (рисунок 1). Хотя такая кинетическая интерпретация полезна, она не учитывает несколько важных аспектов коллигативной природы понижения давления пара. Более строгое объяснение включает свойство энтропии , которое будет обсуждаться в более поздней главе по термодинамике. Для понимания снижения давления паров жидкости достаточно отметить, что большая энтропия раствора по сравнению с его отдельным растворителем и растворенным веществом служит для эффективной стабилизации молекул растворителя и препятствования их испарению.В результате получается более низкое давление пара и, соответственно, более высокая температура кипения, как описано в следующем разделе этого модуля. {\ circ} [/ latex]
Сначала вычислите молярные количества каждого компонента раствора, используя предоставленные данные о массе.
[латекс] 92,1 \; \ rule [0.5ex] {5.5em} {0.1ex} \ hspace {-5.5em} \ text {g \; C} _3 \ text {H} _5 (\ text {OH}) _ 3 \; \ times \; \ frac {1 \; \ text {mol \; C} _3 \ text {H} _5 (\ text {OH}) _ 3} {92.094 \; \ rule [0.25ex] {4.25em} {0.1ex} \ hspace {-4.25em} \ text {g \; C} _3 \ text {H} _5 (\ text {OH}) _ 3} = 1.00 \; \ текст {мол \; C} _3 \ текст {H} _5 (\ text {OH}) _ 3 [/ латекс]
[латекс] 184,4 \; \ rule [0.5ex] {5em} {0.1ex} \ hspace {-5em} \ text {g \; C} _2 \ text {H} _5 \ text {OH} \; \ times \; \ frac {1 \ ; \ text {mol \; C} _2 \ text {H} _5 \ text {OH}} {46.069 \; \ rule [0.25ex] {3.75em} {0.1ex} \ hspace {-3.{\ circ} = 0,800 \; \ times \; 0,178 \; \ text {atm} = 0,142 \; \ text {atm} [/ latex]
Проверьте свои знания
Раствор содержит 5,00 г мочевины, CO (NH 2 ) 2 (нелетучее растворенное вещество) и 0,100 кг воды. Если давление пара чистой воды при 25 ° C составляет 23,7 торр, каково давление пара раствора?
Как описано в главе о жидкостях и твердых телах, точка кипения жидкости — это температура, при которой давление ее пара равно атмосферному давлению окружающей среды.Поскольку давление пара раствора понижается из-за присутствия нелетучих растворенных веществ, естественно, что температура кипения раствора впоследствии будет повышена. По сравнению с чистым растворителем, раствор, следовательно, требует более высокой температуры для достижения любого заданного давления пара, в том числе одного эквивалента давления пара в окружающей атмосфере. Повышение температуры кипения, наблюдаемое при растворении нелетучих растворенных веществ в растворителе, Δ T b , называется повышением точки кипения и прямо пропорционально молярной концентрации растворенных веществ:
[латекс] {\ Delta} T _ {\ text {b}} = K _ {\ text {b}} m [/ latex]
, где K b — константа повышения точки кипения или эбуллиоскопическая константа и m — молярная концентрация (моляльность) всех растворенных веществ.
Константы повышения точки кипения — это характерные свойства, которые зависят от типа растворителя. Значения K b для нескольких растворителей приведены в таблице 2.
| Растворитель | Точка кипения (° C при 1 атм) | K b (C м -1 ) | Температура замерзания (° C при 1 атм.) | K f (C м -1 ) |
|---|---|---|---|---|
| вода | 100.0 | 0,512 | 0,0 | 1,86 |
| ацетат водорода | 118,1 | 3,07 | 16,6 | 3,9 |
| бензол | 80,1 | 2,53 | 5,5 | 5,12 |
| хлороформ | 61,26 | 3,63 | −63,5 | 4,68 |
| нитробензол | 210,9 | 5,24 | 5.67 | 8,1 |
| Таблица 2. Константы повышения точки кипения и депрессии точки замерзания для нескольких растворителей | ||||
Степень снижения давления пара растворителя и повышения температуры кипения зависит от общего количества растворенных частиц, присутствующих в данном количестве растворителя, а не от массы, размера или химической идентичности частиц. . Водный раствор сахарозы 1 m (342 г / моль) и водный раствор этиленгликоля 1 m (62 г / моль) будут иметь одинаковую температуру кипения, потому что каждый раствор имеет один моль растворенных частиц (молекул) на килограмм растворителя.{\ circ} \ text {C} [/ latex]
Проверьте свои знания
Какова точка кипения антифриза, описанного в примере 1?
Пример 5
Точка кипения раствора йода
Найдите точку кипения раствора 92,1 г йода, I 2 , в 800,0 г хлороформа, CHCl 3 , предполагая, что йод нелетучий и что раствор идеально.
Решение
Эту проблему можно решить за четыре шага.
- Преобразуйте из граммов в моль I 2 , используя молярную массу I 2 в качестве коэффициента преобразования единиц.
Результат: 0,363 моль - Определите молярность раствора по количеству молей растворенного вещества и массе растворителя в килограммах.
Результат: 0,454 м - Используйте прямую пропорциональность между изменением точки кипения и молярной концентрацией, чтобы определить, насколько сильно изменяется точка кипения.
Результат: 1,65 ° C - Определите новую точку кипения, исходя из точки кипения чистого растворителя и изменения.
Результат: 62,91 ° C
Проверяйте каждый результат в качестве самооценки.
Проверьте свои знания
Какова точка кипения раствора 1,0 г глицерина, C 3 H 5 (OH) 3 , в 47,8 г воды? Предположим идеальное решение.
Дистилляция — это метод разделения компонентов смесей, который широко применяется как в лабораторных, так и в промышленных условиях.Он используется для очистки нефти, выделения продуктов брожения и очистки воды. Этот метод разделения включает контролируемый нагрев смеси образцов для выборочного испарения, конденсации и сбора одного или нескольких представляющих интерес компонентов. Типичное устройство для лабораторной перегонки показано на рисунке 2.
Рис. 2. Типичная лабораторная установка для дистилляции показана на (а) фотографии и (б) схематической диаграмме компонентов. (кредит a: модификация работы «Rifleman82» / Wikimedia Commons; кредит b: модификация работы «Slashme» / Wikimedia Commons)Нефтеперерабатывающие заводы используют крупномасштабную фракционную перегонку для разделения компонентов сырой нефти.Сырая нефть нагревается до высоких температур в основании высокой ректификационной колонны , испаряя многие компоненты, которые поднимаются внутри колонны. Когда испаренные компоненты достигают достаточно прохладных зон во время подъема, они конденсируются и собираются. Собранные жидкости представляют собой более простые смеси углеводородов и других нефтяных соединений, которые имеют соответствующий состав для различных применений (например, дизельное топливо, керосин, бензин), как показано на Рисунке 3.
Рисунок 3. Сырая нефть представляет собой сложную смесь, которую разделяют крупномасштабной фракционной перегонкой для выделения различных более простых смесей.Растворы замерзают при более низких температурах, чем чистые жидкости. Это явление используется в схемах «антиобледенения», в которых используется соль (рис. 4), хлорид кальция или мочевина для таяния льда на дорогах и тротуарах, а также при использовании этиленгликоля в качестве «антифриза» в автомобильных радиаторах. Морская вода замерзает при более низкой температуре, чем пресная вода, поэтому Северный Ледовитый и Антарктический океаны остаются незамерзшими даже при температурах ниже 0 ° C (как и жидкости организма рыб и других хладнокровных морских животных, обитающих в этих океанах).
Рис. 4. Каменная соль (NaCl), хлорид кальция (CaCl 2 ) или их смесь используются для таяния льда. (кредит: модификация работы Эдди Велкера)Уменьшение точки замерзания разбавленного раствора по сравнению с точкой замерзания чистого растворителя, Δ T f , называется депрессией точки замерзания и прямо пропорционально молярная концентрация растворенного вещества
[латекс] {\ Delta} T _ {\ text {f}} = K _ {\ text {f}} m [/ latex]
, где m — молярная концентрация растворенного вещества в растворителе, а K f называется константой депрессии точки замерзания (или криоскопической константой ).Как и для констант повышения температуры кипения, это характерные свойства, значения которых зависят от химической идентичности растворителя. Значения K f для нескольких растворителей приведены в таблице 2.
Пример 6
Расчет температуры замерзания раствора
Какова точка замерзания 0,33 м раствора нелетучего неэлектролита в бензоле, описанного в примере 2?
Решение
Используйте уравнение, связывающее депрессию точки замерзания с моляльностью растворенного вещества, чтобы решить эту проблему в два этапа.{\ circ} \ text {C} [/ latex]
Проверьте свои знания
Какова точка замерзания 1,85 м раствора нелетучего неэлектролита в нитробензоле?
Коллигативные свойства и удаление обледенения
Хлорид натрия и его аналоги группы 2 Хлорид кальция и магния часто используется для удаления льда с проезжей части и тротуаров, так как раствор любой из этих солей имеет точку замерзания ниже 0 ° C, точку замерзания. чистой воды.Соли металлов группы 2 часто смешивают с более дешевым и более доступным хлоридом натрия («каменной солью») для использования на дорогах, поскольку они, как правило, несколько менее агрессивны, чем NaCl, и обеспечивают большее понижение точки замерзания. , поскольку они диссоциируют с образованием трех частиц на формульную единицу, а не двух частиц, таких как хлорид натрия.
Поскольку эти ионные соединения имеют тенденцию ускорять коррозию металла, их нельзя использовать в составе антифриза для радиатора вашего автомобиля или для удаления льда с самолета перед взлетом.Для этих целей часто используются ковалентные соединения, такие как этилен или пропиленгликоль. Гликоли, используемые в радиаторной жидкости, не только понижают точку замерзания жидкости, но и повышают температуру кипения, что делает жидкость полезной как зимой, так и летом. Нагретые гликоли часто разбрызгиваются на поверхность самолетов перед взлетом в ненастную погоду зимой, чтобы удалить уже образовавшийся лед и предотвратить образование большего количества льда, что было бы особенно опасно, если бы оно образовалось на управляющих поверхностях самолета (Рис. 5).
Рис. 5. Понижение точки замерзания используется для удаления льда с (а) проезжей части и (б) поверхностей управления самолета.Коллигативное влияние на давление пара, точку кипения и точку замерзания, описанное в предыдущем разделе, удобно суммировать путем сравнения фазовых диаграмм для чистой жидкости и раствора, полученного из этой жидкости. Фазовые диаграммы для воды и водного раствора показаны на рисунке 6.
Рис. 6. На этих диаграммах состояния показаны вода (сплошные кривые) и водный раствор неэлектролита (штриховые кривые).Кривая жидкость-пар для раствора расположена на ниже соответствующей кривой для растворителя, изображая снижение давления паров на , Δ P , которое возникает в результате растворения нелетучих растворенных веществ. Следовательно, при любом данном давлении точка кипения раствора наблюдается при более высокой температуре, чем у чистого растворителя, что отражает повышение точки кипения Δ T b , связанное с присутствием нелетучих растворенных веществ.Кривая твердое тело-жидкость для раствора смещена влево от кривой для чистого растворителя, что соответствует понижению температуры замерзания Δ T b , которое сопровождает образование раствора. Наконец, обратите внимание, что кривые твердое тело-газ для растворителя и его раствора идентичны. Так обстоит дело со многими растворами, содержащими жидкие растворители и нелетучие растворенные вещества. Так же, как и в случае испарения, когда раствор такого типа замораживается, фактически только молекул растворителя претерпевают переход из жидкого состояния в твердое, образуя чистый твердый растворитель, который исключает растворенные вещества.Следовательно, твердая и газовая фазы состоят только из растворителя, и поэтому переходы между этими фазами не подвержены коллигативным эффектам.
Ряд природных и синтетических материалов демонстрируют селективную проницаемость , что означает, что только молекулы или ионы определенного размера, формы, полярности, заряда и т. Д. Способны проходить (проникать) через материал. Мембраны биологических клеток представляют собой элегантные примеры избирательного проникновения в природе, в то время как диализные трубки, используемые для удаления метаболических отходов из крови, являются более упрощенным технологическим примером.Независимо от того, как они могут быть изготовлены, эти материалы обычно называют полупроницаемыми мембранами .
Рассмотрим устройство, показанное на рисунке 7, в котором образцы чистого растворителя и раствора разделены мембраной, через которую могут проникать только молекулы растворителя. Молекулы растворителя будут диффундировать через мембрану в обоих направлениях. Поскольку концентрация растворителя больше в чистом растворителе, чем в растворе, эти молекулы будут диффундировать со стороны растворителя мембраны в сторону раствора с большей скоростью, чем в обратном направлении.Результатом является чистый перенос молекул растворителя из чистого растворителя в раствор. Перенос молекул растворителя через полупроницаемую мембрану за счет диффузии — это процесс, известный как осмос .
Рис. 7. Осмос приводит к переносу молекул растворителя из образца с низкой (или нулевой) концентрацией растворенного вещества в образец с более высокой концентрацией растворенного вещества.Когда осмос выполняется в аппарате, подобном показанному на Рисунке 7, объем раствора увеличивается по мере того, как он становится разбавленным из-за накопления растворителя.Это вызывает повышение уровня раствора, увеличение его гидростатического давления (из-за веса столба раствора в трубке), что приводит к более быстрому переносу молекул растворителя обратно на сторону чистого растворителя. Когда давление достигает значения, обеспечивающего скорость обратного переноса растворителя, равную скорости осмоса, объемный перенос растворителя прекращается. Это давление называется осмотическим давлением ( Π ) раствора. Осмотическое давление разбавленного раствора связано с молярностью растворенного вещества M и абсолютной температурой T в соответствии с уравнением
.[латекс] \ it {{\ Pi}} = MRT [/ латекс]
, где R — универсальная газовая постоянная.
Пример 7
Расчет осмотического давления
Каково осмотическое давление (атм) 0,30 M раствора глюкозы в воде, используемого для внутривенной инфузии при температуре тела 37 ° C?
Раствор
Мы можем найти осмотическое давление , используя формулу Π = MRT , где T находится по шкале Кельвина (310 K), а значение R выражается в соответствующие единицы (0.08206 л атм / моль К).
[латекс] \ begin {array} {r @ {{} = {}} l} \ it {{\ Pi}} & MRT \\ [0.5em] & 0.03 \; \ text {mol / L} \; \ times \; 0.08206 \; \ text {L \; atm / mol \; K} \; \ times \; 310 \; \ text {K} \\ [0.5em] & 7.6 \; \ text {atm} \ конец {array} [/ latex]
Проверьте свои знания
Какое осмотическое давление (атм) у раствора объемом 0,750 л, содержащего 5,0 г метанола, CH 3 OH, в воде при 37 ° C?
Если раствор помещается в устройство, подобное показанному на рисунке 8, приложение давления, превышающего осмотическое давление раствора, меняет осмос и выталкивает молекулы растворителя из раствора в чистый растворитель.Этот метод обратного осмоса используется для крупномасштабного опреснения морской воды и в меньших масштабах для производства водопроводной воды высокой чистоты для питья.
Рис. 8. Приложение давления, превышающего осмотическое давление раствора, приведет к обратному осмосу. Молекулы растворителя из раствора выталкиваются в чистый растворитель.Очистка воды обратным осмосом
В процессе осмоса диффузия служит для перемещения воды через полупроницаемую мембрану из менее концентрированного раствора в более концентрированный раствор.Осмотическое давление — это давление, которое необходимо приложить к более концентрированному раствору, чтобы остановить осмос. Если приложить большее давление, вода перейдет из более концентрированного раствора в менее концентрированный (более чистый) раствор. Это называется обратным осмосом. Обратный осмос (RO) используется для очистки воды во многих сферах, от опреснительных установок в прибрежных городах до водоочистных машин в продуктовых магазинах (рис. 9) и небольших бытовых установок с обратным осмосом.Небольшие установки обратного осмоса с ручным насосом могут использоваться в странах третьего мира, в районах бедствий и в спасательных шлюпках. В наших вооруженных силах есть множество установок обратного осмоса с приводом от генератора, которые можно перевозить на автомобилях в отдаленные места.
Рисунок 9. Системы обратного осмоса для очистки питьевой воды показаны здесь в (а) малом и (б) большом масштабе. (кредит а: модификация работы Джерри Киркхарта; кредит б: модификация работы Уилларда Дж. Латропа)Примеры осмоса очевидны во многих биологических системах, потому что клетки окружены полупроницаемыми мембранами.Морковь и сельдерей, которые стали мягкими из-за потери воды, можно снова сделать хрустящими, поместив их в воду. Вода попадает в клетки моркови или сельдерея путем осмоса. Огурец, помещенный в концентрированный солевой раствор, теряет воду в результате осмоса и впитывает немного соли, превращаясь в рассол. Осмос также может влиять на клетки животных. Концентрации растворенных веществ особенно важны, когда растворы вводятся в организм. Растворы в жидкостях клеток организма и сыворотке крови придают этим растворам осмотическое давление примерно 7.7 атм. Растворы, вводимые в организм, должны иметь такое же осмотическое давление, как и сыворотка крови; то есть они должны быть изотоничны, с сывороткой крови. Если менее концентрированный раствор, гипотонический раствор , вводится в количестве, достаточном для разбавления сыворотки крови, вода из разбавленной сыворотки попадает в клетки крови путем осмоса, вызывая расширение и разрыв клеток. Этот процесс называется гемолизом . Когда вводится более концентрированный раствор, гипертонический раствор , клетки теряют воду из-за более концентрированного раствора, сморщиваются и, возможно, погибают в процессе, называемом зубчатой линией .Эти эффекты показаны на Рисунке 10.
Рис. 10. Мембраны эритроцитов проницаемы для воды и будут (а) набухать и, возможно, разрываться в гипотоническом растворе; (б) поддерживать нормальный объем и форму в изотоническом растворе; и (c) сморщиться и, возможно, умереть в гипертоническом растворе. (кредит a / b / c: модификации работы «LadyofHats» / Wikimedia Commons)Осмотическое давление и изменения точки замерзания, точки кипения и давления пара прямо пропорциональны концентрации присутствующего растворенного вещества.Следовательно, мы можем использовать измерение одного из этих свойств для определения молярной массы растворенного вещества по результатам измерений.
Пример 8
Определение молярной массы по понижению температуры замерзания
Обнаружено, что раствор 4,00 г неэлектролита, растворенный в 55,0 г бензола, замерзает при 2,32 ° C. Какова молярная масса этого соединения?
Решение
Эту проблему можно решить, выполнив следующие действия.
- Определите изменение точки замерзания от наблюдаемой точки замерзания и точки замерзания чистого бензола (Таблица 2).{-1}} = 0,63 м [/ латекс]
- Определите количество молей соединения в растворе по молярной концентрации и массе растворителя, использованного для приготовления раствора.
[латекс] \ text {Moles \; of \; solute} = \ frac {0,62 \; \ text {mol \; solute}} {1,00 \; \ rule [0.25ex] {3.5em} {0.1ex} \ hspace {-3.5em} \ text {кг \; растворитель}} \; \ times \; 0,0550 \; \ rule [0.5ex] {4.4em} {0.1ex} \ hspace {-4.4em} \ text {кг \; растворитель} = 0,035 \; \ text {mol} [/ latex]
- Определите молярную массу из массы растворенного вещества и количества молей в этой массе.2 \; \ text {г / моль} [/ латекс]
Проверьте свои знания
Раствор 35,7 г неэлектролита в 220,0 г хлороформа имеет точку кипения 64,5 ° C. Какова молярная масса этого соединения?
Пример 9
Определение молярной массы по осмотическому давлению
Образец водного раствора объемом 0,500 л, содержащий 10,0 г гемоглобина, имеет осмотическое давление 5,9 торр при 22 ° C. Какая молярная масса гемоглобина?
Решение
Вот один набор шагов, которые можно использовать для решения проблемы:
- Преобразуйте осмотическое давление в атмосферы, затем определите молярную концентрацию по осмотическому давлению.4 \; \ text {г / моль} [/ латекс]
Проверьте свои знания
Какова молярная масса белка, если раствор 0,02 г белка в 25,0 мл раствора имеет осмотическое давление 0,56 торр при 25 ° C?
Как отмечалось ранее в этом модуле, коллигативные свойства раствора зависят только от количества, а не от вида растворенных веществ. Например, 1 моль любого неэлектролита, растворенного в 1 килограмме растворителя, вызывает такое же снижение точки замерзания, как и 1 моль любого другого неэлектролита.Однако 1 моль хлорида натрия (электролита) образует 2 моля ионов при растворении в растворе. Каждый отдельный ион оказывает такое же влияние на точку замерзания, как и отдельная молекула.
Пример 10
Точка замерзания раствора электролита
Концентрация ионов в морской воде примерно такая же, как в растворе, содержащем 4,2 г NaCl, растворенного в 125 г воды. Предположим, что каждый из ионов в растворе NaCl оказывает такое же влияние на точку замерзания воды, что и молекула неэлектролита, и определим температуру замерзания раствора (которая примерно равна температуре замерзания морской воды).
Решение
Эту проблему можно решить, выполнив следующие действия.
- Преобразуйте граммы в моль NaCl, используя молярную массу NaCl в коэффициенте преобразования единиц.
Результат: 0,072 моль NaCl - Определите количество молей ионов, присутствующих в растворе, используя количество молей ионов в 1 моль NaCl в качестве коэффициента пересчета (2 моль ионов / 1 моль NaCl).
Результат: 0,14 моль ионов - Определите молярность ионов в растворе по количеству молей ионов и массе растворителя в килограммах.
Результат: 1.1 м - Используйте прямую пропорциональность между изменением точки замерзания и моляльной концентрацией, чтобы определить, насколько изменяется точка замерзания.
Результат: 2,0 ° C - Определите новую точку замерзания, исходя из точки замерзания чистого растворителя и изменения.
Результат: −2,0 ° C
Проверяйте каждый результат в качестве самооценки.
Проверьте свои знания
Предположим, что каждый из ионов хлорида кальция, CaCl 2 , оказывает такое же влияние на точку замерзания воды, как и молекула неэлектролита.{\ circ} \ text {C} [/ латекс].
Однако, когда этот раствор фактически приготовлен и измерено снижение его точки замерзания, получается значение 3,4 ° C. Подобные расхождения наблюдаются для других ионных соединений, и различия между измеренными и ожидаемыми значениями коллигативных свойств обычно становятся более значительными по мере увеличения концентрации растворенных веществ. Эти наблюдения предполагают, что ионы хлорида натрия (и других сильных электролитов) полностью не диссоциируют в растворе.
Чтобы учесть это и избежать ошибок, связанных с предположением о полной диссоциации, используется экспериментально измеренный параметр, названный в честь лауреата Нобелевской премии немецкого химика Якобуса Хенрикуса ван’т Хоффа. Фактор Вант-Гоффа ( i ) определяется как отношение частиц растворенного вещества в растворе к количеству растворенных формульных единиц:
[латекс] i = \ frac {\ text {моль \; \; частицы \; в \; растворе}} {\ text {моль \; \; формула \; единицы \; растворенный}} [/ латекс]
Значения измеренных факторов Вант-Гоффа для нескольких растворенных веществ, наряду с прогнозируемыми значениями, предполагающими полную диссоциацию, показаны в таблице 3.
| Электролит | Частицы в растворе | i (прогноз) | i (Измерено) |
|---|---|---|---|
| HCl | H + , класс — | 2 | 1,9 |
| NaCl | Na + , Класс — | 2 | 1,9 |
| MgSO 4 | мг 2+ , SO 4 2- | 2 | 1.3 |
| MgCl 2 | мг 2+ , 2Cl — | 3 | 2,7 |
| FeCl 3 | Fe 3+ , 3Cl — | 4 | 3,4 |
| глюкоза | С 12 В 22 О 11 | 1 | 1,0 |
| Таблица 3. Ожидаемые и наблюдаемые факторы Вант-Гоффа для нескольких 0.050 m Водные растворы электролитов | |||
В 1923 году химики Питер Дебай и Эрих Хюккель предложили теорию, объясняющую очевидную неполную ионизацию сильных электролитов. Они предположили, что, хотя межионное притяжение в водном растворе очень сильно снижается за счет сольватации ионов и изолирующего действия полярного растворителя, оно не сводится на нет полностью. Остаточное притяжение препятствует тому, чтобы ионы вели себя как полностью независимые частицы (рис. 11).В некоторых случаях положительный и отрицательный ион могут действительно соприкасаться, образуя сольватированную единицу, называемую ионной парой. Таким образом, активность или эффективная концентрация любого конкретного вида иона меньше, чем указанная фактическая концентрация. Чем больше разбавлен раствор, тем больше разделяются ионы, и остаточное межионное притяжение становится все меньше и меньше. Таким образом, в чрезвычайно разбавленных растворах эффективные концентрации ионов (их активности) практически равны фактическим концентрациям.Обратите внимание, что коэффициенты Ван’т-Гоффа для электролитов в таблице 3 приведены для 0,05 м растворов, при которых значение концентрации i для NaCl составляет 1,9, в отличие от идеального значения 2,
. Рис. 11. Чем больше разбавляется раствор, тем больше разделяются ионы, и остаточное межионное притяжение становится меньше.Свойства раствора, зависящие только от концентрации растворенных частиц, называются коллигативными свойствами. Они включают изменения давления пара, точки кипения и точки замерзания растворителя в растворе.Величина этих свойств зависит только от общей концентрации растворенных частиц в растворе, а не от типа частиц. Общая концентрация частиц растворенного вещества в растворе также определяет его осмотическое давление. Это давление, которое необходимо приложить к раствору, чтобы предотвратить диффузию молекул чистого растворителя через полупроницаемую мембрану в раствор. Ионные соединения могут не полностью диссоциировать в растворе из-за эффектов активности, и в этом случае наблюдаемые коллигативные эффекты могут быть меньше прогнозируемых.{\ circ} [/ латекс]
Химия: упражнения в конце главы
- Которая является / являются частью макроскопической области растворов и которая является / являются частью микроскопической области: повышение точки кипения, закон Генри, водородная связь, ионно-дипольное притяжение, молярность, неэлектролит, нестехиометрическое соединение, осмос, сольватированный ион ?
- Какое микроскопическое объяснение макроскопического поведения показано на рисунке 7 в главе 11?3 Растворимость?
- Изобразите качественный график зависимости давления от времени для водяного пара над образцом чистой воды и раствора сахара, когда жидкости испаряются до половины своего первоначального объема.
- Раствор нитрата калия, электролита и раствора глицерина (C 3 H 5 (OH) 3 ), неэлектролита, оба кипятят при 100,3 ° C. Какие еще физические свойства двух растворов идентичны?
- Каковы мольные доли H 3 PO 4 и воды в растворе 14.5 г H 3 PO 4 в 125 г воды?
(a) Опишите шаги, необходимые для ответа на вопрос.
(b) Ответьте на вопрос.
- Каковы мольные доли HNO 3 и воды в концентрированном растворе азотной кислоты (68,0% HNO 3 по массе)?
(a) Опишите шаги, необходимые для ответа на вопрос.
(b) Ответьте на вопрос.
- Рассчитайте мольную долю каждого растворенного вещества и растворителя:
(а) 583 г H 2 SO 4 в 1.50 кг воды — кислотный раствор, используемый в автомобильном аккумуляторе
(б) 0,86 г NaCl в 1,00 × 10 2 г воды — раствор хлорида натрия для внутривенного введения
(c) 46,85 г кодеина, C 18 H 21 NO 3 , в 125,5 г этанола, C 2 H 5 OH
(г) 25 г I 2 в 125 г этанола, C 2 H 5 OH
- Рассчитайте мольную долю каждого растворенного вещества и растворителя:
(а) 0.710 кг карбоната натрия (стиральная сода), Na 2 CO 3 , в 10,0 кг воды — насыщенный раствор при 0 ° C
(b) 125 г NH 4 NO 3 в 275 г воды — смесь, используемая для изготовления быстрорастворимого пакета со льдом
(c) 25 г Cl 2 в 125 г дихлорметана, CH 2 Cl 2
(d) 0,372 г гистамина, C 5 H 9 N, в 125 г хлороформа, CHCl 3
- Рассчитайте мольные доли метанола, CH 3 OH; этанол, C 2 H 5 OH; и воду в растворе, который состоит из 40% метанола, 40% этанола и 20% воды по массе.(Предположим, что данные верны до двух значащих цифр.)
- В чем разница между решением 1 M и решением 1 m ?
- Какова молярность фосфорной кислоты H 3 PO 4 в растворе 14,5 г H 3 PO 4 в 125 г воды?
(a) Опишите шаги, необходимые для ответа на вопрос.
(b) Ответьте на вопрос.
- Какова моляльность азотной кислоты в концентрированном растворе азотной кислоты (68.0% HNO 3 по массе)?
(a) Опишите шаги, необходимые для ответа на вопрос.
(b) Ответьте на вопрос.
- Рассчитайте моляльность каждого из следующих решений:
(a) 583 г H 2 SO 4 в 1,50 кг воды — раствор кислоты, используемый в автомобильном аккумуляторе
(б) 0,86 г NaCl в 1,00 × 10 2 г воды — раствор хлорида натрия для внутривенного введения
(c) 46,85 г кодеина, C 18 H 21 NO 3 , дюйм 125.5 г этанола, C 2 H 5 OH
(г) 25 г I 2 в 125 г этанола, C 2 H 5 OH
- Рассчитайте моляльность каждого из следующих решений:
(a) 0,710 кг карбоната натрия (стиральная сода), Na 2 CO 3 , в 10,0 кг воды — насыщенный раствор при 0 ° C
(b) 125 г NH 4 NO 3 в 275 г воды — смесь, используемая для изготовления быстрорастворимого пакета со льдом
(c) 25 г Cl 2 в 125 г дихлорметана, CH 2 Cl 2
(г) 0.372 г гистамина, C 5 H 9 N, в 125 г хлороформа, CHCl 3
- Концентрация глюкозы, C 6 H 12 O 6 , в нормальной спинномозговой жидкости составляет [латекс] \ frac {75 \; \ text {mg}} {100 \; \ text {g}} [ /латекс]. Какая моляльность раствора?
- 13,0% раствор K 2 CO 3 по массе имеет плотность 1,09 г / см 3 . Рассчитайте моляльность раствора.
- Почему 1 моль хлорида натрия понижает температуру замерзания 1 кг воды почти вдвое больше, чем 1 моль глицерина?
- Какая точка кипения раствора 115.0 г сахарозы, C 12 H 22 O 11 , в 350,0 г воды?
(a) Опишите шаги, необходимые для ответа на вопрос
(б) Ответьте на вопрос
- Какова температура кипения раствора 9,04 г I 2 в 75,5 г бензола, если I 2 нелетуч?
(a) Опишите шаги, необходимые для ответа на вопрос.
(b) Ответьте на вопрос.
- Какая температура замерзания раствора 115.0 г сахарозы, C 12 H 22 O 11 , в 350,0 г воды, которая замерзает при 0,0 ° C в чистом виде?
(a) Опишите шаги, необходимые для ответа на вопрос.
(b) Ответьте на вопрос.
- Какова температура замерзания раствора 9,04 г I 2 в 75,5 г бензола?
(a) Опишите шаги, необходимые для ответа на следующий вопрос.
(b) Ответьте на вопрос.
- Каково осмотическое давление водного раствора 1.64 г Ca (NO 3 ) 2 в воде при 25 ° C? Объем раствора 275 мл.
(a) Опишите шаги, необходимые для ответа на вопрос.
(b) Ответьте на вопрос.
- Каково осмотическое давление раствора бычьего инсулина (молярная масса 5700 г / моль -1 ) при 18 ° C, если в 100,0 мл раствора содержится 0,103 г инсулина?
(a) Опишите шаги, необходимые для ответа на вопрос.
(b) Ответьте на вопрос.
- Какова молярная масса раствора 5.00 г соединения в 25,00 г четыреххлористого углерода (точка кипения 76,8 ° C; K b = 5,02 ° C / м ), который кипит при 81,5 ° C и давлении 1 атм.
(a) Опишите шаги, необходимые для ответа на вопрос.
(b) Решите проблему.
- Образец органического соединения (неэлектролита) массой 1,35 г снизил температуру замерзания 10,0 г бензола на 3,66 ° C. Рассчитайте молярную массу соединения.
- Раствор HCl в бензоле объемом 1,0 м имеет точку замерзания 0.4 ° С. Является ли HCl электролитом в бензоле? Объяснять.
- Раствор содержит 5,00 г мочевины, CO (NH 2 ) 2 , нелетучего соединения, растворенного в 0,100 кг воды. Если давление пара чистой воды при 25 ° C составляет 23,7 торр, каково давление пара раствора?
- Образец неэлектролита массой 12,0 г растворяют в 80,0 г воды. Раствор замерзает при -1,94 ° C. Рассчитайте молярную массу вещества.
- Расположите следующие растворы по убыванию точки замерзания: 0.1 м Na 3 PO 4 , 0,1 м C 2 H 5 OH, 0,01 м CO 2 , 0,15 м NaCl и 0,2 м CaCl 2 .
- Рассчитайте повышение точки кипения 0,100 кг воды, содержащей 0,010 моль NaCl, 0,020 моль Na 2 SO 4 и 0,030 моль MgCl 2 , предполагая полную диссоциацию этих электролитов.
- Как вы могли подготовить 3.08 m водный раствор глицерина, C 3 H 8 O 3 ? Какая точка замерзания этого раствора?
- Образец серы массой 0,210 г растворяли в 17,8 г сероуглерода, CS 2 ( K b = 2,43 ° C / m ). Если повышение температуры кипения составляло 0,107 ° C, какова формула молекулы серы в сероуглероде?
- В значительном эксперименте, проведенном много лет назад, 5,6977 г йодида кадмия в 44 раза.Температура кипения 69 г воды повысилась на 0,181 ° C. Что это говорит о природе раствора CdI 2 ?
- Лизоцим — это фермент, расщепляющий клеточные стенки. Образец раствора лизоцима объемом 0,100 л, который содержит 0,0750 г фермента, демонстрирует осмотическое давление 1,32 × 10 -3 атм при 25 ° C. Какая молярная масса лизоцима?
- Осмотическое давление раствора, содержащего 7,0 г инсулина на литр, составляет 23 торр при 25 ° C. Какая молярная масса инсулина?
- Осмотическое давление крови человека 7.6 атм при 37 ° C. Какая масса глюкозы, C 6 H 12 O 6 , требуется для приготовления 1,00 л водного раствора для внутривенного кормления, если раствор должен иметь такое же осмотическое давление, что и кровь при температуре тела 37 ° C?
- Какова температура замерзания раствора дибромбензола, C 6 H 4 Br 2 , в 0,250 кг бензола, если раствор кипит при 83,5 ° C?
- Какова температура кипения раствора NaCl в воде, если раствор замерзает при -0.93 ° С?
- Сахар-фруктоза содержит 40,0% C, 6,7% H и 53,3% O по массе. Раствор 11,7 г фруктозы в 325 г этанола имеет температуру кипения 78,59 ° C. Температура кипения этанола составляет 78,35 ° C, а для этанола K b составляет 1,20 ° C / м . Какова молекулярная формула фруктозы?
- Давление паров метанола, CH 3 OH, составляет 94 торр при 20 ° C. Давление паров этанола, C 2 H 5 OH, составляет 44 торр при той же температуре.
(a) Рассчитайте мольную долю метанола и этанола в растворе 50,0 г метанола и 50,0 г этанола.
(b) Этанол и метанол образуют раствор, который ведет себя как идеальный раствор. Рассчитайте давление паров метанола и этанола над раствором при 20 ° C.
(c) Рассчитайте мольную долю метанола и этанола в паре над раствором.
- Тройная точка безвоздушной воды определяется как 273,15 К. Почему так важно, чтобы вода не содержала воздуха?
- Мясо можно классифицировать как свежее (незамороженное), даже если оно хранится при температуре -1 ° C.Почему мясо не замораживается при такой температуре?
- Органическое соединение имеет состав 93,46% C и 6,54% H по массе. Раствор 0,090 г этого соединения в 1,10 г камфоры плавится при 158,4 ° C. Температура плавления чистой камфоры составляет 178,4 ° C. K f для камфоры 37,7 ° C / m . Какова молекулярная формула растворенного вещества? Покажи свои расчеты.
- Образец HgCl 2 массой 9,41 г растворяют в 32,75 г этанола, C 2 H 5 OH ( K b = 1.20 ° C / м ). Повышение температуры кипения раствора составляет 1,27 ° C. Является ли HgCl 2 электролитом в этаноле? Покажи свои расчеты.
- Известно, что соль представляет собой фторид щелочного металла. Быстрое приблизительное определение точки замерзания показывает, что 4 г соли, растворенной в 100 г воды, дает раствор, который замерзает при температуре около -1,4 ° C. Какая формула соли? Покажи свои расчеты.
Глоссарий
- превышение точки кипения
- Повышение температуры кипения жидкости путем добавления растворенного вещества
- Константа повышения точки кипения
- константа пропорциональности в уравнении, связывающем повышение точки кипения с моляльностью растворенного вещества; также известная как эбуллиоскопическая постоянная
- коллигативная собственность
- свойство раствора, которое зависит только от концентрации растворенных веществ
- зубцы
- процесс, при котором биологические клетки сморщиваются из-за потери воды из-за осмоса
- Депрессия точки замерзания
- понижение точки замерзания жидкости путем добавления растворенного вещества
- Константа депрессии точки замерзания
- (также криоскопическая постоянная) константа пропорциональности в уравнении, связывающем депрессию точки замерзания с моляльностью растворенного вещества
- гемолиз
- разрыв красных кровяных телец из-за накопления лишней воды путем осмоса
- гипертонический
- большего осмотического давления
- гипотонический
- с меньшим осмотическим давлением
- ионная пара
- Сольватированная пара анион / катион, удерживаемая вместе умеренным электростатическим притяжением
- изотонический
- равного осмотического давления
- моляльность ( м )
- единица концентрации, определяемая как отношение количества молей растворенного вещества к массе растворителя в килограммах
- осмос
- диффузия молекул растворителя через полупроницаемую мембрану
- осмотическое давление ( Π )
- Противодавление, необходимое для предотвращения массового переноса молекул растворителя через полупроницаемую мембрану
- Закон Рауля
- парциальное давление, оказываемое компонентом раствора, равно произведению мольной доли компонента в растворе на его равновесное давление пара в чистом состоянии
- Полупроницаемая мембрана
- мембрана, которая избирательно пропускает определенные ионы или молекулы
- Фактор Вант-Гоффа ( i )
- отношение количества молей частиц в растворе к количеству молей формульных единиц, растворенных в растворе
Решения
Ответы к упражнениям в конце главы по химии
2.Сила связей между подобными молекулами сильнее, чем прочность между разнородными молекулами. Следовательно, будут существовать некоторые области, в которых молекулы воды будут исключать молекулы масла, а другие области будут существовать, в которых молекулы масла будут исключать молекулы воды, образуя гетерогенную область.
4. Оба образуют однородные растворы; их повышение точки кипения такое же, как и снижение давления пара. Осмотическое давление и понижение точки замерзания одинаковы для обоих растворов.
6. (a) Найдите количество молей HNO 3 и H 2 O в 100 г раствора. Найдите мольные доли компонентов.
(б) Мольная доля HNO 3 составляет 0,378. Мольная доля H 2 O составляет 0,622.
8. (a) [латекс] X _ {\ text {Na} _2 \ text {CO} _3} = 0,0119 [/ латекс]; [латекс] X _ {\ text {H} _2 \ text {O}} = 0,988 [/ латекс]; (б) [латекс] X _ {\ text {NH} _4 \ text {NO} _3} = 0,9927 [/ латекс]; [латекс] X _ {\ text {H} _2 \ text {O}} = 0,907 [/ латекс]; (c) [латекс] X _ {\ text {Cl} _2} = 0.192 [/ латекс]; [латекс] X _ {\ text {CH} _2 \ text {Cl} _2} = 0.808 [/ latex]; (г) [латекс] X _ {\ text {C} _5 \ text {H} _9 \ text {N}} = 0,00426 [/ латекс]; [латекс] X _ {\ text {CHCl} _3} = 0,997 [/ латекс]
10. В растворе 1 M моль содержится ровно в 1 л раствора. В растворе 1 m моль содержится ровно в 1 кг растворителя.
12. (a) Определите молярную массу HNO 3 . Определите количество молей кислоты в растворе. По количеству молей и массе растворителя определяют моляльность.(б) 33,7 м
14. (а) 6.70 × 10 −1 м ; (б) 5,67 м ; c) 2,8 м ; (г) 0,0358 м
16. 1.08 м
18. (a) Определите молярную массу сахарозы; определить количество молей сахарозы в растворе; перевести массу растворителя в килограммы; по количеству молей и массе растворителя определить моляльность; определить разницу между температурой кипения воды и температурой кипения раствора; определить новую точку кипения.(б) 100,5 ° С
20. (a) Определите молярную массу сахарозы; определить количество молей сахарозы в растворе; перевести массу растворителя в килограммы; по количеству молей и массе растворителя определить моляльность; определить разницу между температурой замерзания воды и температурой замерзания раствора; определить новую температуру замерзания. (б) -1,8 ° С
22. (a) Определите молярную массу Ca (NO 3 ) 2 ; определить количество молей Ca (NO 3 ) 2 в растворе; определить количество молей ионов в растворе; определить молярность ионов, затем осмотическое давление.(б) 2,67 атм
24. (a) Определите молярную концентрацию по изменению температуры кипения и K b ; определить количество молей растворенного вещества в растворе по молярной концентрации и массе растворителя; молярную массу определяют по количеству молей и массе растворенного вещества. (б) 2.1 × 10 2 г моль −1
26. Нет. Чистый бензол замерзает при 5,5 ° C, поэтому наблюдаемая температура замерзания этого раствора ниже Δ T f = 5.5 — 0,4 = 5,1 ° С. Расчетное значение, предполагающее отсутствие ионизации HCl, составляет Δ T f = (1,0 м) (5,14 ° C / м ) = 5,1 ° C. Согласованность этих значений подтверждает предположение, что HCl не ионизируется.
28. 144 г моль −1
30. 0,870 ° С
32. S 8
34. 1,39 × 10 4 г моль −1
36,54 г
38,100,26 ° С
40. (a) [латекс] X _ {\ text {CH} _3 \ text {OH}} = 0.{\ circ} \ text {C} [/ latex]
Наблюдаемое изменение равно теоретическому изменению; следовательно, диссоциации не происходит.
коллигативных свойств
коллигативных свойствКоллигативные свойства растворов — это свойства, которые зависят от концентрации молекул или ионов растворенного вещества, но не от идентичности растворенного вещества. Коллигативные свойства включают снижение давления пара, повышение точки кипения, снижение точки замерзания и осмотическое давление.
Понижение давления пара:
Давайте сначала напомним себе, что такое давление пара и что влияет на него химически и физически.В закрытом контейнере жидкость будет испаряться до тех пор, пока такое же количество молекул не вернется в жидкое состояние, как они уходят в газовую фазу. Давление паровой фазы над жидкостью в этой точке называется равновесным давлением пара. Это давление пара зависит от ряда факторов, включая температуру системы (кинетическая энергия требуется, чтобы помочь молекулам уйти в газовую фазу), давление в системе (высокое давление может удерживать газ, содержащийся в жидкости e .грамм. бутылка кокса), а также межмолекулярные силы самой жидкости (более сильные связи потребуют большей кинетической энергии для разрыва, замедляя процесс испарения, снижая общее давление пара в системе).
Что произойдет с системой, если мы добавим растворенное вещество в рассматриваемый растворитель? Проще говоря, поскольку некоторые молекулы растворенного вещества будут занимать места на поверхности жидкости, это ограничит количество молекул растворителя на поверхности. Поскольку только молекулы растворителя, расположенные на поверхности, могут улетучиваться (испаряться), явное присутствие растворенного вещества снижает количество приходящих и уходящих молекул растворителя и, следовательно, снижает равновесное давление пара.Чтобы выяснить, насколько растворенное вещество повлияло на давление пара, нам нужно приблизительно определить, на сколько меньшее количество молекул способны достичь поверхности жидкости, верно? Хорошим приближением того, сколько существует молекул растворителя по сравнению с растворенным веществом, является мольная доля X растворителя . Если мы просто умножим новую мольную долю растворителя на стандартное давление паров (P o растворитель ) чистого растворителя, это даст нам хорошее приближение к новому давлению паров растворителя.Уравнение будет выглядеть так: P растворитель = X растворитель P o растворитель . Это уравнение называется законом Рауля. Обратите внимание, что давление, которое вы получаете из этого уравнения, является новым равновесным давлением пара системы с включенным растворенным веществом. Если вы хотите узнать, сколько изменений произошло, вам нужно будет посмотреть на разницу между новым растворителем P и исходным P o растворителем чистого растворителя (другими словами, вычтите одно из другого. ) DP = P растворитель — P o растворитель = изменение давления пара в системе.Почти для всех нелетучих растворителей это изменение будет отрицательным.
Ограничения по закону Рауля:
Закон Рауля работает только для растворов с низкой концентрацией. Почему? Что ж, для того, чтобы наше приближение работало, взаимодействия между молекулами растворенного вещества и растворителя должны быть почти идентичными. Если взаимодействия сильнее, тогда теплота испарения растворителя изменится, и, таким образом, все наше приближение развалится. Поскольку мы знаем, что межмолекулярные силы сильно различаются между молекулами, влияние этих сил должно быть сведено к минимуму, поддерживая очень низкую концентрацию растворенного вещества.Вы можете думать об этом как о том, что один вонючий парень на вечеринке в комнате на 1000 человек, есть очень хороший шанс, что вам не придется его нюхать, но если бы в комнате было 100 вонючих парней, это испортило бы вся партия, верно?
Еще одно соображение — это тип растворенного вещества. Если растворенное вещество является ионным веществом (солью), то оно, скорее всего, разделится на составляющие ионы при попадании в растворитель (обычно воду). Если это так, нам нужно рассмотреть каждую формирующуюся частицу.Например, если вы добавили 0,25 моль NaCl в раствор, вы фактически добавили бы 0,25 моль Na + и 0,25 моль Cl — для общего коллигативного эффекта 0,50 моль ионов. Это значение 2 x 0,25 называется фактором Вант-Гоффа ( i ) и должно использоваться всякий раз, когда вы вычисляете коллигативные свойства растворов, содержащих ионы.
Высота точки кипения:
Теперь, когда мы увидели, как добавление растворенных веществ к растворителю может снизить давление его паров, давайте посмотрим, сможем ли мы выяснить, как это связано с точкой кипения того же растворителя.Нормальная точка кипения жидкости определяется как температура, при которой давление пара жидкости равно стандартному давлению (1 атм). Если мы изменим внешнее давление с 1 атм ниже или выше, точка кипения также изменится. Точка кипения — это просто температура, при которой давление пара растворителя равно давлению окружающей среды. Если вы думаете об этом, до тех пор, пока давление пара не достигнет этой точки, молекулы газа не могут вырваться, верно? Давление на поверхность сдерживает их.Как только вы достигнете температуры кипения, давление пара станет равным внешнему давлению, и молекулы могут улететь. Учтите, что вам действительно нужно превысить температуру кипения, чтобы жидкость полностью испарилась. Т.е. пар горячее 100 o C.
Теперь вернемся к коллигативным свойствам … как добавление растворенных веществ в растворитель влияет на температуру кипения? Что ж, теперь мы понимаем, что молекулы растворенных веществ, занимающие позиции на поверхности жидкости, снижают давление пара.Мы также знаем, что нам нужно повысить давление пара жидкости, чтобы достичь точки кипения, поэтому это должно означать, что нам придется вложить больше энергии, чтобы достичь того же давления пара. Подвод большего количества энергии соответствует подаче тепла в систему этого типа, поэтому температура точки кипения должна быть выше, чтобы получить такое же давление пара. Таким образом, добавление нелетучего растворенного вещества к раствору повышает температуру кипения этого раствора.
Когда растворенное вещество растворяется в растворителе, температура кипения раствора повышается в соответствии с уравнением:
D T = i K b м
DT = изменение температуры
i = фактор Вант-Гоффа, который представляет собой количество частиц, на которые диссоциирует растворенное вещество
м = молярность, которая представляет собой моли растворенного вещества на килограммы растворителя
K b = молярная константа точки кипения (для воды K b = 0.5121 o C / м )
Хотите попрактиковаться в вычислениях с использованием этого уравнения? Нажмите здесь .
Депрессия точки замерзания:
Давайте начнем это обсуждение так же, как мы начали предыдущие, с определения нормальной точки замерзания. Нормальная точка замерзания жидкости — это температура, при которой жидкость становится твердой при давлении 1 атм. Более конкретное определение точки замерзания — это температура, при которой твердая и жидкая фазы сосуществуют в равновесии.Давайте посмотрим, сможем ли мы выяснить, почему точка замерзания понижается, когда мы добавляем растворенные вещества в раствор. Мы уже знаем, что для того, чтобы жидкость заморозить, нужно понизить температуру. С понижением температуры раствор становится более упорядоченным по мере продвижения к твердой фазе. Этот эффект противоречит второму закону термодинамики . Короче говоря, энтропия (беспорядок) любит возрастать, а не убывать в естественном порядке вещей. Итак, если нам нужно снизить температуру до определенной точки, чтобы заморозить чистый растворитель, когда мы добавляем растворенное вещество, мы добавляем к энтропии системы, верно? Смесь более неупорядоченная, чем чистая.Теперь необходимо преодолеть это дополнительное количество энтропии, чтобы позволить жидкости преобразовать фазы в твердое тело (стать упорядоченным). Значит, температура должна быть еще ниже, чем раньше. Таким образом, добавление любого типа растворенного вещества к растворителю снижает его точку замерзания.
Как и в случае с повышением точки кипения, уравнение для определения того, насколько велико будет изменение температуры, имеет следующий вид:
D T = i K f м
DT = изменение температуры
i = фактор Вант-Гоффа, который представляет собой количество частиц, на которые диссоциирует растворенное вещество
м = молярность, которая представляет собой моли растворенного вещества на килограммы растворителя
K f = постоянная молярной точки замерзания (для воды K f = -1.86 o C / м )
Хотите попрактиковаться в задачах? Нажмите здесь .
Использование коллигативных свойств для определения молекулярной массы вещества:
Совместные свойства, такие как понижение точки замерзания или повышение температуры кипения, можно использовать для расчета молекулярной массы растворимого твердого вещества. Для завершения этого расчета необходимо знать массу растворенного вещества и растворителя, а также точки замерзания / кипения чистого растворителя и раствора.
или
Вот шаги, которые необходимо предпринять:
1) Определить DT
2) Используйте DT, i и K b или K f для определения моляльности растворенного вещества (m = g растворенного вещества / кг растворителя ).
3) Подставьте все значения и рассчитайте для m.w.
4) Используйте здравый смысл, чтобы оценить вашу расчетную стоимость как разумную или нет! Другими словами, проверьте на бу-бу.
Примечание. Таким же образом можно использовать изменение давления пара или осмос для расчета молекулярной массы.
Депрессия точки замерзания — Концепция
Понижение точки замерзания является коллигативным свойством растворов. Точки замерзания растворов ниже, чем у чистого растворителя или растворенного вещества, потому что замерзание или превращение в твердое вещество создает порядок и снижает энтропию. Растворы имеют высокую энтропию из-за смеси растворителя и растворенного вещества, поэтому требуется больше энергии, чтобы уменьшить их энтропию до той же точки.
Хорошо, имея дело с растворами, вы столкнетесь с коллигативными свойствами, и одним из коллигативных свойств, которые вы увидите, является снижение точки замерзания, и это говорит о том, что в растворе частицы растворенного вещества мешают силам притяжения в растворителе. частицы. И это предотвращает переход раствора в твердое состояние. По сути, они говорят, потому что в жидкости есть все эти дополнительные частицы для образования раствора, и это не чистый растворитель, который мешает межмолекулярным силам, которые делают ее твердым телом.Подобно водородной связи, диполь-дипольному взаимодействию и лондонским силам дисперсии, те дополнительные частицы, которые там присутствуют, как бы мешают, и они на самом деле помогают снизить температуру замерзания, чтобы получить, вытолкнуть эти частицы, чтобы это было чистый растворитель, когда он фактически заморожен.
Точка замерзания означает, что частицы больше не обладают достаточной кинетической энергией для преодоления межмолекулярных сил притяжения, поэтому, когда эти частицы присутствуют, эти силы притяжения не нужны.Так что им нужно будет просто вытолкнуть эти частицы, чтобы у них действительно присутствовали силы притяжения внутренних частиц. Итак, давайте поговорим о разных веществах и их температурах замерзания. Итак, мы говорим о воде, которая является универсальным растворителем, и мы знаем, что вода обычно замерзает при 0 градусах Цельсия при нормальной температуре замерзания. Теперь для каждого моляля вещества, которое я собираюсь поместить в эту воду в чистом веществе, фактически понижается температура до точки замерзания на 1.86 градусов по Цельсию.
Бензол замерзает при 5,5 градусах Цельсия намного выше, чем вода, и на каждый моль вещества, который у вас есть на килограмм раствора, точка кипения упадет еще на 5,12 градуса Цельсия и так далее, и тому подобное. Итак, если вы посмотрите на это, это очень похоже на повышение точки кипения, но эта формула набора точно такая же, но есть некоторые небольшие отличия. Таким образом, изменение температуры точки замерзания равно константе, которую мы обсуждали, временное сходство этого решения, с которым мы имеем дело, время — это коэффициент Бен-Хоффа, а коэффициент Бен-Хоффа — это то, насколько на самом деле частица разделяется в решение.Итак, мы говорим об ионных соединениях, они разделяются на раствор в зависимости от того, сколько в них частиц или сколько ионов в нем, но молекулярные соединения этого не делают. Итак, давайте действительно применим это к действию.
Хорошо, а какая точка замерзания 0,029 моляля водного раствора NaCl, чтобы мы знали, что он водный, а водный, говорит нам, что нашим растворителем является вода. Итак, мы собираемся сказать, что наша дельта T при изменении температуры до точки замерзания будет равна постоянной воды, равной 1.86 градусов Цельсия на каждый коренной зуб. И молярный раствор 0,029, и поскольку это NaCl, я знаю, что он ионный на каждый моль, он фактически разделится на 2 вещества: Na плюс и Cl минус. На самом деле мы умножаем это на 2, у нас есть вещества, когда они находятся в растворе. Итак, когда вы умножаете все это вместе, вы получаете 0,11 градуса Цельсия, и мы собираемся сказать, что наша исходная точка замерзания равна 0, она будет ниже на 0,11, и поэтому наша новая точка замерзания составляет 0,11 градуса по Цельсию, потому что она упала настолько сильно.Так что нам действительно нравится говорить о том, когда вы думаете о том, когда на улице идет снег, и о том, почему вы кладете соль на дороги, на дорогах даже нет соли, которая на самом деле снижает температуру замерзания, поэтому листов не будет. льда по дороге, по дорогам или тротуарам. Вот почему они используют соль, и они обычно используют хлорид кальция, который на самом деле лучше, чем хлорид натрия, потому что он фактически распадается на 3 частицы, поэтому температура замерзания у него падает в 3 раза больше, чем у другого растворенного вещества.Итак, это пример депрессии точки завивки.

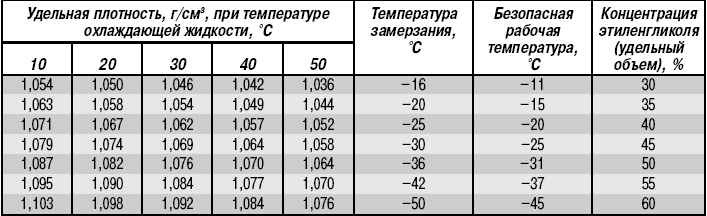 Анилин
Анилин