|
Физические свойства углекислоты Углекислота (СО2, двуокись углерода, диоксид углерода) – вещество с химическое формулой СО2 и молекулярной массой 44,011 г/моль, которое может существовать в четырёх фазовых состояниях – газообразном, жидком, твёрдом и сверхкритическом. Газообразное состояние СО2 носит общеупотребительное название «углекислый газ». При атмосферном давлении это бесцветный газ без цвета и запаха, при температуре +20 ?С плотностью 1,839 кг/м? (в 1,52 раза тяжелее воздуха), хорошо растворяется в воде (0,88 объёма в 1 объёме воды), частично взаимодействуя в ней с образованием угольной кислоты. Входит в состав атмосферы в среднем 0,035% по объёму. Газообразный диоксид углерода ранее нередко хранили в стационарных газгольдерах. В настоящее время такой способ хранения не применяется; углекислый газ в необходимом количестве получают непосредственно на месте – путём испарения жидкой углекислоты в газификаторе. Далее газ можно легко перекачать по любому газопроводу под давлением 2-6 атмосфер. Жидкое состояние СО2 носит техническое название «жидкая углекислота» или просто «углекислота». Это бесцветная жидкость без запаха, средней плотностью 771 кг/м3, которая существует только под давлением 3 482…519 кПа при температуре 0…-56,5 град.С («низкотемпературная углекислота»), либо под давлением 3 482…7 383 кПа при температуре 0…+31,0 град.С («углекислота высокого давления»). Углекислоту высокого давления получают чаще всего путём сжатия углекислого газа до давления конденсации, при одновременном охлаждении водой. При небольшом и среднем потреблении углекислоты (высокого давления),т для её хранения и транспортировки используют разнообразные стальные баллоны (от баллончиков для бытовых сифонов до ёмкостей вместимостью 55 л). Самым распространенным является 40 л баллон с рабочим давление 15 000 кПа, вмещающим 24 кг углекислоты. За стальными баллонами не требуется дополнительный уход, углекислота сохраняется без потерь в течение длительного времени. Баллоны с углекислотой высокого давления окрашивают в чёрный цвет. При значительном потреблении, для хранения и транспортировки низкотемпературной жидкой углекислоты используют изотермические цистерны самой разнообразной вместимости, оснащённые служебными холодильными установками. Существуют накопительные (стационарные) вертикальные и горизонтальные цистерны вместимостью от 3 до 250 т, транспортируемые цистерны вместимостью от 3 до 18 т. При мгновенном снижении давления до атмосферного, происходящем при впрыске в специальную расширительную камеру (дросселировании), жидкий диоксид углерода мгновенно превращается в газ и тончайшую снегообразную массу, которую прессуют и получают диоксид углерода в твёрдом состоянии, который носит общеупотребительное название «сухой лёд». При атмосферном давлении это белая стекловидная масса плотностью 1 562 кг/м?, с температурой -78,5 ?С, которая на открытом воздухе сублимируется – постепенно испаряется, минуя жидкое состояние. Сухой лёд может быть также получен непосредственно на установках высокого давления, применяемых для получения низкотемпературной углекислоты, из газовых смесей, содержащих СО2 в количестве не менее 75-80%. Объёмная холодопроизводительность сухого льда почти в 3 раза больше, чем у водяного льда, и составляет 573,6 кДж/кг. Твёрдый диоксид углерода обычно выпускают в брикетах размером 200?100?20-70 мм, в гранулах диаметром 3, 6, 10, 12 и 16 мм, редко в виде тончайшего порошка («сухой снег»). При давлении свыше 7,39 кПа и температуре более 31,6 град.С диоксид углерода находится в так называемом сверхкритическом состоянии, при котором его плотность как у жидкости, а вязкость и поверхностное натяжение как у газа. Эта необычная физическая субстанция (флюид) является отличным неполярным растворителем. Сверхкритический CO2 способен полностью или выборочно экстрагировать любые неполярные составляющие с молекулярной массой менее 2 000 дальтон: терпеновые соединения, воски, пигменты, высокомолекулярные насыщенные и ненасыщенные жирные кислоты, алкалоиды, жирорастворимые витамины и фитостерины.
Техника безопасности По степени воздействия на организм человека газообразный диоксид углерода относится к 4-му классу опасности по ГОСТу 12.1.007-76 «Вредные вещества. Классификация и общие требования безопасности». Предельно допустимая концентрация в воздухе рабочей зоны не установлена, при оценке этой концентрации следует ориентироваться на нормативы для угольных и озокеритовых шахт, установленные в пределах 0,5%. При применении сухого льда, при использовании сосудов с жидкой низкотемпературной углекислотой должно обеспечиваться соблюдение мер безопасности, предупреждающих обморожение рук и других участков тела работника. |
Сколько газа необходимо заправить в баллон?
Перед тем, как отправиться заправлять углекислотный баллон, необходимо убедиться, что не истекла дата его аттестации. Если баллон просрочен, его необходимо аттестовать в уполномоченной организации. Иначе на заправочной станции откажут в обслуживании.
Главное правило заправки баллонов – не пытаться закачать их СО2 полностью!
Требование техники безопасности обусловлено:
- способностью газа расширяться при повышении температуры;
- необходимостью создания «воздушной подушки» в баллоне.
Формула предельно допустимой заправки – объем баллона, умноженный на коэффициент 0,7. Например, для 2-литрового баллона 2 * 0,7 =1,4 кг. Заправленное выше нормы (определяется по весу баллона или показаниям манометра) необходимо как можно быстрей стравить через вентиль.
Перегруженный углекислотный баллон способен взорваться уже при 250 С!
Также нежелательно заправлять полностью пустые емкости. Остаточное давление газа, по показателям манометра, должно быть в районе 0,05 мПа.
Остаточное давление газа, по показателям манометра, должно быть в районе 0,05 мПа.
Техника безопасности при использовании баллонного СО2
Заправленные по правилам техники безопасности баллоны нельзя подвергать нагреву выше 400 С, иначе возможно критическое расширение и взрыв. Не ставьте систему подачи углекислого газа около батарей отопления и обогревателей или под солнечные лучи.
Баллоны должны соответствовать требованиям правил безопасности (ПБ):
- не иметь повреждений и вздутий;
- площадь затронутых ржавчиной участков не должна превышать 30% от общей площади поверхности;
- проходить обязательную аттестацию.
Соответствие требованиям проверяется во время аттестационных испытаний. В их число входят:
- контроль внешних повреждений;
- контроль износа стенок;
- контроль состояния вентиля;
- гидроиспытания;
- промывка и сушка горячим воздухом;
- дегазация;
-
испытания под давлением.

Уполномоченная организация имеет лицензию не только на испытания, но и на ремонт. Некритичные неисправности, например, замена вентиля или окраска, могут быть исправлены на месте и тогда эксплуатация оборудования будет безопасной.
Если баллон не прошел тесты, то его следует заменить и не пытаться заправить кустарным методом в точках, не имеющих разрешения на работы с газами. Компаний, соглашающихся работать с неаттестованными баллонами следует избегать, поскольку они не будут отвечать при появлении проблем.
Как рассчитать количество кислорода в баллоне
Если выполнение тех или иных работ требует использования технического газа, то сметчики обычно сталкиваются с проблемой расчёта его содержания в газовых баллонах. Трудность возникает в связи с тем, что в накладных поставщиков могут фигурировать самые разные единицы измерения. Так, содержание газа в кислородных баллонах может указываться в литрах, кубометрах, килограммах или даже в количестве баллонов. А в смете может быть указана совсем другая единица измерения, поэтому специалисты должны знать, как рассчитать содержание газа в баллоне.
А в смете может быть указана совсем другая единица измерения, поэтому специалисты должны знать, как рассчитать содержание газа в баллоне.
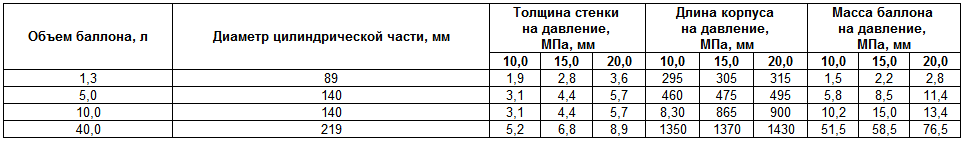
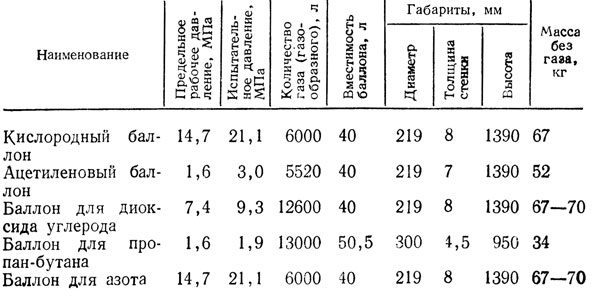
При расчёте содержания кислорода, прежде всего, нужно уточнить размеры и другие параметры кислородных баллонов. Чаще всего используются ёмкости на пять, десять и сорок литров. Все необходимые для расчётов данные содержатся в ГОСТе 949 73.
В другом госстандарте за номером 558378, который регулирует использование кислорода медицинского и технического назначения, содержится формула. Она предназначена для вычисления объёма газа, находящегося в условиях близких к нормальным. В данной формуле объём выражен в кубометрах.
В формуле V=K1*Vб указаны следующие параметры:
- коэффициент, определяющий объём газа, который содержится в ёмкости при нормальных условиях — К1;
- вместимость ёмкости в кубических дециметрах — Vб.
Для расчёта коэффициента также потребуются такие параметры, как
- давление, которое измеряется с помощью манометра и выражается в кгс/см2;
- коэффициент, предназначенный для перевода технических параметров в физические атмосферы, он равен 0,968;
- температура кислорода, находящегося в ёмкости;
- коэффициент, по которому определяется сжигаемость газа в условиях определённой температуры.

Каким может быть К1, также можно узнать из таблицы, которая размещена в ГОСТе 5583 78.
В качестве примера выясним, каким будет содержание кислорода в сорокалитровом газовом баллоне. Его рабочее давление равняется 14,7 мегапаскалей или 150 кгс/см2. По таблице номер четыре определим коэффициент, если температура кислорода равняется 15 градусам Цельсия. Это значение равняется 0,159.
Подставив значения в формулу, указанную выше, выясним, что в одном сорокалитровом баллоне содержится 6,36 кубометра кислорода.
Также объём любого газа, содержащегося в баллонах, можно рассчитать, используя газовые калькуляторы. С их помощью подсчитывается содержание в баллонах таких газов, как кислород, азот, гелий и аргон, которые находятся под определённым давлением.
На какое время хватит одного баллона углекислого газа при сварке?
Углекислый газ, так же как и аргон, используется в качестве защитной среды во время сварочных работ. Углекислота, подаваемая в рабочую зону сварочного аппарата, вытесняет присутствующий там атмосферный воздух – так шов защищается от химических реакций с кислородом и азотом.
Компания ТОРГГАЗ предоставляет баллоны ёмкостью 5, 10, 20 и 40 л. Ознакомиться с их стоимостью можно здесь.
Как быстро расходуется газ
Для грамотного планирования рабочего процесса необходимо знать, с какой скоростью убывают расходные материалы, в т.ч. CO2.
Чтобы посчитать, насколько примерно хватит баллона, необходимо знать следующие исходные данные для задачки:
- сила тока;
- диаметр сварочной проволоки;
- толщина металла, изготовляемого изделия.
Так как сварная проволока подбирается исходя из требуемых характеристик сварного шва, а они находятся в сильной зависимости от толщины обрабатываемого металла, то в целях упрощения последний параметр можно опустить.
В итоге после проведённых вычислений, получаются приблизительно такие показатели расхода углекислого газа:- проволока 0,8-1,0 мм, сила тока 60-160А – 8-9л/мин;
- проволока 1,2мм, сила тока 100-250А – 9-12 л/мин;
- проволока 1,4мм, сила тока 120-320А – 12-15л/мин;
- проволока 1,6мм, сила тока 240-380А – 15-18л/мин;
- проволока 2,0мм, сила тока 280-450А – 18-20л/мин.

Существует ещё два аспекта, которые сложно учесть в отрыве от конкретной ситуации:
- Для оптимальной работы с различными металлами и их сплавами используются и разные газы.
- Порывы ветра на улице препятствуют формированию защитной газовой среды. В результате расход углекислоты может существенно возрасти.
Сколько прослужит стандартный баллон
В обычной 40-литровой ёмкости внутри находится 24 кг сжиженного углекислого газа, которые при испарении дают 12000 л. рабочего вещества. Если принять во внимание, рассмотренные ранее параметры расхода, то выходит, что один стандартный баллон прослужит 12000/10=1200 мин или же 20 часов при работе с проволокой 1,2 мм и силе тока 120А.
Справочники по сварке дают такую информацию на этот счёт: 1 кг наплавляемого металла = 1,35 кг сварочной проволоки = 1,1 кг углекислоты. Становится заметна пропорция на каждый кг расхода проволоки приходится 0,82 кг CO2. Это значит имеющихся в баллоне 24 кг сжиженного газа достаточно для работы с 29 кг сварочной проволоки.
Похожие статьи
Как определить, сколько технического газа осталось в баллоне?
Нельзя полностью расходовать сжиженный газ из баллона. Опорожненные емкости принимаются на повторное заполнение с остаточным давлением не менее 0,05 МПа, а в случае с ацетиленом – от 0,05 до 0,1 МПа. Такие требования позволяют контролировать остаток газа и предотвращают проникновение внутрь сосуда посторонних веществ из окружающей среды. Если содержимое емкости истрачено полностью, приходится проводить дополнительную операцию промывки. Опорожненные баллоны хранятся на складе с предохранительными колпаками или подвергаются повторной заправке.
В то же время, слишком большой остаток – это финансовые потери для пользователя. По сути, он выбрасывает топливо, за которое заплатил собственные деньги. Существует несколько способов определения количества оставшегося в емкости газа.
Взвешивание
Самый простой способ, доступный каждому потребителю и не требующий сложных математических вычислений.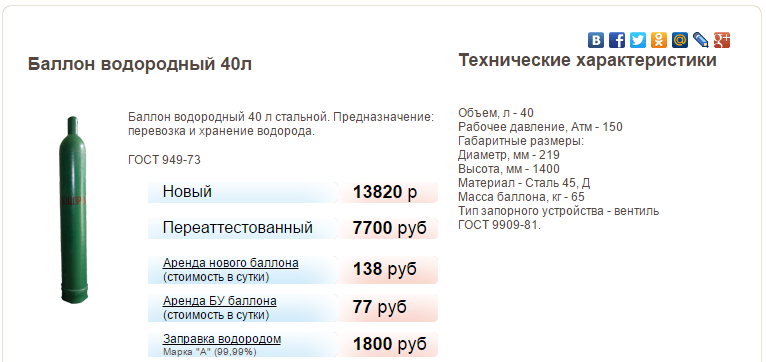 Перед тем, как заправить газовый баллон в Москве и любом другом городе, необходимо изучить маркировку сосуда, расположенную на дне. Надпись должна содержать данные завода-изготовителя, срок последней аттестации, дату производства, номинальный объем, габариты, рабочее давление и вес пустой емкости. После этого остается только взвесить баллон с остатками газа и определить разницу.
Перед тем, как заправить газовый баллон в Москве и любом другом городе, необходимо изучить маркировку сосуда, расположенную на дне. Надпись должна содержать данные завода-изготовителя, срок последней аттестации, дату производства, номинальный объем, габариты, рабочее давление и вес пустой емкости. После этого остается только взвесить баллон с остатками газа и определить разницу.
Для примерного расчета количества содержимого можно полученное значение умножить на 2. Такое приближение допустимо, так как вес сжатого бытового газа равен примерно 0,5 кг/л. То есть, если разница в массе составила 1 кг, то количество остатка около 2 л. Знание оставшегося газа поможет рассчитать время замены баллона.
Определение по манометру
На всех баллонах большой емкости устанавливается прибор определения давления. Узнать остаток газа в сосуде можно, умножив объем сосуда на показания манометра в атмосферах. Вычисление будет приблизительным, так как давление в емкости сильно зависит от физико-технических характеристик содержимого и температуры окружающей среды.
Измерение специальным прибором
Современные производители предлагают пользователям оборудование, показания которого не зависят от внешних и внутренних факторов. Принцип измерения основан на ультразвуке. Прибор подставляют к баллону и определяют степень наполненности по цветовому индикатору. Продвигаясь по стенке емкости сверху вниз можно определить, до какого уровня она еще наполнена. Прибор стоит дорого, но для постоянного использования технических газов является очень полезным. Измерения проводятся быстро без дополнительных манипуляций с баллоном и вычислений.
Похожие статьи
Расход углекислоты при сварке полуавтоматом: формула расчета, таблица
Использовать защитный газ входе проведения сварочных работ — значит обеспечивать улучшение качества сваренных соединений, ускорять рабочий процесс и давать кислороду возможность попадать внутрь сварочной зоны.
Помимо этого, стоимость такого газового баллона отличается доступностью. С его помощью обеспечивается домашняя сварка. Поэтому возникает потребность выпускать разновидности компактных баллонов, легко транспортируемых внутри автомобильного багажника. Все больше потребителей интересует вопрос о расходе углекислоты в процессе сварке полуавтоматом.
Поэтому возникает потребность выпускать разновидности компактных баллонов, легко транспортируемых внутри автомобильного багажника. Все больше потребителей интересует вопрос о расходе углекислоты в процессе сварке полуавтоматом.
Домашнему сварщику не приходится задаваться таким вопросом, так как он просто покупает такой баллон компактных размеров в магазине и не беспокоится, какой его. В случае использования одного баллона можно воспользоваться вторым. Но иногда в производственных условиях к сварщикам выдвигаются требования относительно расхода газа при сварке полуавтоматом. В такой ситуации важно знать правила вычисления оптимального расхода углекислоты, когда приходится использовать полуавтомат.
Что влияет на показатели расхода
Прежде чем определить, какой расход углекислоты при сварке полуавтоматом, важно разобраться, что влияет на такой расход. В первую очередь учитывается характеристика металла, который используется для работы. Также важны показатели, какая в диаметре присадочная проволока и какой силы сварочный ток. Именно сочетание таких компонентов и влияет на показатели расхода углекислоты в процессе сварки.
Именно сочетание таких компонентов и влияет на показатели расхода углекислоты в процессе сварки.
Усредненные показатели
Показатели, сколько газа расходуется, могут быть следующими:
| Диаметр проволоки (см) | Сила тока (Ампер) | Средние показатели расхода (литров в минуту) |
| 0,8 — 1 | 60 — 160 | 8 |
| 1,2 | 100 — 250 | 9 — 12 |
| 1,4 | 120 — 320 | 12 — 15 |
| 1,6 | 240 — 130 | 15 — 18 |
| 2 см | 280 — 450 | 18 — 20 |
Измерение расхода защитного газа
Чем измеряют расход защитного газа при сварке? Для ответа на этот вопрос можно взять конкретный пример на емкости стандартного баллона объемом в 40 л. Такие баллоны используются на большинстве современных предприятий.
В одном таком баллоне чистая углекислота содержится в количестве примерно 24 кг. В процессе испарения происходит её преобразование в 12 000 ДЦ. газовой фазы. Для примерного понимания расхода это вполне исчерпывающий ответ.
Причины расхода защитного газа
В процессе выполнения сварочных работ можно выделить несколько основных показателей, влияющих на то, сколько сварочной смеси расходуется:
- какой силы ток;
- проволоку какого диаметра используют;
- какой толщины будет металл, который сваривают.
Найти показатели этих значений можно у многих производителей, если изучить паспортные данные о конкретно взятом сварочном газе. Это позволит в значительной степени упростить процесс выполнения расчетов.
К примеру, показатели среднего значения, сколько смеси аргона используется в процессе сварочных работ, выполняемых методом TIG, составляют 6 литров в минуту при использовании силы тока в 100 А. Если силу тока увеличивают до показателей в 300 А, то и нормы потребления будут расти до 10 литров в минуту.
Соблюдение такой тенденции происходит и в случае с методом MIG — если диаметр проволоки увеличить с 1 до 1,6 мм, это приведет тому, что количество потребляемого газа вырастет от 9 до 18 литров за минуту.
Также важную роль играет тот факт, какие условия созданы для проведения сварочных работ.
Влияние условий
Показатели расход газа при сварке полуавтоматом в смеси зависят от того, какие условия обеспечены для проведения работ по сварке. Это может быть открытое пространство. Если вокруг сквозняки, то возможно увеличение расхода. Так как оптимальные факторы защитного плана работают только при условии, что защитный слой имеется в большом количестве. В такой ситуации заправку баллона можно будет производить чаще.
Формула расчета
Показатели расхода для сварочной смеси при сварке с полуавтоматом можно выполнить с помощью следующей формулы:
- P = Py * T;
- Py — показатели удельного расхода газа, о которых заявил производитель;
- T — количество основного времени, необходимое, чтобы сварить один проход.

В приведенной ниже таблице указаны нормы потребления газа, на которые оказывают влияние такие показатели: какая в диаметре проволока и какие средние показатели имеет силы тока.
Так как 40-литровый баллон содержит сварочную смесь в количестве 6 000 литров, нетрудно произвести вычисления, сколько времени можно пользоваться одним резервуаром, если процесс сварки происходит непрерывно.
К примеру, расход CO2 при полуавтоматической сварке, когда используется проволока 1 мм в диаметре, составляет от 10 до 11 часов при условии, что процесс происходит непрерывно.
Показатели таких расчетов довольно грубые, ведь здесь не учитывают, сколько газа потребляется при выполнении подготовительных и финишных операций за один проход. Это поможет в определении приблизительной картины. Если потребуются более точные показания, для их проведения может потребоваться расходомер.
Советы по сокращению расхода
Расход защитного газа при полуавтоматической сварке можно сократить.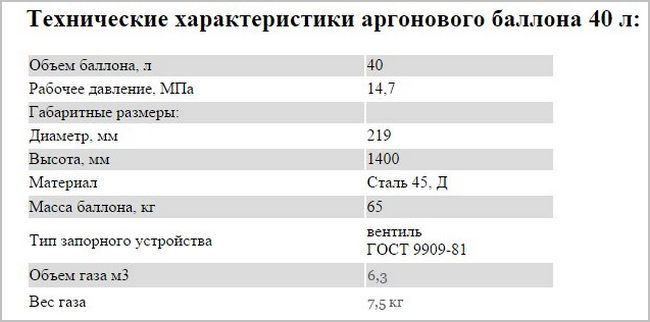 В этом помогут следующие советы.
В этом помогут следующие советы.
Уровень сварочных работ зависит от того, насколько качественным и надежным будет шов. Для этих целей и понадобится использование защитного газа. Поэтому в занижении расхода сварочной смеси искусственным путем нет никакого смысла. Иначе это может вызвать ситуацию, когда образуются поры и возникнут побочные эффекты другого плана.
Для экономии очень важным является качество газовой смеси. Например, если постоянно использовать состав «Микспро 3212», в котором много разных компонентов, можно сократить потребление как минимум вдвое. В сравнении с ситуацией, когда используется бинарный защитный газ. Его основа состоит из аргоновой и углекислотной смесей. Применение смеси «Микспро» приводит к тому, что получается наиболее качественный шов.
Интересное видео
Перевести граммы диоксида углерода в моль
›› Перевести граммы диоксида углерода в
мольПожалуйста, включите Javascript использовать конвертер величин
›› Дополнительная информация в конвертере величин
Сколько граммов диоксида углерода в 1 моль?
Ответ 44. 0095.
0095.
Мы предполагаем, что вы конвертируете граммов диоксида углерода в моль .
Вы можете просмотреть более подробную информацию о каждой единице измерения:
молекулярная масса диоксида углерода или
моль
Молекулярная формула диоксида углерода — CO2.
Основной единицей СИ для количества вещества является моль.
1 грамм диоксида углерода равен 0,022722366761722 моля.
Обратите внимание, что могут возникнуть ошибки округления, поэтому всегда проверяйте результаты.
Используйте эту страницу, чтобы узнать, как переводить между граммами диоксида углерода и молями.
Введите ваши собственные числа в форму для преобразования единиц!
›› Похожие химические формулы
Обратите внимание, что все формулы чувствительны к регистру.
Вы хотели преобразовать одну из этих похожих формул?
граммов CO2 на моль
граммов Co2 на моль
›› График перевода граммов диоксида углерода в
моль 1 грамм углекислого газа на моль = 0. 02272 моль
02272 моль
10 граммов диоксида углерода на моль = 0,22722 моль
20 граммов диоксида углерода на моль = 0,45445 моль
30 граммов диоксида углерода на моль = 0,68167 моль
40 граммов диоксида углерода на моль = 0,90889 моль
50 граммов диоксида углерода на моль = 1,13612 моль
100 граммов диоксида углерода на моль = 2,27224 моль
200 граммов диоксида углерода на моль = 4,54447 моль
›› Хотите другие единицы?
Вы можете произвести обратное преобразование единиц измерения из моль диоксида углерода в граммы, или введите другие единицы для преобразования ниже:
›› Общее количество преобразований веществ
грамма диоксида углерода на молекулу
граммов диоксида углерода на микромоль
граммов диоксида углерода на пикомоль
граммов диоксида углерода на киломоль
граммов диоксида углерода на децимоль
граммов диоксида углерода на наномоль
граммов диоксида углерода на атом
граммов диоксида углерода на сантимоль
диоксид углерода в миллимоль
›› Подробная информация о расчетах молекулярной массы
В химии вес формулы — это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Часто на этом сайте просят перевести граммы в моль. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.
Определение молярной массы начинается с единиц граммов на моль (г / моль).При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Формула веса особенно полезна при определении относительного веса реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям.
Если формула, используемая при расчете молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой. Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.
Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.
Атомные веса, используемые на этом сайте, получены от NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы. Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних. Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов.Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
›› Метрические преобразования и др.
ConvertUnits.com предоставляет онлайн
калькулятор преобразования для всех типов единиц измерения.
Вы также можете найти метрические таблицы преобразования для единиц СИ.
в виде английских единиц, валюты и других данных. Введите единицу
символы, аббревиатуры или полные названия единиц длины,
площадь, масса, давление и другие типы.Примеры включают мм,
дюйм, 100 кг, жидкая унция США, 6 футов 3 дюйма, 10 стоун 4, кубический см,
метры в квадрате, граммы, моль, футы в секунду и многое другое!
Введите единицу
символы, аббревиатуры или полные названия единиц длины,
площадь, масса, давление и другие типы.Примеры включают мм,
дюйм, 100 кг, жидкая унция США, 6 футов 3 дюйма, 10 стоун 4, кубический см,
метры в квадрате, граммы, моль, футы в секунду и многое другое!
Свойства диоксида углерода Есть несколько физических и химических свойств. относятся к диоксиду углерода.
Где мы находим углекислый газ?Углекислый газ можно найти в основном в воздухе, но также и в воде как часть углеродного цикла.Мы можем показать вам, как работает углеродный цикл, с помощью объяснения и схематического изображения. -> Перейти к углеродному циклу. Применение углекислого газа человеком Люди используют углекислый газ по-разному. Самый известный пример — его использование в безалкогольных напитках и пиве для придания им газообразности. Двуокись углерода, выделяемая разрыхлителем или дрожжами, поднимает тесто для торта. Роль двуокиси углерода в экологических процессахДвуокись углерода — один из наиболее распространенных газов в атмосфере.Углекислый газ играет важную роль в жизненно важных процессах растений и животных, таких как фотосинтез и дыхание. Эти процессы будут кратко объяснены здесь. Зеленые растения превращают двуокись углерода и воду в пищевые соединения, такие как глюкоза и кислород. Этот процесс называется фотосинтезом. Реакция фотосинтеза следующая: Растения и животные, в свою очередь, преобразовывают пищевые соединения, объединяя их с кислородом, чтобы высвободить энергию для роста и других жизненных функций.Это процесс дыхания, обратный фотосинтезу. Реакция дыхания следующая: Фотосинтез и дыхание важную роль в углеродном цикле и находятся в равновесии друг с другом. Влияние двуокиси углерода на щелочность Двуокись углерода может изменять pH воды.Вот как это работает: Углекислый газ слегка растворяется в воде с образованием слабой кислоты, называемой угольной кислотой, H 2 CO 3 , в соответствии со следующей реакцией: После этого углекислота незначительно и обратимо реагирует в воде с образованием катиона гидроксония H 3 O + и бикарбонат-иона HCO 3 — в соответствии со следующим реакция: Это химическое поведение объясняет, почему вода, которая обычно имеет нейтральный pH 7 имеет кислый pH приблизительно 5. Выбросы углекислого газа людьми
Экологические проблемы — парниковый эффект Тропосфера — это нижняя часть атмосферы толщиной около 10-15 километров. С начала промышленной революции 1850 года человеческие процессы стали причиной выбросов парниковых газов, таких как CFC и диоксид углерода. Вместе с водородом диоксид углерода является основным парниковым газом.Однако водород не выделяется во время промышленных процессов. Люди не вносят вклад в количество водорода в воздухе, оно изменяется естественным образом только в течение гидрологического цикла, и в результате не является причиной глобального потепления. В предыдущем абзаце были упомянуты различные виды деятельности человека, которые способствуют выбросу углекислого газа. Первым, кто предсказал, что выбросы углекислого газа в результате сжигания ископаемого топлива и других процессов горения вызовут глобальное потепление, был Сванте Аррениус, опубликовавший статью «О влиянии углекислоты в воздухе на температуру земли. »в 1896 году. Рост концентрации углекислого газа в воздухе за последние десятилетия Киотский договор Мировые лидеры собрались в Киото, Япония, в декабре 1997 года, чтобы обсудить всемирное соглашение, ограничивающее выбросы парниковых газов, в основном углерода диоксид, которые, как считается, вызывают глобальное потепление.К сожалению, хотя Киотские договоры какое-то время работали, Америка теперь пытается уклониться от них. Углекислый газ и здоровье Углекислый газ необходим для внутреннего дыхания в организме человека. Внутреннее дыхание — это процесс, при котором кислород транспортируется к тканям тела, а углекислый газ уносится от них. Известно, что углекислый газ не только является важным буфером в организме человека, но и оказывает воздействие на здоровье, когда его концентрации превышают определенный предел. Углекислый газ представляет собой основную опасность для здоровья: Ресурсы: http://www.oism.org/pproject/s33p36.htm |
диоксид углерода | Infoplease
двуокись углерода, химическое соединение , CO 2 , бесцветный газ без запаха и вкуса, который примерно в полтора раза плотнее воздуха при обычных условиях температуры и давления. Он не горит, при нормальных условиях стабилен, инертен и нетоксичен.Однако он будет поддерживать горение магния с образованием оксида магния и углерода. Хотя это не яд, при вдыхании в больших количествах он может вызвать смерть от удушья. Это довольно стабильное соединение, но при очень высоких температурах оно разлагается на углерод и кислород. Он хорошо растворяется в воде, один ее объем растворяется в равном объеме воды при комнатной температуре и давлении; образующийся слабокислый водный раствор называется угольной кислотой. Газ легко сжижается путем сжатия и охлаждения.Если жидкий углекислый газ быстро разжимается, он быстро расширяется, и часть его испаряется, отводя достаточно тепла, чтобы остальная часть остывала в твердый углекислый газ
Он не горит, при нормальных условиях стабилен, инертен и нетоксичен.Однако он будет поддерживать горение магния с образованием оксида магния и углерода. Хотя это не яд, при вдыхании в больших количествах он может вызвать смерть от удушья. Это довольно стабильное соединение, но при очень высоких температурах оно разлагается на углерод и кислород. Он хорошо растворяется в воде, один ее объем растворяется в равном объеме воды при комнатной температуре и давлении; образующийся слабокислый водный раствор называется угольной кислотой. Газ легко сжижается путем сжатия и охлаждения.Если жидкий углекислый газ быстро разжимается, он быстро расширяется, и часть его испаряется, отводя достаточно тепла, чтобы остальная часть остывала в твердый углекислый газ снег.Стандартным тестом на присутствие диоксида углерода является его реакция с известковой водой (насыщенный водный раствор гидроксида кальция) с образованием молочно-белого осадка гидроксида кальция.
Двуокись углерода встречается в природе как в свободном виде, так и в сочетании (например, в карбонатах). Это часть атмосферы, составляющая около 1% от объема сухого воздуха.Поскольку это продукт сгорания углеродсодержащего топлива (например, угля, кокса, мазута, бензина и кухонного газа), в городском воздухе его обычно больше, чем в загородном. За последние 800000 лет содержание углекислого газа в атмосфере колебалось в течение десятков тысяч лет от 180 до 280 частей на миллион (ppm), но после промышленной революции оно неуклонно увеличивалось выше 280 ppm за относительно короткое время, достигнув 400. ppm в 2013 году. Этот дополнительный углекислый газ подпитывает парниковый эффект, нагревая атмосферу и еще больше нарушая естественный цикл углекислого газа (см. глобальное потепление), а контроль углекислого газа, производимого в результате деятельности человека, является ключом к ограничению глобального потепления и разрушительных последствий изменение климата.
Это часть атмосферы, составляющая около 1% от объема сухого воздуха.Поскольку это продукт сгорания углеродсодержащего топлива (например, угля, кокса, мазута, бензина и кухонного газа), в городском воздухе его обычно больше, чем в загородном. За последние 800000 лет содержание углекислого газа в атмосфере колебалось в течение десятков тысяч лет от 180 до 280 частей на миллион (ppm), но после промышленной революции оно неуклонно увеличивалось выше 280 ppm за относительно короткое время, достигнув 400. ppm в 2013 году. Этот дополнительный углекислый газ подпитывает парниковый эффект, нагревая атмосферу и еще больше нарушая естественный цикл углекислого газа (см. глобальное потепление), а контроль углекислого газа, производимого в результате деятельности человека, является ключом к ограничению глобального потепления и разрушительных последствий изменение климата.
В различных частях мира, особенно в Италии, на Яве и в Йеллоустонском национальном парке в Соединенных Штатах, углекислый газ образуется под землей и выходит из трещин в земле. Природные минеральные воды, такие как вода Виши, сверкают (шипят), потому что избыток углекислого газа, растворенный в них под давлением, собирается в пузырьки и улетучивается, когда давление сбрасывается. Дроссельная заслонка (см. Сырость) шахт, карьеров и старых неиспользуемых колодцев в основном состоит из углекислого газа. Двуокись углерода является сырьем для фотосинтеза зеленых растений и продуктом дыхания животных.Это также продукт распада органических веществ.
Природные минеральные воды, такие как вода Виши, сверкают (шипят), потому что избыток углекислого газа, растворенный в них под давлением, собирается в пузырьки и улетучивается, когда давление сбрасывается. Дроссельная заслонка (см. Сырость) шахт, карьеров и старых неиспользуемых колодцев в основном состоит из углекислого газа. Двуокись углерода является сырьем для фотосинтеза зеленых растений и продуктом дыхания животных.Это также продукт распада органических веществ.
Двуокись углерода используется в различных коммерческих целях. Его наибольшее применение в качестве химического вещества — в производстве газированных напитков; он придает блеск газированным напиткам, таким как газированная вода. Образованный под действием дрожжей или разрыхлителя углекислый газ вызывает подъем хлебного теста. Соединение также используется для умягчения воды, при производстве аспирина и свинцовых красок, а также в процессе Solvay для получения карбоната натрия.В некоторых огнетушителях углекислый газ выходит через сопло и оседает на пламени, подавляя его. Он также имеет множество нехимических применений. Он используется в качестве среды под давлением и пропеллента, например, в аэрозольных баллончиках с едой, в огнетушителях, в пистолетах-мишенях и для надувания спасательных плотов. Поскольку он относительно инертен, он используется для создания инертной атмосферы, например, для упаковки пищевых продуктов, таких как кофе, которые могут быть испорчены окислением во время хранения. Твердый диоксид углерода, известный как сухой лед, используется в качестве охлаждающего агента.
Он также имеет множество нехимических применений. Он используется в качестве среды под давлением и пропеллента, например, в аэрозольных баллончиках с едой, в огнетушителях, в пистолетах-мишенях и для надувания спасательных плотов. Поскольку он относительно инертен, он используется для создания инертной атмосферы, например, для упаковки пищевых продуктов, таких как кофе, которые могут быть испорчены окислением во время хранения. Твердый диоксид углерода, известный как сухой лед, используется в качестве охлаждающего агента.
Есть три основных коммерческих источника диоксида углерода. Из некоторых скважин добывается углекислый газ высокой чистоты. Газ получается как побочный продукт химического производства, например, при ферментации зерна для получения спирта и при обжиге известняка для получения извести. Он также производится непосредственно путем сжигания углеродсодержащего топлива. Для коммерческого использования он доступен в виде жидкости под высоким давлением в стальных баллонах, в виде низкотемпературной жидкости при более низких давлениях и в виде твердого сухого льда.
Колумбийская электронная энциклопедия, 6-е изд. Авторские права © 2012, Columbia University Press. Все права защищены.
Дополнительные статьи в энциклопедии: Соединения и элементы
Двуокись углерода | Департамент здравоохранения штата Висконсин
Также известен как: углекислый газ; Сухой лед; СО2; Компонент выхлопной системы дизельного двигателя
Химический справочный номер (CAS): 124-38-9
CO2 — четвертый по содержанию газ в атмосфере Земли.При комнатной температуре диоксид углерода (CO2) представляет собой негорючий газ без цвета и запаха, при других температурах и давлениях диоксид углерода может быть жидким или твердым. Твердый диоксид углерода называется сухим льдом, потому что он медленно превращается из холодного твердого вещества непосредственно в газ.
Углекислый газ является побочным продуктом нормального функционирования клеток, когда он выдыхается из организма. CO2 также образуется при сжигании ископаемого топлива или разложении растительности. Поверхностные почвы иногда могут содержать высокие концентрации этого газа в результате гниения растительности или химических изменений в коренных породах.
Поверхностные почвы иногда могут содержать высокие концентрации этого газа в результате гниения растительности или химических изменений в коренных породах.
В твердом виде углекислый газ используется в огнетушителях, в лабораториях, а также в театральных и сценических постановках в виде сухого льда для образования тумана. Использование сухого льда может повысить уровень CO2 в помещении, если воздух не вентилируется.
При высоком уровне CO2 в почве газ может просачиваться в подвалы через каменные стены или трещины в полу и фундаменте. CO2 может также накапливаться в зданиях, в которых проживает много людей или животных, и является признаком проблем с циркуляцией свежего воздуха в здании или доме.Высокий уровень CO2 может вытеснять кислород (O2) и азот (N2), потенциально вызывая проблемы со здоровьем.
Как избежать воздействия :
- Попросите подрядчика по ОВК или утеплению измерять уровни CO2 в вашем доме. Если уровни превышают 1000 ppm, печь следует настроить на увеличение количества свежего воздуха, поступающего в здание.
 Если уровни выше 2000 ppm, это может быть серьезным заболеванием, которое может потребовать модификации HVAC.
Если уровни выше 2000 ppm, это может быть серьезным заболеванием, которое может потребовать модификации HVAC. - Никогда не используйте огнетушитель или сухой лед не по назначению.
- Никогда не входите в яму для жидкого навоза без защитного снаряжения, поскольку CO2, а также аммиак, метан и сероводород, образующиеся при разложении навоза, могут быстро вызвать потерю сознания и смерть.
- Будьте осторожны при входе в силосы, так как при разложении зерна может накапливаться CO2.
Не существует стандартов содержания CO2 в воздухе внутри помещений; однако высокий уровень углекислого газа в воздухе может указывать на то, что система HVAC (отопления, вентиляции и кондиционирования) не работает должным образом.
Количество углекислого газа в здании обычно зависит от количества свежего воздуха, поступающего в это здание. Как правило, чем выше уровень CO2 в здании, тем меньше объем свежего воздухообмена. Следовательно, изучение уровней CO2 в воздухе в помещении может показать, работают ли системы HVAC в соответствии с нормативными требованиями. Уровни CO2 обычно измеряются в процентах (%) воздуха или частях на миллион (ppm). Высокий уровень CO2, обычно более 1000 частей на миллион, указывает на потенциальную проблему с циркуляцией воздуха и свежим воздухом в помещении или здании.В целом, высокие уровни CO2 указывают на необходимость проверки системы HVAC. Высокий уровень углекислого газа может привести к ухудшению качества воздуха и даже может погасить сигнальные лампы на газовых приборах.
Уровни CO2 обычно измеряются в процентах (%) воздуха или частях на миллион (ppm). Высокий уровень CO2, обычно более 1000 частей на миллион, указывает на потенциальную проблему с циркуляцией воздуха и свежим воздухом в помещении или здании.В целом, высокие уровни CO2 указывают на необходимость проверки системы HVAC. Высокий уровень углекислого газа может привести к ухудшению качества воздуха и даже может погасить сигнальные лампы на газовых приборах.
Реакция всех разная
Реакция человека на химические вещества зависит от нескольких факторов, включая индивидуальное здоровье, наследственность, предыдущее воздействие химических веществ, включая лекарства, и личные привычки, такие как курение или употребление алкоголя. Также важно учитывать продолжительность воздействия химического вещества, степень воздействия химического вещества, а также то, было ли это химическое вещество вдыхалось, касалось или съедалось.
Воздействие CO2 может иметь различные последствия для здоровья. К ним могут относиться головные боли, головокружение, беспокойство, покалывание или ощущение игл, затрудненное дыхание, потливость, усталость, учащенное сердцебиение, повышенное артериальное давление, кому, асфиксия и судороги.
К ним могут относиться головные боли, головокружение, беспокойство, покалывание или ощущение игл, затрудненное дыхание, потливость, усталость, учащенное сердцебиение, повышенное артериальное давление, кому, асфиксия и судороги.
Уровни CO2 в воздухе и потенциальные проблемы со здоровьем:
- 250 — 400 ppm: фоновый (нормальный) уровень наружного воздуха.
- 400–1000 ppm: типичный уровень для жилых помещений с хорошим воздухообменом.
- 1,000 — 2,000 ppm: уровень, связанный с жалобами на сонливость и плохой воздух.
- 2 000 — 5 000 частей на миллион: уровень, связанный с головными болями, сонливостью и застоявшимся, несвежим, душным воздухом. Также могут присутствовать плохая концентрация, потеря внимания, учащенное сердцебиение и легкая тошнота.
- 5000 частей на миллион: это указывает на необычные условия воздуха, в которых также могут присутствовать высокие уровни других газов. Может произойти отравление или кислородное голодание.
 Это допустимый предел воздействия при ежедневном воздействии на рабочем месте.
Это допустимый предел воздействия при ежедневном воздействии на рабочем месте. - 40 000 ppm: этот уровень немедленно опасен из-за недостатка кислорода.
Гиперкапния: причины, лечение и диагностика
Гиперкапния или гиперкапния — это состояние, которое возникает из-за слишком большого количества углекислого газа в крови.
Это часто вызвано гиповентиляцией или нарушением дыхания, когда в легкие поступает недостаточно кислорода и выделяется недостаточное количество углекислого газа. Есть и другие причины гиперкапнии, в том числе некоторые заболевания легких.
Симптомы гиперкапнии могут варьироваться от легких до тяжелых. Есть много потенциальных причин гиперкапнии.
В этой статье обсуждаются симптомы и причины гиперкапнии, а также описываются некоторые варианты лечения, которые помогают контролировать это состояние.
В случаях, когда симптомы легкие и медленно развиваются с течением времени, люди могут даже не осознавать, что у них гиперкапния. Поэтому важно знать как о легких, так и о тяжелых симптомах.
Поэтому важно знать как о легких, так и о тяжелых симптомах.
Легкие симптомы
Легкими симптомами гиперкапнии считаются следующие:
- головокружение
- сонливость
- чрезмерная утомляемость
- головные боли
- чувство дезориентации
- покраснение кожи
- одышка
- Симптомы гиперкапнии могут возникать из-за более коротких периодов поверхностного или медленного дыхания, например, во время глубокого сна.
Они не всегда могут быть поводом для беспокойства, поскольку организм часто способен корректировать симптомы и балансировать уровни углекислого газа в кровотоке без вмешательства.
Однако, если вышеуказанные симптомы сохраняются в течение нескольких дней, рекомендуется обратиться к врачу.
Тяжелые симптомы
Симптомы тяжелой гиперкапнии требуют немедленной медицинской помощи, так как они могут вызвать долгосрочные осложнения. Некоторые случаи могут быть фатальными.
Симптомы тяжелой гиперкапнии включают:
Существует множество причин гиперкапнии, в том числе следующие:
Хроническая обструктивная болезнь легких или ХОБЛ
ХОБЛ — это общий термин для нескольких состояний, влияющих на дыхание.
 Общие формы ХОБЛ включают хронический бронхит и эмфизему.
Общие формы ХОБЛ включают хронический бронхит и эмфизему.Хронический бронхит приводит к воспалению и образованию слизи в дыхательных путях, тогда как эмфизема вызывает повреждение воздушных мешков или альвеол в легких.
Оба состояния могут вызвать повышенный уровень углекислого газа в кровотоке.
Основная причина ХОБЛ — длительное воздействие раздражителей легких. По данным Национального института сердца, легких и крови, сигаретный дым является наиболее распространенным раздражителем легких, вызывающим ХОБЛ в Соединенных Штатах.Загрязнение воздуха и воздействие химикатов или пыли также могут вызывать ХОБЛ.
Хотя не у всех с ХОБЛ разовьется гиперкапния, риск человека увеличивается по мере прогрессирования ХОБЛ.
Апноэ во сне
Национальный фонд сна сообщает, что от 5 до 20 процентов взрослых страдают апноэ во сне.
Это обычное состояние характеризуется поверхностным дыханием или паузами в дыхании во время сна. Это может повлиять на уровень кислорода в кровотоке и нарушить баланс углекислого газа и кислорода в организме.

Симптомы апноэ во сне включают:
- дневную сонливость
- головные боли при пробуждении
- трудности с концентрацией внимания
- храп
Генетика
Редко генетическое заболевание, при котором печень не может производить достаточно альфа-1-антитрипсина. может вызвать гиперкапнию. Альфа-1-антитрипсин — это белок, который необходим для здоровья легких, поэтому дефицит ААТ является фактором риска развития ХОБЛ.
Нервные расстройства и мышечные проблемы
У некоторых людей нервы и мышцы, необходимые для правильного функционирования легких, могут работать неправильно.Например, мышечная дистрофия может вызвать ослабление мышц, что в конечном итоге приведет к проблемам с дыханием.
Другие нарушения нервной или мышечной системы, которые могут способствовать гиперкапнии, включают:
Другие причины
К другим причинам высокого уровня углекислого газа в крови относятся:
- Действия, влияющие на дыхание, включая ныряние или использование вентилятора.

- Инсульт ствола мозга, который может повлиять на дыхание.
- Гипотермия, неотложная медицинская помощь, вызванная быстрой потерей тепла телом.
- Ожирение Синдромы гиповентиляции, когда люди с избыточным весом не могут дышать глубоко или достаточно быстро.
- Передозировка некоторых наркотиков, таких как опиоиды или бензодиазепины.
Во время пандемии COVID-19 некоторые люди обеспокоены тем, что ношение лицевой маски может привести к гиперкапнии. Однако существует очень мало доказательств того, что маски для лица могут вызывать гиперкапнию.
Маски не герметичны и сделаны из материалов, пропускающих воздух.Это позволяет диоксиду углерода циркулировать, а не накапливаться. Даже медицинские маски N95 пропускают поток углекислого газа, что делает маловероятным накопление значительного количества газа.
Более тонкие хирургические и тканевые маски более пористые и свободно прилегают, что обеспечивает еще больший воздухообмен.
Центры по контролю и защите заболеваний (CDC) рекомендуют, чтобы человек носил маску только при выходе на публику или в присутствии людей, которые не живут в своей семье, чтобы предотвратить распространение COVID-19.
 За эти короткие промежутки времени избыток углекислого газа не накапливается.
За эти короткие промежутки времени избыток углекислого газа не накапливается.Людям с затрудненным дыханием не требуется носить маску.
Некоторые люди более подвержены риску развития гиперкапнии, чем другие, особенно если они:
- Курите : Курящие люди, особенно заядлые курильщики, подвержены большему риску развития ХОБЛ, гиперкапнии, других затруднений дыхания и легких. болезни.
- Есть астма : Поскольку астма вызывает воспаление и сужение дыхательных путей, она может повлиять на дыхание и уровень углекислого газа в организме, когда она не контролируется должным образом.
- Работа с раздражителями легких : Те, кто работает с химическими веществами, пылью, дымом или другими раздражителями легких, подвергаются большему риску гиперкапнии.
- ХОБЛ : ХОБЛ, особенно если диагностирована на более поздней стадии прогрессирования заболевания, увеличивает вероятность развития гиперкапнии.

Некоторые тесты, используемые для диагностики гиперкапнии, включают:
- Анализ газов артериальной крови : Проверяет уровень углекислого газа и кислорода в крови.
- Спирометрический тест : Этот тест включает в себя вдувание в трубку, чтобы оценить, сколько воздуха человек может выйти из своих легких и как быстро он может это сделать.
- Рентген или компьютерная томография : Эти визуализационные тесты могут проверить наличие повреждений легких и состояния легких.
Лечение гиперкапнии будет зависеть от тяжести состояния и основной причины.
Варианты включают:
Вентиляция
При гиперкапнии используются два типа вентиляции:
- Неинвазивная вентиляция : Дыханию способствует поток воздуха, который проходит через мундштук или носовую маску.Это помогает людям с апноэ во сне держать дыхательные пути открытыми ночью и также известно как CPAP или постоянное положительное давление в дыхательных путях.

- Механическая вентиляция : человеку через рот вводят трубку в дыхательные пути. Это называется интубацией.
Людям с тяжелыми симптомами гиперкапнии можно подключить устройство искусственной вентиляции легких для облегчения дыхания.
Лекарства
Определенные лекарства могут помочь дыханию, например:
- антибиотики для лечения пневмонии или других респираторных инфекций
- бронходилататоры для открытия дыхательных путей
- кортикостероиды для уменьшения воспаления в дыхательных путях
9 Кислородная терапия 905 проходить кислородную терапию, регулярно пользоваться устройством для доставки кислорода в легкие.Это может помочь сбалансировать уровень углекислого газа в крови.
Изменение образа жизни
Чтобы уменьшить симптомы и избежать осложнений, врач может порекомендовать изменение диеты и физической активности. Они также будут поощрять людей с гиперкапнией избегать раздражения легких, бросая курить и ограничивая воздействие химикатов, пыли и паров.

Хирургия
Если легкие или дыхательные пути повреждены, может потребоваться операция. Варианты включают операцию по уменьшению объема легких для удаления поврежденной ткани или трансплантацию легкого, когда поврежденное легкое заменяется здоровым легким от донора.
Гиперкапнию можно предотвратить с помощью:
- лечения существующих заболеваний легких
- отказа от курения
- поддержания здорового веса
- регулярных тренировок
- избегания воздействия токсичных паров и химикатов
Гиперкапния вызвана слишком большим количеством углекислого газа в крови. Это может произойти по нескольким причинам, и их устранение является ключом к управлению симптомами и улучшению качества жизни человека.
Поскольку симптомы могут быть легкими и медленно прогрессировать с течением времени, важно знать о симптомах гиперкапнии и проконсультироваться с врачом при обнаружении затрудненного дыхания или других симптомов.
Тем, кому требуется длительное лечение или хирургическое вмешательство по поводу гиперкапнии, следует тщательно соблюдать режим лечения, чтобы снизить риск осложнений.





 Цистерны вертикального исполнения требуют строительства фундамента и используются преимущественно в условиях ограниченного пространства для размещения. Применение горизонтальных цистерн позволяет снизить затраты на фундаменты, особенно при наличии общей рамы с углекислотной станцией. Цистерны состоят из внутреннего сварного сосуда, изготовленного из низкотемпературной стали и имеющего пенополиуретановую или вакуумную теплоизоляцию; наружного кожуха из пластика, оцинкованной или нержавеющей стали; трубопроводов, арматуры и приборов контроля. Внутренняя и наружная поверхности сварного сосуда подвергаются специальной обработке, благодаря чему снижена до вероятность поверхностной коррозии металла. В дорогих импортных моделях наружный герметичный кожух выполнен из алюминия. Использование цистерн обеспечивает заправку и слив жидкой углекислоты; хранение и транспортировку без потерь продукта; визуальный контроль массы и рабочего давления при заправке, в процессе хранения и выдачи. Все типы цистерн оснащены многоуровневой системой безопасности.
Цистерны вертикального исполнения требуют строительства фундамента и используются преимущественно в условиях ограниченного пространства для размещения. Применение горизонтальных цистерн позволяет снизить затраты на фундаменты, особенно при наличии общей рамы с углекислотной станцией. Цистерны состоят из внутреннего сварного сосуда, изготовленного из низкотемпературной стали и имеющего пенополиуретановую или вакуумную теплоизоляцию; наружного кожуха из пластика, оцинкованной или нержавеющей стали; трубопроводов, арматуры и приборов контроля. Внутренняя и наружная поверхности сварного сосуда подвергаются специальной обработке, благодаря чему снижена до вероятность поверхностной коррозии металла. В дорогих импортных моделях наружный герметичный кожух выполнен из алюминия. Использование цистерн обеспечивает заправку и слив жидкой углекислоты; хранение и транспортировку без потерь продукта; визуальный контроль массы и рабочего давления при заправке, в процессе хранения и выдачи. Все типы цистерн оснащены многоуровневой системой безопасности.
 Брикеты, гранулы и снег хранят не более 1-2 суток в стационарных заглублённых хранилищах шахтного типа, разбитых на небольшие отсеки; перевозят в специальных изотермических контейнерах с предохранительным клапаном. Используются контейнеры разных производителей вместимостью от 40 до 300 кг и более. Потери на сублимацию составляют, в зависимости от температуры окружающего воздуха 4-6% и более в сутки.
Брикеты, гранулы и снег хранят не более 1-2 суток в стационарных заглублённых хранилищах шахтного типа, разбитых на небольшие отсеки; перевозят в специальных изотермических контейнерах с предохранительным клапаном. Используются контейнеры разных производителей вместимостью от 40 до 300 кг и более. Потери на сублимацию составляют, в зависимости от температуры окружающего воздуха 4-6% и более в сутки. Нерастворимыми веществами для сверхкритического CO2 являются целлюлоза, крахмал, органические и неорганические полимеры с высоким молекулярным весом, сахара, гликозидные вещества, протеины, металлы и соли многих металлов. Обладая подобными свойствами, сверхкритический диоксид углерода всё шире применяется в процессах экстракции, фракционирования и импрегнации органических и неорганических веществ. Он является также перспективным рабочим телом для современных тепловых машин.
Нерастворимыми веществами для сверхкритического CO2 являются целлюлоза, крахмал, органические и неорганические полимеры с высоким молекулярным весом, сахара, гликозидные вещества, протеины, металлы и соли многих металлов. Обладая подобными свойствами, сверхкритический диоксид углерода всё шире применяется в процессах экстракции, фракционирования и импрегнации органических и неорганических веществ. Он является также перспективным рабочим телом для современных тепловых машин.

 Плавление твердой углекислоты происходит при температурах и давлениях, соответствующих тройной точке (t = -56,6 град. и р = 5,28 ата) или находящихся выше ее.
Плавление твердой углекислоты происходит при температурах и давлениях, соответствующих тройной точке (t = -56,6 град. и р = 5,28 ата) или находящихся выше ее. Теплопроводность углекислого газа при 0 град. составляет 0,012 ккал/м*час*град.С, а при температуре -78 град. она понижается до 0,008 ккал/м*час*град.С.
Теплопроводность углекислого газа при 0 град. составляет 0,012 ккал/м*час*град.С, а при температуре -78 град. она понижается до 0,008 ккал/м*час*град.С. , ккал/м*час*град.С.
, ккал/м*час*град.С.  Диэлектрическая постоянная жидкой углекислоты при 50 – 125 ати, находится в пределах 1,6016 – 1,6425.
Диэлектрическая постоянная жидкой углекислоты при 50 – 125 ати, находится в пределах 1,6016 – 1,6425.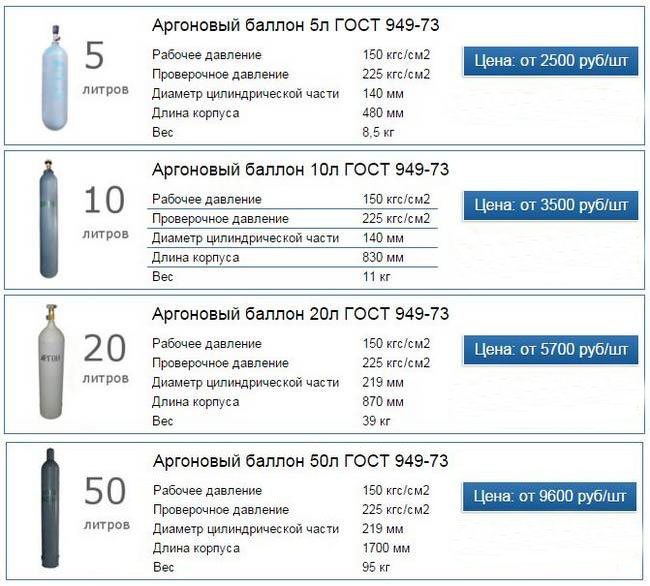




 Жидкая двуокись углерода существует в основном при растворении двуокиси углерода в воде. Углекислый газ растворяется в воде только при поддержании давления.После падения давления газ CO2 попытается уйти в воздух. Это событие характеризуется образованием пузырьков CO2 в воде.
Жидкая двуокись углерода существует в основном при растворении двуокиси углерода в воде. Углекислый газ растворяется в воде только при поддержании давления.После падения давления газ CO2 попытается уйти в воздух. Это событие характеризуется образованием пузырьков CO2 в воде.  / Об. При 20 o C
/ Об. При 20 o C Твердая форма углекислого газа, широко известная как сухой лед, используется в театрах для создания сценических туманов и создания пузырей вроде «волшебных зелий».
Твердая форма углекислого газа, широко известная как сухой лед, используется в театрах для создания сценических туманов и создания пузырей вроде «волшебных зелий». 5 при контакте с воздухом.
5 при контакте с воздухом. В тропосфере есть газы, называемые парниковыми газами. Когда солнечный свет достигает Земли, часть его превращается в тепло. Парниковые газы поглощают часть тепла и удерживают его у поверхности земли, так что земля нагревается. Этот процесс, широко известный как парниковый эффект, был открыт много лет назад и позднее подтвержден лабораторными экспериментами и атмосферными измерениями.
В тропосфере есть газы, называемые парниковыми газами. Когда солнечный свет достигает Земли, часть его превращается в тепло. Парниковые газы поглощают часть тепла и удерживают его у поверхности земли, так что земля нагревается. Этот процесс, широко известный как парниковый эффект, был открыт много лет назад и позднее подтвержден лабораторными экспериментами и атмосферными измерениями.  Это вызвало экологическую проблему: количество парниковых газов выросло настолько сильно, что климат Земли меняется из-за повышения температуры. Это неестественное дополнение к парниковому эффекту известно как глобальное потепление. Есть подозрения, что глобальное потепление может вызвать усиление штормовой активности, таяние ледяных шапок на полюсах, что вызовет затопление обитаемых континентов, и другие экологические проблемы.
Это вызвало экологическую проблему: количество парниковых газов выросло настолько сильно, что климат Земли меняется из-за повышения температуры. Это неестественное дополнение к парниковому эффекту известно как глобальное потепление. Есть подозрения, что глобальное потепление может вызвать усиление штормовой активности, таяние ледяных шапок на полюсах, что вызовет затопление обитаемых континентов, и другие экологические проблемы. Из этих видов деятельности сжигание ископаемого топлива для производства энергии вызывает около 70-75% выбросов диоксида углерода, являясь основным источником выбросов диоксида углерода. Остальные 20-25% выбросов вызваны расчисткой и сжиганием земель, а также выбросами выхлопных газов автомобилей.
Из этих видов деятельности сжигание ископаемого топлива для производства энергии вызывает около 70-75% выбросов диоксида углерода, являясь основным источником выбросов диоксида углерода. Остальные 20-25% выбросов вызваны расчисткой и сжиганием земель, а также выбросами выхлопных газов автомобилей.  В конце 1950-х годов, когда были разработаны высокоточные методы измерения, было найдено еще больше подтверждений. К 1990-м годам теория глобального потепления получила широкое признание, хотя и не всеми. Вопрос о том, действительно ли глобальное потепление вызвано увеличением содержания углекислого газа в атмосфере, все еще обсуждается.
В конце 1950-х годов, когда были разработаны высокоточные методы измерения, было найдено еще больше подтверждений. К 1990-м годам теория глобального потепления получила широкое признание, хотя и не всеми. Вопрос о том, действительно ли глобальное потепление вызвано увеличением содержания углекислого газа в атмосфере, все еще обсуждается.
 Твердый углекислый газ всегда ниже -78 o C при обычном атмосферном давлении, независимо от температуры воздуха. Работа с этим материалом более одной-двух секунд без надлежащей защиты может вызвать серьезные волдыри и другие нежелательные эффекты.Газообразный диоксид углерода, выделяющийся из стального баллона, такого как огнетушитель, вызывает аналогичные эффекты.
Твердый углекислый газ всегда ниже -78 o C при обычном атмосферном давлении, независимо от температуры воздуха. Работа с этим материалом более одной-двух секунд без надлежащей защиты может вызвать серьезные волдыри и другие нежелательные эффекты.Газообразный диоксид углерода, выделяющийся из стального баллона, такого как огнетушитель, вызывает аналогичные эффекты.  Если уровни выше 2000 ppm, это может быть серьезным заболеванием, которое может потребовать модификации HVAC.
Если уровни выше 2000 ppm, это может быть серьезным заболеванием, которое может потребовать модификации HVAC. Это допустимый предел воздействия при ежедневном воздействии на рабочем месте.
Это допустимый предел воздействия при ежедневном воздействии на рабочем месте. Общие формы ХОБЛ включают хронический бронхит и эмфизему.
Общие формы ХОБЛ включают хронический бронхит и эмфизему.

 За эти короткие промежутки времени избыток углекислого газа не накапливается.
За эти короткие промежутки времени избыток углекислого газа не накапливается.


