Как рассчитать газ на Гкал, расчет тепла на отопление дома
Рассчитать количество газа на Гкал и то, сколько нужно тепла, чтобы отопить и оплатить дом по его площади вы сможете сами, для чего воспользуйтесь следующей формулой:
(Количество Гкал) разделить (калорийность газа) разделить (коэффициент полезного действия котла) умножить 1000000 = расчетное количество газа в метрах кубических (м3)
Где:
— количество Гкал – сколько Гкал мы потратили или планируем потратить на отопление, например жилого дома.
— калорийность газа – сколько ккал выделится при сжигании 1 м3 газа = примерно 8000
— коэффициент полезного действия котла или колонки – для современных котлов он равен 88 – 92% (при расчете в формулу подставляем КПД/100 или 0,88 – 0,92)
Диагностика современного конденсационного котла фирмы «Riello»
Правда сейчас активно развивается отдельная ветвь котлов с КПД до 107%, так называемых  В случае неправильного монтажа или наладке очень быстро выходят из строя. Если Вы владелец такого типа котлов мой совет, следите за дымоходом, если из него появиться влага (конденсат на трубах из нержавейки) проявляется как потеки ржавчины, бейте тревогу, иначе останетесь без котла.
В случае неправильного монтажа или наладке очень быстро выходят из строя. Если Вы владелец такого типа котлов мой совет, следите за дымоходом, если из него появиться влага (конденсат на трубах из нержавейки) проявляется как потеки ржавчины, бейте тревогу, иначе останетесь без котла.
А теперь для примера разберем сколько нужно тепла чтобы отопить и оплатить дом например 53 метра квадратных.
Принято считать, что 10 квадратных метров правильно спроектированного и построенного дома необходим 1 кВт тепла.
Теперь нам необходимо перевести кВт в Гкал. Для этого можно воспользоваться калькулятором перевода тепловых единиц, его Вы можете скачать бесплатно, или формулами в этой статье – «Как перевести кВт в Гкал?».
Если проще то это 53/10х0,86=4,558 ккал=0,004558 Гкал/час
Теперь переведем все это в кубометры газа.
0,004558/8000/0,9х1000000 = 0,632 м3
И так мы получили, что в самые сильные морозы на отопления нашего дома площадью 53 квадратных метра, в час мы сожжем 0,632 м3 газа. Конечно, если на улице теплее и газа уйдет меньше.
Конечно, если на улице теплее и газа уйдет меньше.
В сутки эта величина будет 0,632х24=15,168 м3 газа.
В средний месяц 15,168х30=455,04 м3 газа.
Мы с вами рассчитали, сколько необходимо тепла, чтобы отопить дом известной площадью. В денежное выражение, я думаю, каждый сможет перевести сам, сколько нужно тепла, чтобы отопить и оплатить свой дом.
Парамонов Ю.О. Ростов-на-Дону. 2015-17г. Эксклюзивно для ООО «Энергостром»
Для тех кто пропустил:
— Как рассчитать мощность котла для обогрева частного дома?
— Как экономит деньги погодозависимая автоматика?
— Как перевести тн угля в Гкал, определение потребности в тепле и топливе.
Что еще почитать по теме:
Теплотворная способность (теплотворность) природного газа: высокая и низкая, разница
Ежедневно включая горелку на кухонной плите, мало кто задумывается о том, насколько давно начали добывать газ. В нашей стране его разработка была начата в двадцатом веке.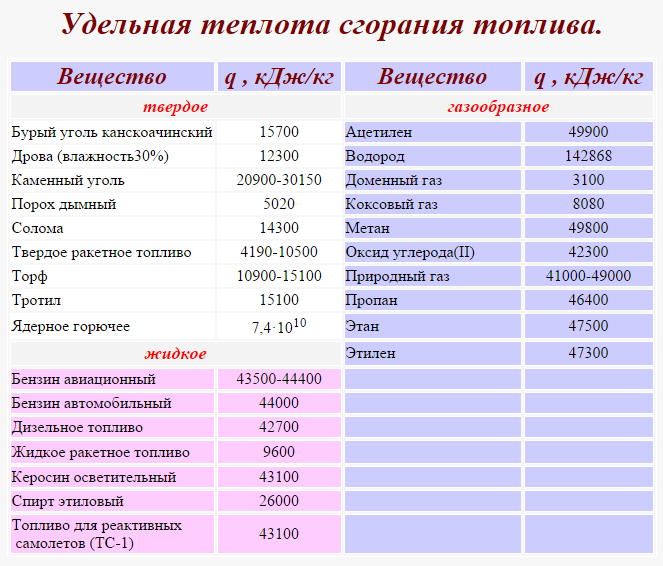 Перед этим же его просто находили при добывании нефтепродуктов. Теплотворная способность природного газа настолько велика, что сегодня это сырьё просто незаменимо, а его качественные аналоги ещё не разработаны.
Перед этим же его просто находили при добывании нефтепродуктов. Теплотворная способность природного газа настолько велика, что сегодня это сырьё просто незаменимо, а его качественные аналоги ещё не разработаны.
Особенность горючего ископаемого
Природный газ — это важное горючее ископаемое, которое занимает ведущие позиции в топливно-энергетических балансах многих государств. В целях снабжения топливом города и всевозможных технических предприятий потребляют различный горючий газ, поскольку природный считается опасным.
Экологи считают, что газ — это чистейшее топливо, при сгорании он выпускает намного меньше ядовитых веществ, чем дрова, уголь, нефть. Это топливо ежедневно используется людьми и содержит в себе такую добавку, как одорант, её добавление происходит на оборудованных установках в соотношении 16 миллиграмм на 1 тысячу кубометров газа.
Важной составляющей вещества является метан (примерно 88-96%), остальное — это прочие химические вещества:
- бутан;
- сероводород;
- пропан;
- азот;
- кислород.

В данном видео рассмотрим роль угля:
Количество метана в природном топливе напрямую зависит от его месторождения.
Описываемый вид топлива состоит из углеводородных и неуглеводородных компонентов. Природное горючее ископаемое — это прежде всего метан, включающий в себя бутан и пропан. Не считая углеводородные составляющие, в описываемом горючем ископаемом присутствуют азот, сера, гелий и аргон. А также встречаются жидкие пары, но лишь в газонефтяных месторождениях.
Виды залежей
Отмечается наличие несколько разновидностей залежей газа. Они подразделяются на такие виды:
- газовые;
- нефтяные.
Их отличительной чертой является содержание углеводорода. В газовых залежах содержится примерно 85-90% представленного вещества, в нефтяных месторождениях содержится не больше 50%.
Остальные проценты занимают такие вещества, как бутан, пропан и нефть.
Огромным недостатком нефтяного зарождения считается его промывка от разного рода добавок. Сера в качестве примеси эксплуатируется на технических предприятиях.
Потребление природного газа
Бутан потребляется в качестве топлива на заправках для машин, а органическое вещество, именуемое «пропан», применяют для заправки зажигалок. Ацетилен является высокогорючим веществом и используется при сварке и при резке металла.
Горючее ископаемое применяется в быту:
Такого рода топливо считается самым бюджетным и невредным, единственным минусом является выброс углекислого газа при сжигании в атмосферу. Ученые всей планеты ищут замену тепловой энергии.
Теплотворная способность
Теплотворной способностью природного газа именуется величина тепла, образующаяся при достаточном выгорании единицы величины топлива.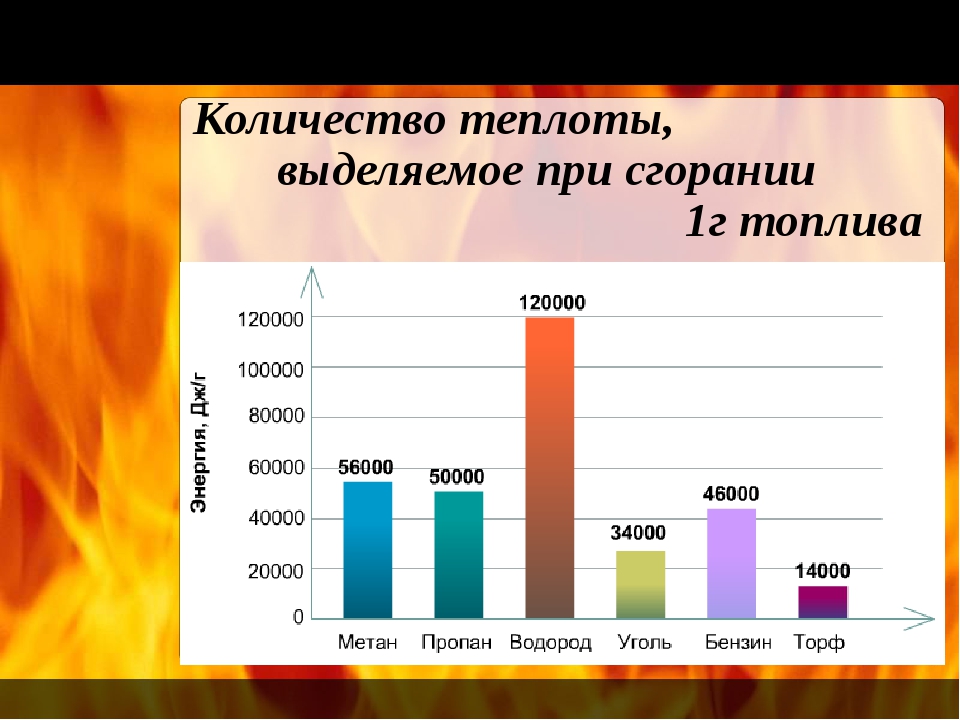 Количество теплоты, выделяемое при сгорании, относят к одному кубическому метру, взятому в естественных условиях.
Количество теплоты, выделяемое при сгорании, относят к одному кубическому метру, взятому в естественных условиях.
Тепловая способность природного газа измеряется в следующих показателях:
- ккал/нм3;
- ккал/м3.
Существует высокая и низкая теплотворная способность:
- Высокая. Рассматривает теплоту водяных паров, возникающих при сжигании топлива.
- Низкая. Не учитывает тепло, содержащееся в водных парах, так как такие пары не поддаются конденсации, а уходят с продуктами горения. Ввиду скопления водяных паров образует количество тепла, равное 540 ккал/кг. К тому же при остывании конденсата выходит тепло от 80 до ста ккал/кг. В общем, за счет скопления водяных паров образуется больше 600 ккал/кг, это и является отличительной чертой между высокой и низкой теплопроизводительностью.

Для подавляющего большинства газов, потребляемых в городской системе распределения топлива, разность приравнивается к 10%. Для того чтобы обеспечить города газом, его теплотворность должна быть больше 3500 ккал/нм3. Объясняется это тем, что подача осуществляется по трубопроводу на большие расстояния. Если теплотворность мала, то его подача увеличивается.
Если теплотворность природного газа меньше 3500 ккал/нм3, его чаще применяют в промышленности. Его не нужно переправлять на длинные отрезки пути, и осуществить горение становится намного легче. Серьезные изменения теплотворной способности газа нуждаются в частой регулировке, а порой и замене большого количества стандартизированных горелок бытовых датчиков, что приводит к трудностям.
Такая ситуация приводит к увеличению диаметров газопровода, а также увеличиваются затраты на металл, прокладывание сетей и эксплуатацию. Большим недостатком низкокалорийных горючих ископаемых является огромное содержание угарного газа, в связи с этим увеличивается уровень угрозы при эксплуатации топлива и при техобслуживании трубопровода, в свою очередь, как и оборудования.
Большим недостатком низкокалорийных горючих ископаемых является огромное содержание угарного газа, в связи с этим увеличивается уровень угрозы при эксплуатации топлива и при техобслуживании трубопровода, в свою очередь, как и оборудования.
Выделяющееся тепло при горении, не превышающее 3500 ккал/нм3, чаще всего применяют в промышленном производстве, где не приходится перебрасывать его на большую протяженность и без труда образовывать сгорание.
(рис. 14.1 – Теплотворная Обратите внимание на теплотворную способность (удельную теплоту сгорания) различных видов топлива, сравните показатели. Теплотворная способность топлива характеризует количество теплоты, выделяемое при полном сгорании топлива массой 1 кг или объёмом 1 м³ (1 л). Наиболее часто теплотворная способность измеряется в Дж/кг (Дж/м³; Дж/л). Удельная теплота сгорания каждого вида топлива зависит:
(рис. 14.2 – Удельная теплота сгорания) Согласно таблице «Удельная теплота сгорания различных энергоносителей, сравнительный анализ расходов», пропан-бутан (сжиженный углеводородный газ) уступает в экономической выгоде и перспективности использования только природному газу (метану). Таким образом, сжиженный углеводородный газ, стоимость которого практически не изменится, остаётся исключительно перспективным – оптимальным решением для систем автономной газификации. | |||||||||
Молярная теплота сгорания топлива Учебное пособие по химии
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Молярная теплота сгорания (молярная энтальпия сгорания) некоторых обычных веществ, используемых в качестве топлива
Углеводороды, такие как алканы, и спирты, такие как алканолы, могут использоваться в качестве топлива.
Когда алкан полностью сгорает в избытке газообразного кислорода, продуктами реакции являются диоксид углерода (CO 2 (г) ) и вода (H 2 O (г) , которая конденсируется до H 2 O (л) при комнатной температуре и давлении).
алкан + избыток газообразного кислорода → газообразный диоксид углерода + водяной пар
Молярная теплота сгорания алкана (молярная энтальпия сгорания алкана) — это количество тепловой энергии, выделяющейся, когда 1 моль алкана сгорает в избытке газообразного кислорода.
Когда алканол полностью сгорает в избытке газообразного кислорода, продуктами реакции являются диоксид углерода (CO 2 (г) ) и вода (H 2 O (г) , которая конденсируется до H 2 O). (л) при комнатной температуре и давлении).
алканол + избыток газообразного кислорода → газообразный диоксид углерода + водяной пар
Молярная теплота сгорания алканола (молярная энтальпия сгорания алканола) — это количество тепловой энергии, выделяемой при сгорании 1 моля алканола в избытке газообразного кислорода.
Чтобы определить молярную теплоту сгорания , нам необходимо определить, сколько моль вещества было израсходовано в реакции горения, поэтому вещество должно быть чистым.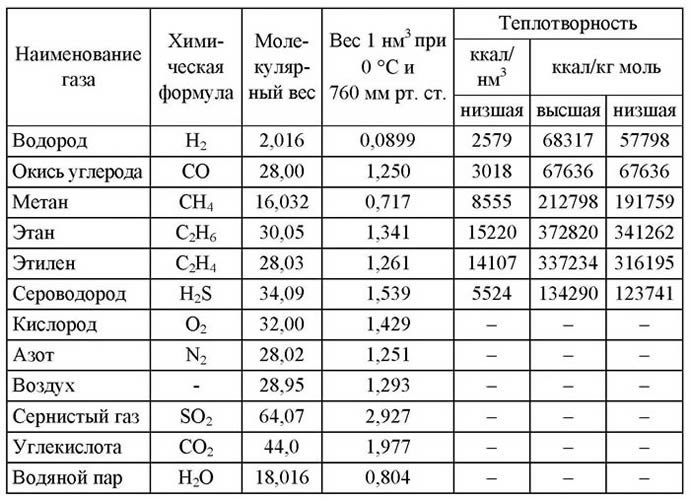 1
1
Молярная теплота сгорания (молярная энтальпия сгорания) некоторых обычных алканов и спиртов, используемых в качестве топлива, представлена в таблице ниже в единицах килоджоулей на моль (кДж моль
Обратите внимание, что химические уравнения, представляющие каждую из реакций горения, сбалансированы таким образом, что используется 1 моль сгоревшего вещества, топлива.
Реакция горения происходит в избытке газообразного кислорода, избытке O 2 (г) , поэтому вполне нормально использовать доли O 2 (г) , чтобы сбалансировать уравнение, потому что нас действительно интересует энергия, выделяемая на моль топлива, а не на моль газообразного кислорода.
| Вещество (топливо) | Молярная теплота сгорания (кДж моль -1 ) | Реакция горения | ΔH реакция (кДж моль -1 ) |
|---|---|---|---|
| метан | 890 | CH 4 (г) + 2O 2 (г) → CO 2 (г) + 2H 2 O (л) | ΔH = -890 |
| этан | 1560 | C 2 H 6 (г) + 7 / 2 O 2 (г) → 2CO 2 (г) + 3H 2 O (л) | ΔH = -1560 |
| пропан | 2220 | C 3 H 8 (г) + 5O 2 (г) → 3CO 2 (г) + 4H 2 O (л) | ΔH = -2220 |
| бутан | 2874 | C 4 H 10 (г) + 13 / 2 O 2 (г) → 4CO 2 (г) + 5H 2 O (л) | ΔH = -2874 |
| октановое число | 5460 | C 8 H 18 (г) + 25 / 2 O 2 (г) → 8CO | ΔH = -5460 |
| метанол (метиловый спирт) | 726 | CH 3 OH (л) + 3 / 2 O 2 (г) → CO 2 (г) + 2H 2 O (л) | ΔH = -726 |
| этанол (этиловый спирт) | 1368 | C 2 H 5 OH (л) + 3O 2 (г) → 2CO 2 (г) + 3H 2 O (л) | ΔH = -1368 |
| пропан-1-ол (1-пропанол) | 2021 | C 3 H 7 OH (л) + 9 / 2 O 2 (г) → 3CO 2 (г) + 4H 2 O (л) | ΔH = -2021 |
| бутан-1-ол (1-бутанол) | 2671 | C 4 H 9 OH (л) + 6O 2 (г) → 4CO 2 (г) + 5H 2 O (л) | ΔH = -2671 |
Из таблицы видно, что 1 моль газообразного метана, CH 4 (г) , подвергается полному сгоранию в избытке газообразного кислорода, выделяя 890 кДж тепла.
Молярная теплота сгорания газообразного метана приведена в таблице как положительное значение, 890 кДж · моль -1 .
Изменение энтальпии при сгорании газообразного метана указано в таблице как отрицательное значение, ΔH = -890 кДж моль -1 , потому что реакция производит энергию (это экзотермическая реакция).
Мы могли бы написать химическое уравнение для представления сгорания 1 моля газообразного метана как:
CH 4 (г) + 2O 2 (г)
Но сколько энергии выделяется, если 2 моля метана полностью сгорают?
Когда мы пишем химическое уравнение для этой реакции, мы должны умножить каждый член на два ( × 2 ), включая значение ΔH:
2 × CH 4 (г) + 2 × 2O 2 (г) → 2 × CO 2 (г) + 2 × 2H 2 O (г) ΔH = 2 × -890 кДж моль -1
2 CH 4 (г) + 4 O 2 (г) → 2 CO 2 (г) + 4 H 2 O (г) ΔH = -1780 кДж моль -1
2 моля метана полностью сгорят с выделением 2 × 890 = 1780 кДж тепла.
Точно так же, если у нас есть только половина моля метана, который подвергается полному сгоранию, мы должны умножить каждый член в химическом уравнении, включая значение ΔH, на ½ , как показано в химических уравнениях ниже:
½ × CH 4 (г) + ½ × 2O 2 (г) → ½ × CO 2 (г) + ½ × 2H 2 O (г) ΔH = ½ × -890 кДж моль -1
½ CH 4 (г) + O 2 (г) → ½ CO 2 (г) + H 2 O (г) ΔH = -445 кДж моль -1
½ моля метана сгорит с выделением ½ × 890 = 445 кДж тепла.
В общем, количество тепловой энергии, выделяемой при сгорании n молей топлива, равно значению молярной теплоты сгорания топлива, умноженной на количество молей сожженного топлива.
выделяемого тепла (кДж) = n (моль) × молярная энтальпия сгорания (кДж моль -1 )
(Дополнительные примеры таких расчетов см.
В этом разделе мы рассмотрели, как использовать таблицы значений молярной энтальпии сгорания чистых веществ, чтобы рассчитать, сколько тепловой энергии будет выделено, когда известные количества вещества будут сожжены в избытке газообразного кислорода.
Но откуда эти значения?
Значения молярной энтальпии сгорания могут быть определены с помощью лабораторных экспериментов.
В следующем разделе мы обсудим эксперимент, который вы могли бы провести, чтобы определить молярную теплоту сгорания спирта.
Измерение молярной теплоты сгорания жидкого топлива (измерение молярной энтальпии сгорания жидкого топлива)
В школьной лаборатории можно определить молярную теплоту сгорания (энтальпию сгорания) жидкого топлива, такого как спирт, используя процедуру, описанную ниже: 3
- В колбу, химический стакан или банку наливают известное количество воды.

- Термометр расположен так, чтобы его груша (резервуар) находилась в середине объема воды.
- В спиртовую горелку помещается известное количество топлива, например спирт (алканол).
- Начальная температура воды измеряется и записывается (T i ).
- Фитиль спиртовой горелки горит, сжигая топливо и нагревая воду.
- Когда температура воды значительно повысилась, спиртовая горелка гаснет, и максимальная достигнутая температура записывается как конечная температура (T f ).
- Окончательное количество топлива измеряется и записывается.
Типичные результаты эксперимента, в котором энергия, выделяемая при полном сгорании этанола, используется для нагрева 200 г воды, показаны ниже:
| начальная температура воды (T i ) = 20 ° C | горелка с начальной массой + этанол (m и ) = 37,25 г |
| конечная температура воды (T f ) = 75 ° C | Конечная масса горелки + этанол (m f ) = 35.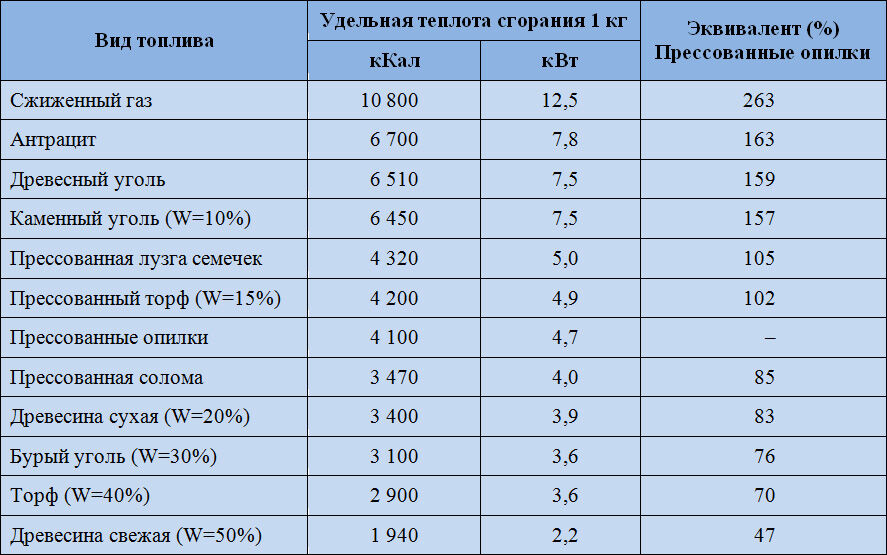 50 г 50 г |
| изменение температуры воды = T f — T i = 75-20 = 55 ° C | Масса этанола, используемого в реакции горения = m i — m f = 37,25 — 35,50 = 1,75 г |
Примечание:
- Температура воды увеличивается, поскольку при сгорании топлива выделяется энергия, которая нагревает воду.
- Масса топлива уменьшается, поскольку оно расходуется в реакции сгорания.
Результаты этого эксперимента можно затем использовать для расчета молярной теплоты сгорания этанола (молярной энтальпии сгорания этанола), как показано ниже:
Шаги для расчета молярной энтальпии сгорания этанола с использованием этих экспериментальных результатов:
- Рассчитать моль (n) использованного топлива
моль = масса ÷ молярная масса
масс использованного этанола = 1.75 г (из опыта)
молярная масса (M) этанола (C 2 H 5 OH)
= (2 × 12,01) + (6 × 1,008) + 16,00 (из периодической таблицы)
= 46,1 г моль -1
n (этанол) = масса ÷ молярная масса
= 1,75
г÷ 46,1гмоль -1= 0,0380 моль
- Рассчитать энергию, необходимую для изменения температуры воды:
энергия, поглощенная водой = удельная теплоемкость воды × масса воды × изменение температуры воды
удельная теплоемкость воды = c г = 4.
 184 Дж ° C -1 г -1 (технический паспорт)
184 Дж ° C -1 г -1 (технический паспорт)масса воды = 200 г (из опыта)
изменение температуры воды = 55 ° C (из эксперимента)
энергии, поглощенной водой = 4,184 Дж
° C -1 г -1× 200г× 55° C= 46024 Дж
Преобразуйте энергию в Дж в кДж, разделив на 1000:
энергия = 46024
Дж÷ 1000Дж/ кДж= 46.024 кДж
- Рассчитайте молярную теплоту сгорания этанола (молярную энтальпию сгорания этанола):
Предположим, что все тепло, произведенное при сжигании этанола, ушло на нагрев воды, то есть тепло не было потрачено впустую.
Из
Тогда мы можем сказать, что0,0380 моль этанола выделено 46,024 кДж тепла.
Следовательно, 1 моль этанола даст:
тепловой энергии на моль этанола = 46.024 кДж ÷ 0,0380 моль
= 1211 кДж моль -1
Следовательно, молярная теплота сгорания этанола составляет 1211 кДж моль -1
(молярная энтальпия сгорания этанола составляет 1211 кДж моль -1 ).
(Обратите внимание, что изменение энтальпии для реакции отрицательное, поскольку реакция является экзотермической, поэтому изменение энтальпии для реакции составляет -1211 кДж моль -1 , ΔH = -1211 кДж моль -1 )
Экспериментально определенное значение молярной теплоты сгорания этанола обычно меньше принятого значения 1368 кДж моль -1 , потому что некоторое количество тепла всегда теряется в атмосферу и при нагревании сосуда.
План эксперимента можно улучшить, пытаясь свести к минимуму потери тепла в окружающую среду, например, окружив всю экспериментальную установку металлическими стенами.
Безусловно, лучший способ минимизировать потери тепла в окружающую среду — это использовать калориметр-бомбу.
Учебное пособие по химии сжигания углеводородов
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Полное сжигание углеводородов
Любой углеводород сгорает в избытке кислорода с образованием газообразного диоксида углерода и водяного пара.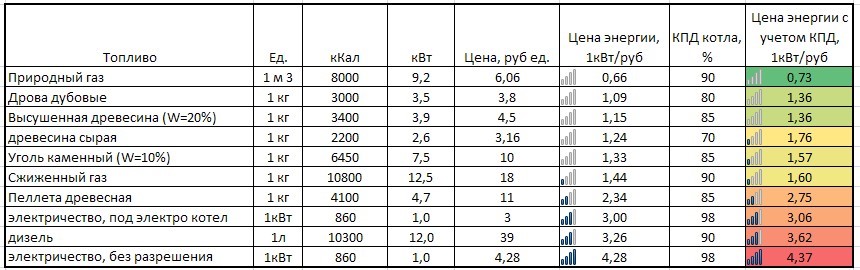
Для полного сгорания углеводорода:
⚛ газообразный кислород — избыток реагента
⚛ углеводород — ограничивающий реагент
Мы можем написать общее словесное уравнение для полного сгорания любого углеводорода, как показано ниже:
углеводород + избыточный газообразный кислород → газообразный диоксид углерода + водяной пар
Углеводороды включают алканы, алкены и алкины, поэтому мы можем сказать, что:
⚛ любой алкан сгорает в избытке кислорода с образованием газообразного диоксида углерода и водяного пара
алкан + избыток газообразного кислорода → газообразный диоксид углерода + водяной пар
⚛ любой алкен сгорает в избытке кислорода с образованием газообразного диоксида углерода и водяного пара
алкен + избыток газообразного кислорода → газообразный диоксид углерода + водяной пар
⚛ любой алкин сгорает в избытке кислорода с образованием газообразного диоксида углерода и водяного пара
алкин + избыток газообразного кислорода → газообразный диоксид углерода + водяной пар
Пример: полное сгорание метана
Метан, CH 4 (г) , является углеводородом. Это соединение, состоящее только из элементов углерода (C) и водорода (H).
Это соединение, состоящее только из элементов углерода (C) и водорода (H).
Метан — это газ при комнатной температуре и давлении. Это обычный компонент природного газа, который используется в качестве топлива.
Метан сгорает в избытке кислорода с образованием газообразного диоксида углерода (CO 2 (г) ) и водяного пара (H 2 O (г) ).
Сгорание с избытком кислорода называется полным сгоранием.
Мы можем написать сбалансированное химическое уравнение для представления полного сгорания газообразного метана, как показано ниже:
- Напишите словесное уравнение для полного сгорания метана:
общее уравнение: реактивы → товаров слово уравнение: метан + газообразный кислород → углекислый газ + водяной пар - Запишите молекулярную формулу для каждого реагента и продукта в словесном уравнении:
Реагенты Продукты метан: газообразный кислород:
CH 4 (г) O 2 (г)
углекислый газ: водяной пар:
CO 2 (г) H 2 O (г)
- Напишите несбалансированное химическое уравнение, подставив молекулярную формулу для названия каждого реагента и продукта в словесное уравнение:
общее уравнение: реактивы → товаров уравнение слова: метан + газообразный кислород → углекислый газ + водяной пар несбалансированное химическое уравнение: CH 4 (г) + O 2 (г) → CO 2 (г) + H 2 O (г) - Сбалансируйте химическое уравнение:
несбалансированное химическое уравнение: CH 4 (г) + O 2 (г) → CO 2 (г) + H 2 O (г) No.  Атомы C:
Атомы C:1 = 1 C-атомы сбалансированы Кол-во атомов H: 4 ≠ 2 Атомы H НЕ сбалансированы Необходимо умножить количество молекул воды на 2 , чтобы уравновесить атомы водорода.Затем проверьте баланс этого нового химического уравнения, как показано ниже. CH 4 (г) + O 2 (г) → CO 2 (г) + 2 H 2 O (г) № C атомов: 1 = 1 C-атомы сбалансированы No.Атомы H: 4 = 4 Атомы H сбалансированы Кол-во атомов O: 2 ≠ 2 + 2 Атомы O НЕ сбалансированы Необходимо умножить количество молекул кислорода на 2 , чтобы уравновесить атомы кислорода.  Затем проверьте баланс этого нового химического уравнения, как показано ниже:
Затем проверьте баланс этого нового химического уравнения, как показано ниже:CH 4 (г) + 2 O 2 (г) → CO 2 (г) + 2H 2 O (г) № C атомов: 1 = 1 C-атомы сбалансированы No.Атомы H: 4 = 4 Атомы H сбалансированы Кол-во атомов O: 4 = 2 + 2 Атомы О сбалансированы - Сбалансированное химическое уравнение полного сгорания газообразного метана имеет вид:
CH 4 (г) + 2O 2 (г) → CO 2 (г) + 2H 2 O (г)
Неполное сжигание углеводородов
Если присутствует недостаточно газообразного кислорода для сгорания углеводорода, чтобы произвести наиболее окисленную форму углерода, которой является газообразный диоксид углерода, мы называем реакцию неполным сгоранием углеводорода.
Для неполного сгорания углеводорода:
⚛ газообразный кислород — ограничивающий реагент
⚛ углеводород — избыток реагента
Неполное сгорание углеводорода обычно приводит к возникновению «сажистого» пламени из-за присутствия углерода (C) или сажи как продукта реакции неполного сгорания.
Водород в углеводороде будет окислен до воды, H 2 O, но углерод в углеводороде может или не может быть окислен до газообразного монооксида углерода (CO (г) ).
Пример: неполное сгорание метана
В конкретном эксперименте избыточный газообразный метан (CH (g) ) сжигался в ограниченном количестве газообразного кислорода с образованием сажи (твердого углерода) и водяного пара.
Мы можем написать сбалансированное химическое уравнение, чтобы представить это неполное сгорание метана в этом эксперименте, как показано ниже:
- Напишите словесное уравнение неполного сгорания метана:
общее уравнение: реактивы → товаров слово уравнение: метан + газообразный кислород → твердый углерод + водяной пар - Запишите молекулярную формулу для каждого реагента и продукта в словесном уравнении:
Реагенты Продукты метан: газообразный кислород:
CH 4 (г) O 2 (г)
твердый углерод: водяной пар:
C (с) H 2 O (г)
- Напишите несбалансированное химическое уравнение, подставив формулу для названия каждого реагента и продукта в словесное уравнение:
общее уравнение: реактивы → товаров слово уравнение: метан + газообразный кислород → твердый углерод + водяной пар несбалансированное химическое уравнение: CH 4 (г) + O 2 (г) → C (т) + H 2 O (г) - Сбалансируйте химическое уравнение:
несбалансированное химическое уравнение: CH 4 (г) + O 2 (г) → C (т) + H 2 O (г) No.  Атомы C:
Атомы C:1 = 1 C-атомы сбалансированы Кол-во атомов H: 4 ≠ 2 Атомы H НЕ сбалансированы Необходимо умножить количество молекул воды на 2 , чтобы уравновесить атомы водорода.Затем проверьте баланс нового уравнения: CH 4 (г) + O 2 (г) → C (т) + 2 H 2 O (г) № C атомов: 1 = 1 C-атомы сбалансированы No.Атомы H: 4 = 4 Атомы H сбалансированы Кол-во атомов O: 2 = 2 Атомы О сбалансированы - Сбалансированное химическое уравнение неполного сгорания газообразного метана в этом эксперименте:
CH 4 (г) + O 2 (г) → C (с) + 2H 2 O (г)
Теплота сгорания — Простая английская Википедия, бесплатная энциклопедия
Эти куски древесного угля имеют теплотворную способность 7543 ккал / кг. Горели почти 4 часа.
Горели почти 4 часа.Теплота сгорания , также называемая теплотворной способностью , или . Энергетическая ценность вещества — это количество энергии, которое выделяется при сгорании определенного количества вещества. Эта энергия выделяется в виде тепла, когда вещество сжигается в стандартных условиях.
Теплота сгорания ( Δ H ° c ) — это мера количества энергии, выделяющейся в виде тепла ( q ) при сгорании одного моля вещества (горение).Выработка тепла означает, что реакция является экзотермическим процессом и выделяет энергию. Теплота сгорания — это особая форма энтальпии реакции, поскольку она измеряется в стандартных условиях и ограничена одним моль исходного материала. Символ (°) показывает, что значение теплоты сгорания достигается при стандартных условиях: 25 градусов Цельсия (298,15 Кельвина) и при постоянном давлении. Сообщается, что давление составляет один бар или одну атмосферу в зависимости от источника. [1] , [2]
[1] , [2]
Теплота сгорания также называется энтальпией сгорания, поскольку энергия, выделяемая в результате реакции сгорания, является результатом изменения общей энтальпии исходного вещества, поскольку оно полностью реагирует с кислородом.Термины теплота сгорания и энтальпия сгорания используются взаимозаменяемо из-за Первого закона термодинамики и соотношений между теплотой при постоянном давлении ( q P ), изменением внутренней энергии (ΔU) и изменением энтальпии. (ΔH). [3] , [4]
Уравнение для изменения внутренней энергии:
Δ U = q P — PΔV .
Если уравнение переставить, то
q P = Δ U + P Δ V .
Уравнение изменения энтальпии:
Δ H = Δ U + P Δ V + V Δ P .
Член V Δ P отменяется, потому что нет изменения давления, поэтому
Δ H = Δ U + P Δ V .
Как указано ранее,
q P = Δ U + P Δ V .
Следовательно, q P = Δ H .
Измерения теплоты сгорания наиболее распространены при сгорании органических углеводородов, соединений, состоящих из углерода и водорода, но могут включать и другие атомы, присутствующие в органических соединениях, таких как азот, фосфор, сера и особенно кислород. Значения теплоты сгорания наиболее широко используются для определения того, является ли вещество эффективным источником топлива. [5] Многие органические соединения можно найти в таблицах теплоты сгорания.
Единицы теплоты сгорания можно варьировать, но они всегда указываются в единицах энергии на моль или на единицу массы или объема в зависимости от метода, используемого для сообщения значений.Для оценки эффективности вещества как топлива удобнее использовать энергию на единицу массы или объема. [5]
Как и при любом горении и многих реакциях окисления, кислород должен присутствовать для того, чтобы вещество могло воспламениться. Реакции горения проводятся с кислородом при постоянном давлении в калориметре. Типичной реакцией горения является реакция метана (CH 4 ) в присутствии кислорода.
Реакции горения проводятся с кислородом при постоянном давлении в калориметре. Типичной реакцией горения является реакция метана (CH 4 ) в присутствии кислорода.
CH 4 (г) + O 2 (г) → CO 2 + H 2 O (л)
Продуктами реакции горения являются вода и углекислый газ, если реагентами являются кислород и углеводороды.Водный продукт может быть в виде газа или жидкости в зависимости от температуры дожигания. Для определения истинной теплоты сгорания используется жидкая вода в конце реакции из-за того, что эксперимент возвращается к стандартной температуре 25 ° C, при которой вода конденсируется в жидкость. [3] , [4] , [2] .
- ↑ Домальский, Э.С. Избранные значения теплоты сгорания и теплоты образования органических соединений, содержащих элементы C, H, N, O и P.J. Phys. Chem. Ref. Данные 1972 г., 1, стр. 221-277.
- ↑ 2,0 2,1 Schmidt-Rohr, K.
 Почему процессы сгорания всегда экзотермичны, давая около 418 кДж на моль 02. J. Chem. Эд. 2015, 92, 2094-2099.
Почему процессы сгорания всегда экзотермичны, давая около 418 кДж на моль 02. J. Chem. Эд. 2015, 92, 2094-2099. - ↑ 3,0 3,1 McQuarrie, D. A .; Саймон, Дж. Д. Молекулярная термодинамика; Научные книги университета, Саусалито, Калифорния, 1999.
- ↑ 4,0 4,1 Мортимер Р.Г. Физическая химия; 3-е изд .; Макгроу-Хилл, Лондон, 2002.
- ↑ 5,0 5,1 McMurry, J.E; Fay, R.C .; Робинсон, Дж. Химия; 7-е изд .; Пирсон, Аппер-Сэдл-Ривер, Нью-Джерси, 2015. стр. 335-337.



 Остальные проценты занимают такие вещества, как бутан, пропан и нефть.
Остальные проценты занимают такие вещества, как бутан, пропан и нефть.
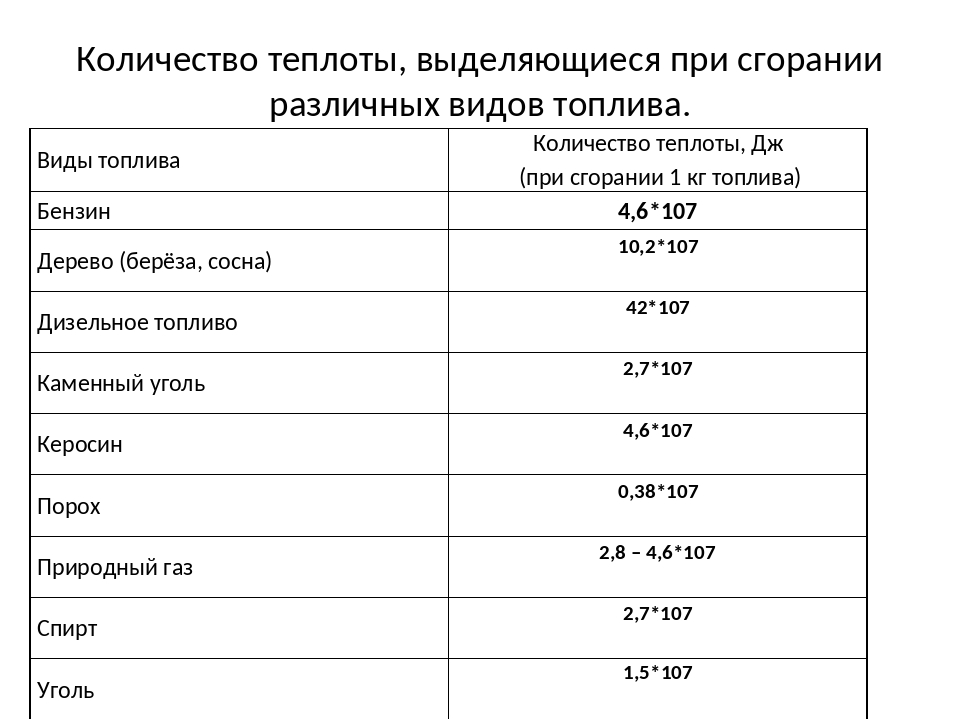 Чем выше удельная теплота сгорания топлива, тем меньше его расход. Поэтому теплотворная способность является одной из наиболее значимых характеристик топлива.
Чем выше удельная теплота сгорания топлива, тем меньше его расход. Поэтому теплотворная способность является одной из наиболее значимых характеристик топлива. 278кВт·ч)
278кВт·ч) за л
за л за кг
за кг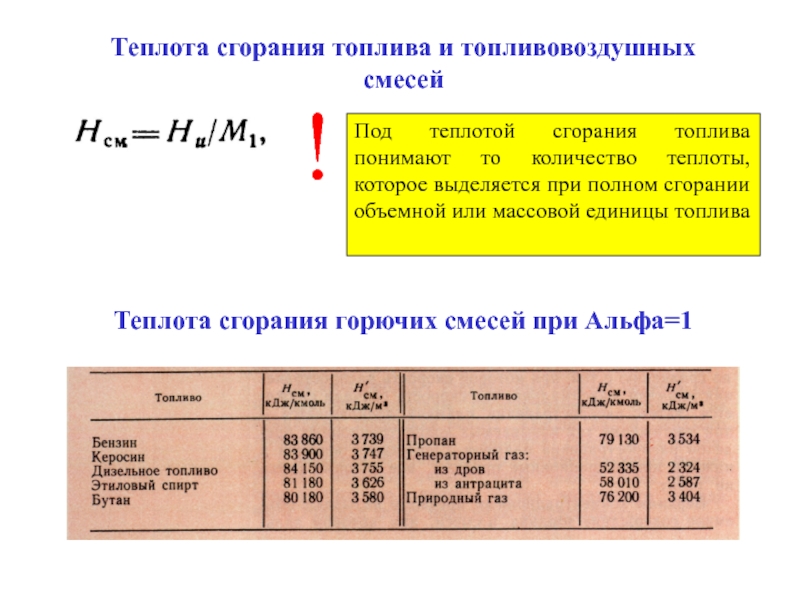 Однако следует обратить внимание на тенденцию к неизбежному росту стоимости магистрального газа, которая на сегодняшний день существенно занижена. Аналитики предрекают неминуемую реорганизацию отрасли, которая приведёт к существенному удорожанию природного газа, возможно, даже превысит стоимость дизельного топлива.
Однако следует обратить внимание на тенденцию к неизбежному росту стоимости магистрального газа, которая на сегодняшний день существенно занижена. Аналитики предрекают неминуемую реорганизацию отрасли, которая приведёт к существенному удорожанию природного газа, возможно, даже превысит стоимость дизельного топлива.
 184 Дж ° C -1 г -1 (технический паспорт)
184 Дж ° C -1 г -1 (технический паспорт)
 Атомы C:
Атомы C: Затем проверьте баланс этого нового химического уравнения, как показано ниже:
Затем проверьте баланс этого нового химического уравнения, как показано ниже: Атомы C:
Атомы C: Почему процессы сгорания всегда экзотермичны, давая около 418 кДж на моль 02. J. Chem. Эд. 2015, 92, 2094-2099.
Почему процессы сгорания всегда экзотермичны, давая около 418 кДж на моль 02. J. Chem. Эд. 2015, 92, 2094-2099.