Страница не найдена — evroterm32.com
Скважины
Содержание1 Гидрофор для частного дома: как правильно выбрать и установить1.1 Аспект #1 — устройство
Скважины
Содержание1 Тампонаж скважин: суть метода, виды и технология работ1.
Вопросы
Содержание1 Как согнуть медную трубку в домашних условиях: как согнуть медную трубу пружиной без
Вопросы
Содержание1 Как снять гусак со смесителя на кухне1.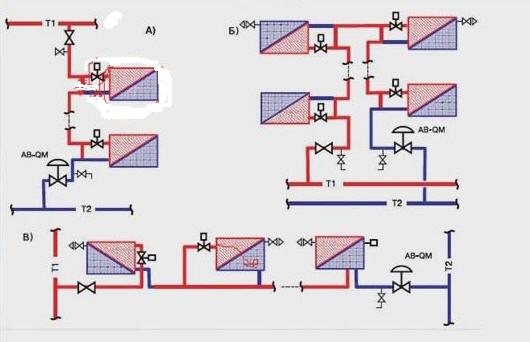 1 Как отремонтировать рычажный кран1.2 Как отремонтировать
1 Как отремонтировать рычажный кран1.2 Как отремонтировать
Бассейны
Содержание1 Какой бассейн установить на даче?1.1 Надувные бассейны1.2 Сборные бассейны1.3 Стационарные бассейны1.4 Пластиковые чаши1.5
Отопление
Содержание1 Как подключить радиатор отопления с боковым подключением1. 1 Разновидности разводки отопления1.2 Однотрубная схема отопительных
1 Разновидности разводки отопления1.2 Однотрубная схема отопительных
Страница не найдена — evroterm32.com
Водопровод
Содержание1 Сп канализация наружные сети и сооружения: особенности, требования и монтаж1.1 Внутренняя канализация жилого
Скважины
Содержание1 Почему из скважины идет вода с песком: возможные причины и их решение1.
Насосные станции
Содержание1 Защита от сухого хода: выбор, подключение, настройка, принцип работы1.1 Принцип работы реле защиты от
Колодцы
Содержание1 Глиняный замок1. 1 Надежное и простое решение1.2 Почему именно глина?1.3 Обустройство глиняного замка1.4 Профессиональная
1 Надежное и простое решение1.2 Почему именно глина?1.3 Обустройство глиняного замка1.4 Профессиональная
Вопросы
Содержание1 Ремонт душевой кабины: как починить популярные поломки душ-кабины своими руками1.1 Обзор часто встречающихся
Дымоходы
Содержание1 Как чистить дымоход печи от сажи – варианты и средства1. 1 Причины появления сажи1.2
1 Причины появления сажи1.2
Страница не найдена — evroterm32.com
Вопросы
Содержание1 Как заделать свищ в пластиковых и металлических трубах1.1 Как заделать свищ1.2 Способы заделки
Насосные станции
Содержание1 Что делать, если насосная станция часто включается и выключается?1. 1 Устройство системы1.2 Регулятор давления1.3
1 Устройство системы1.2 Регулятор давления1.3
Насосы
Содержание1 Как правильно откачать выгребную яму?1.1 Способы откачки выгребной ямы1.2 Очистка выгребной ямы без
Бассейны
Содержание1 Как построить бассейн из поликарбоната своими руками?1.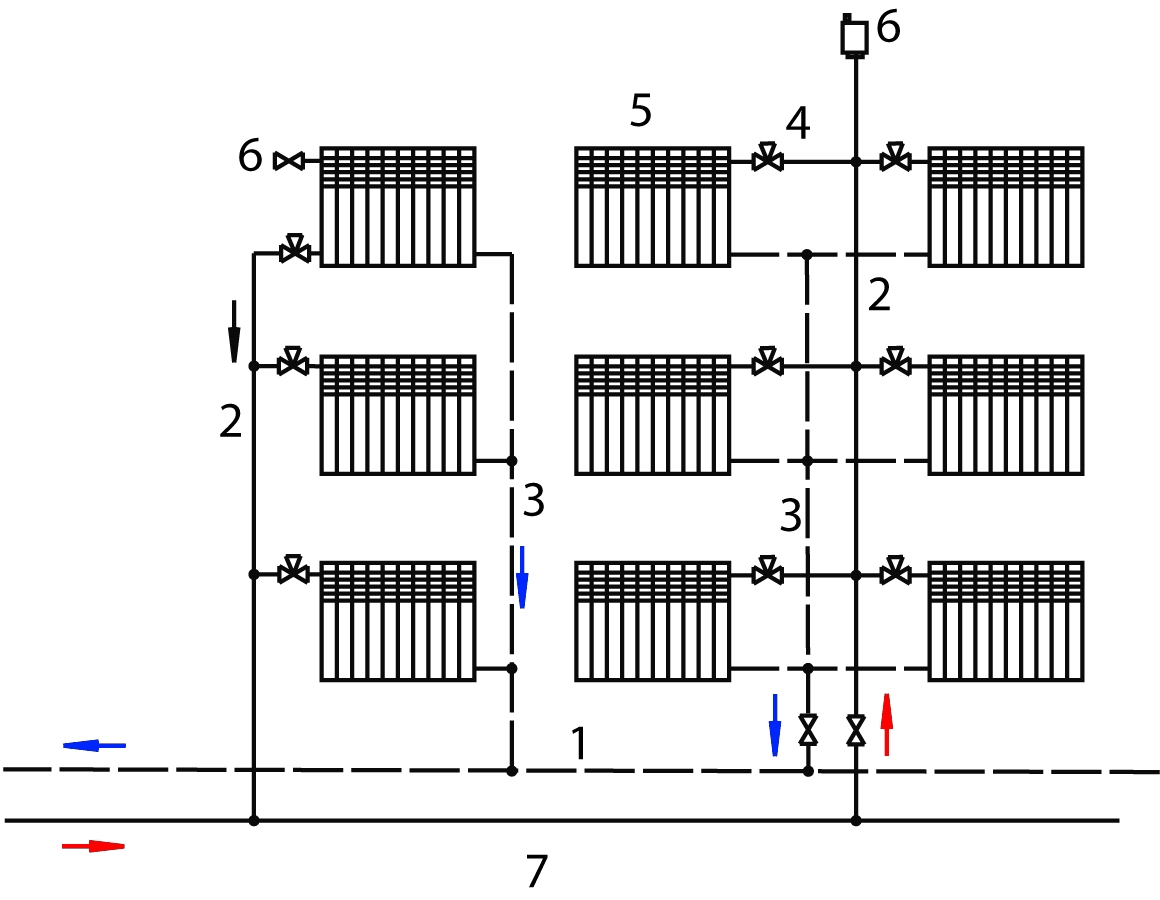 1 Назначение павильона1.2 Преимущества поликарбоната1.3 Классификация конструкций1.4
1 Назначение павильона1.2 Преимущества поликарбоната1.3 Классификация конструкций1.4
Пластик
Содержание1 Особенности использования водорозеток для металлопластиковых труб1.1 Что такое водорозетка1.2 Особенности конструкции1.3 Основные виды1.4
Дымоходы
Содержание1 Асбестовая труба для дымохода –особенности выбора и этапы монтажа1. 1 Основные характеристики и особенности
1 Основные характеристики и особенности
Системы отопления с верхней разводкой
При выборе способа подачи теплоносителя к радиаторам учитывают особенности планировки здания, которые определяются наличием подвалов, технических этажей и других подсобных помещений. Верхняя разводка системы отопления — организация обогрева жилья с трубами, расположенными под потолком или на чердаке. Первый вариант востребован в многоэтажных зданиях, а второй — в одноэтажных домах.
ТМ Ogint реализует в широком ассортименте оборудование и комплектующие элементы для монтажа отопительной сети с верхней разводкой. Представленные в продаже модели радиаторов и трубопроводная арматура производятся в соответствии с требованиями европейских стандартов и адаптированы к эксплуатации на территории России.
Особенности верхней разводки
Водяное отопление с верхней разводкой используется при отсутствии возможностей прокладки подающей и обратной магистралей с теплоносителем в стяжке, на уровне пола или в подвале. Востребован такой вариант подачи рабочей среды и при монтаже системы обогрева c естественной циркуляцией.
Востребован такой вариант подачи рабочей среды и при монтаже системы обогрева c естественной циркуляцией.
К преимуществам схемы отопления с верхней разводкой относятся:
- простота монтажа. Трубопровод можно скрыть в потолочных конструкциях или на чердаке, что улучшает эстетическое восприятие коммуникаций. При монтаже магистралей с теплоносителем под потолком следует учитывать размещение мебели, избегая закрывания патрубков;
- низкие потери тепла. Нагретый воздух в помещении поднимается вверх и компенсирует теплоотдачу труб, поэтому значительная часть тепловой энергии поступает в отопительные приборы;
- хорошие гидродинамические показатели. Используя аксонометрию и методику гидравлического расчета, можно спроектировать систему обогрева с минимальным количеством угловых поворотов и разветвлений.
Основные недостатки сети с верхней разводкой — рост расходов на приобретение материалов. Кроме того, возникает необходимость установки более мощного отопительного оборудования из-за увеличения объема теплоносителя.
Кроме того, возникает необходимость установки более мощного отопительного оборудования из-за увеличения объема теплоносителя.
В зависимости от конструктивных особенностей сеть с верхней подачей рабочей среды может быть однотрубной или двухтрубной.
Однотрубная система
В однотрубных системах с верхней разводкой теплоноситель подается к самой верхней точке, а затем распределяется по радиаторам. Они характеризуются последовательным подключением батарей, что приводит к зависимости степени нагрева от протяженности коммуникаций и невозможности регулировать температуру каждого отопительного прибора. При монтаже однотрубных сетей необходимо соблюдать уклон подающего трубопровода, который составляет 5-7 мм на 1 м.п. в сторону перемещения рабочей среды. Он улучшает циркуляцию теплоносителя и обеспечивает более равномерный нагрев помещений.
По расположению труб, соединяющих отопительные приборы, однотрубные системы бывают горизонтальными и вертикальными.
Вертикальная схема с верхней разводкой получила распространение при строительстве многоэтажных жилых зданий в начале 50-х годов прошлого века. Сегодня она востребована и в домах высотой 4-9 этажей и более, и в одноэтажных коттеджах площадью до 100 м2. Чтобы устранить недостатки системы и обеспечить эффективное потребление тепловой энергии, радиаторы однотрубной системы оснащаются следующей трубопроводной арматурой:
Сегодня она востребована и в домах высотой 4-9 этажей и более, и в одноэтажных коттеджах площадью до 100 м2. Чтобы устранить недостатки системы и обеспечить эффективное потребление тепловой энергии, радиаторы однотрубной системы оснащаются следующей трубопроводной арматурой:
Батареи для однотрубной сети с верхней разводкой подбирают, учитывая условия эксплуатации и величину давления в трубопроводе. Для многоквартирных домов с центральным отоплением подойдут биметаллические и чугунные модели, способные выдерживать значительные гидравлические удары. В одноэтажных зданиях устанавливают батареи из чугуна. Алюминиевые приборы отопления можно использовать при наличии контроля состава и уровня кислотности теплоносителя.
Двухтрубная сеть отопления
Двухтрубная система обогрева с верхней разводкой отличается параллельным подключением радиаторов и предусматривает наличие двух магистралей для транспортировки теплоносителя — подающей и обратной. По первой циркулирует нагретая рабочая среда, а вторая служит для отвода остывшей воды.
Для монтажа двухтрубной схемы потребуется больше материалов и комплектующих. Однако затраты и сложность проведения работ компенсируются следующими преимуществами:
- возможностью подключения системы «теплый пол»;
- равномерным распределением нагретого теплоносителя по всем приборам отопления;
- установкой регулирующей арматуры, как на обвязку радиаторов, так и на отдельные контуры.
В зависимости от способа перемещения рабочей среды двухтрубные системы разделяют на коммуникации с естественной и принудительной циркуляцией. Сети первого типа используются для организации обогрева помещений в частных домах, общая площадь которых составляет до 400 м2. Диаметр труб должен обеспечивать транспортировку теплоносителя с определенной скоростью. Чтобы правильно подобрать сечение трубопровода, производят расчет системы отопления. Сети с верхней разводкой и естественной циркуляцией должны оснащаться расширительным баком, который размещают в самой верхней точке. Обычно она находится на чердаке, поэтому корпус резервуара следует утеплять.
Обычно она находится на чердаке, поэтому корпус резервуара следует утеплять.
Принудительная циркуляция в сети отопления с верхней разводкой достигается двумя способами. В первом случае трубопровод комплектуется циркуляционным насосом и мембранным баком, который устанавливают на прямом участке обратной магистрали. Сети отопления такого типа служат для обогрева частных домов, поэтому для их монтажа можно использовать чугунные или алюминиевые радиаторы. При установке моделей из алюминия следует контролировать состав теплоносителя. В многоэтажных домах с центральным отоплением циркуляция обеспечивается за счет высокого давления в сети. Для длительного и бесперебойного функционирования коммуникаций подбирают батареи, которые отличаются устойчивостью к гидравлическим ударам.
Как устроено ХВС в многоэтажке — Добродушный Сантехник
Сегодня расскажу, как устроено холодное водоснабжение в многоэтажном доме.
Видео получилось длинным (во время экскурсии я отвлёкся на состояние труб и задвижек), но тем не менее посмотреть его стоит, чтобы и у обычного человека было понимание устройства коммуникаций.
Тем, кто проще воспринимает текст — всё то же самое в текстовом формате.
Как устроено холодное водоснабжение в многоквартирных домах
Водоканал подаёт воду в дома по огромным магистралям. Представим себе условную многоэтажку:
Спускаемся в подвал (не обращаем внимания на разбегающихся мышей) и видим две вводные трубы: одна на нижний розлив, вторая — на верхний:
В первой давление ниже (≈ 3 бара), чем во второй, потому что по нижней вода поднимается только до средины многоэтажки:А вот в верхнем розливе, там давление чуть ли не вдвое выше (≈ 7 бар). Именно по верхнему розливу вода поднимется на чердак и уже оттуда спускается стояками вниз, питая верхнюю половину дома. Собственно, из-за того, что труба питает верхнюю часть дома, она и называется — верхний розлив — разливается сверху.
На каждой из вводных «трубок» в подвале установлены счётчики, чтобы точно знать, сколько воды за месяц израсходовал дом. Эти вводы называют водомерными узлами. Вода из них не сразу идёт в стояки, а сначала попадает в большую магистраль, которая идёт по всему дому. Каждая вводная труба соединена со своей магистралью: одна с магистралью нижнего розлива, вторая — верхнего розлива.
Водомерный узел → Магистраль → Стояки
Но дом слишком длинный (в шесть раз длиннее нашей условной многоэтажки) и одного ввода воды было бы просто недостаточно. Поэтому в дом заведено несколько пар таких трубок, которые также соединяются с магистралями верхнего и нижнего розлива.
Водомерные узлы, как вы понимаете, приходится обслуживать с какой-то периодичностью. И для того, чтобы обеспечить непрерывную подачу воды, пока один из водомерных узлов отключён на обслуживание, сделана третья магистраль. Она соединена с магистралью верхнего розлива и называется «транзит».
Транзит
Не будь транзита, при отключении одного из водомеров верхнего розлива (а у нас их несколько на весь дом), в этой части дома верхние этажи останутся без воды.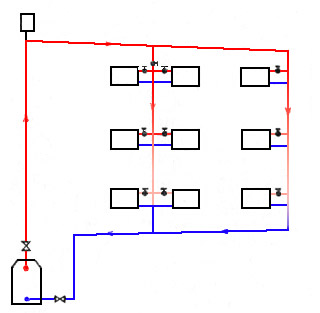 Давления оставшихся водомеров просто не хватит, чтобы подавать воду на верхние этажи на этом участке дома. Но таким приоритетом обладают только жители верхних этажей. Именно они при отключениях страдают меньше всего. У нижнего розлива нет транзита. Почему? Всё просто.
Давления оставшихся водомеров просто не хватит, чтобы подавать воду на верхние этажи на этом участке дома. Но таким приоритетом обладают только жители верхних этажей. Именно они при отключениях страдают меньше всего. У нижнего розлива нет транзита. Почему? Всё просто.
Почему нет транзита у нижнего розлива
Всё дело в пожарной безопасности. Для поднятия воды на чердак, используется не одна вертикальная труба, как схематично показано на рисунке выше. Используется много трубок, и эти трубки проходят через все коридоры каждого этажа. К этим трубам прикручены пожарные краны. Кое-где повешены пожарные рукава. Т. е. наши трубы не только питают верхние этажи, но и одновременно играют роль пожарных кранов. А оставлять пожарные трубы без воды недопустимо. Именно для безостановочной подачи воды в пожарные трубы и была установлена труба транзита. Таким образом, дело не в приоритете жителей верхних этажей, а в пожарной безопасности жителей каждого этажа.
Ну, а дальше — стояки через все квартиры.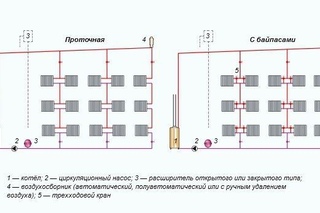 На стояках краны, ваши фильтры, счётчики… вот это всё.
На стояках краны, ваши фильтры, счётчики… вот это всё.
Отопление в многоквартирном доме нормы
Основной жилищный фонд городов бывшего СССР, и РФ в том числе, – это многоэтажные многоквартирные дома, от двух-трехэтажек до шестнадцатиэтажных зданий, тогда считавшихся высотными. Плюс к этому современное строительство давно запускает в эксплуатацию дома в несколько десятков этажей, и во всех этих многоквартирных домах функционирует не только центральное отопление, но и автономное. Стандартная схема отопления многоквартирного дома показана ниже: Стандартная схема центрального отопления многоэтажки
О централизованной системе отопления и схемах его реализации
ЦСО (центральная система отопления многоэтажного дома) никогда не отличалась особой эффективностью – по пути к потребителю и сейчас теряется до 30% тепла, которое потребителем же и оплачивается. Поэтому многие владельца квартир отказываются от ЦСО в пользу автономной системы ввиду ее бо́льшей эффективности и экономичности. Но как работает централизованный обогрев квартир, и можно ли его улучшить?
Но как работает централизованный обогрев квартир, и можно ли его улучшить?
Система разводки труб по дому схематично очень сложная, плюс подвод труб в жилой дом, и распределение тепла по районам. Только в одном отдельно взятом доме в схему включаются сотни вентилей, кранов, сливов, фитингов, распределителей и фланцев, которые работают на центральное оборудование – элеваторный узел, регулирующий раздачу тепла по дому. Элеваторный узел
[ads-pc-2]
[ads-mob-2]
Схемы подачи теплоносителя в отдельную квартиру с элеваторного узла бывают разными. Так, схема с нижним разливом использует принцип подачи теплоносителя по направлению снизу вверх. Те, кто живет в «брежневках», «хрущевках» и «сталинках», знают, как это работает.
В многоэтажном доме с такой схемой подачи теплоносителя подающая и обратная трубы монтируются по периметру дома, начиная с подвала, и выполняют роль перемычек между тепловыми магистралями. Такая схема представляет собой замкнутый цикл с началом и окончанием в подвале дома. Верхняя точка этой трубной разводки – самая высокая квартиры (квартиры) в доме.
Общедомовой узел учета тепловой энергии
Такая схема представляет собой замкнутый цикл с началом и окончанием в подвале дома. Верхняя точка этой трубной разводки – самая высокая квартиры (квартиры) в доме.
Общедомовой узел учета тепловой энергии
- Главный недостаток, от которого эта система отопления в многоквартирном доме так и не избавилась – обязательный спуск воздуха в самой верхней точке разводки при запуске системы. Для этого используют краны Маевского или обычные вентили. Если воздух не спустить, то воздушная пробка обязательно перекроет систему в какой-то произвольной точке, закрыв обогрев всему дому.
- Еще один минус схемы с нижним разливом – половина дома обогревается более горячими батареями (от трубы подачи теплоносителя), а вторая половина жильцов получает несколько охлажденный теплоноситель (бо́льшей частью – уже от обратки), и с этим ничего не поделаешь. Температурная разница особо заметна на нижних этажах дома.
Важно: Для тех, кто еще подключен к центральной системе отопления и живет на последнем этаже – не переносите кран Маевского на чердак, чтобы не возникло вопросов, в том числе и финансового порядка, к вам от вашего ЖКХ.
Тем более, что чердак не отапливается, и трубы могут просто размерзнуться и порваться.
Верхний розлив используется для более высоких домов, начиная с девятиэтажных зданий. Труба подачи теплоносителя не заходит в квартиры, а проводится на технический этаж – самый верхний, сразу после последнего жилого. На этом этаже размещается расширительная емкость, воздушный клапан и задвижки, при помощи которых отключаются нужные стояки в случае необходимости – ремонта или аварии. При организации схемы с верхним розливом тепло распределяется по квартирам равномернее, и раздача не зависит от того, на каком этаже и в каком подъезда находится квартира. Такая система отопления в многоквартирном доме схема которой представлена на рисунке ниже, является оптимальной для высотных домов.
Недостаток схемы один: после транспортировки по всем этажам многоквартирного многоэтажного дома теплоноситель до последней ветки раздачи тепла доходит остывшим, и увеличить теплоотдачу в квартире можно только увеличением количества секций в радиаторах по всей квартире. Схема отопления с нижним разливом
Схема отопления с нижним разливом
Регламент предоставления услуг центрального отопления многоквартирного дома оговаривает предельные значения температуры в квартире: во время отопительного сезона температура в жилых помещениях не должна быть меньше +200С, а в ванной или в совмещенном санузле +250С. Для кухни температурные порог меньше – до +180С, так как она практически всегда отапливается дополнительно – печью (газовой или электрической) для приготовления пищи.
Температурный графикВажно: все температурные требования применимы для квартир в центре дома. Для угловых и боковых квартир температура должна быть больше на 3 -50С.
Специалисты, работающие в этой сфере, утверждают, что центральное отопление в многоквартирном доме изживает себя, и наступает эра мини-котельных и автономных систем отопления. Но, пока это произойдет, приходится выбирать.
Об автономном отоплении
Автономная система отопления многоквартирного дома – мечта многих владельцев квартир, но процесс перехода на независимое отопление непрост и дорог. Это и длительные юридические хлопоты, и техническое решение вопроса – правильный подбор оборудования, монтаж и пуско-наладочные работы. И проблемы, связанные с технической реализацией проекта, намного проще.
Автономная котельная многоквартирного дома
Это и длительные юридические хлопоты, и техническое решение вопроса – правильный подбор оборудования, монтаж и пуско-наладочные работы. И проблемы, связанные с технической реализацией проекта, намного проще.
Автономная котельная многоквартирного дома
Рынок бытовой техники, в том числе и отопительной, предлагает широчайший ассортимент котлов, радиаторов, труб и всевозможных фитингов, и в каждом городе есть несколько десяткой специализированных компаний, работающих в этом направлении. Организация не только проделает всю монтажную и настроечную работу, но и оформит все необходимые акты и разрешения. Но дешевле всего, конечно, установить отопительный котел и развести трубы своими руками.
Основные документы, необходимые для того, чтобы подключить автономное отопление многоквартирного дома самостоятельно:
- Справка с обоснованием от эксплуатационной компании о том, что вы можете обогреть свою квартиру своими силами, и причиной отказа от централизованной системы отопления;
- Проект с техническими условиями по подключению автономной системы:
- Технические расчеты о целесообразности вашего автономного отопления и расчеты о том, что изменение общей схемы ЦСО не повредит отоплению дома в целом;
- Расчеты потребления тепла от остальных стояков в ЦОС по остаточному принципу;
- Заключение от эксплуатационной компании о том, что после монтажа вашей автономной отопительной системы теплогидравлический режим ЦОС не будет нарушен;
- Акт от пожарной инспекции;
- Разрешение от службы газа и от СЭС на отопление квартиры природным газом;
- Копии лицензий от компании, устанавливающей газовое оборудование – самостоятельное подключение газового котла запрещено.
 Своими силами вы можете только развести трубы и подключить радиаторы. Если котел электрический, то все работы можно проводить своими руками;
Своими силами вы можете только развести трубы и подключить радиаторы. Если котел электрический, то все работы можно проводить своими руками; - После установки котла, подключения отопления труб и радиаторов необходимо присутствие представителя местной службы газа для подключения котла и опломбирования счетчика и системы. Одновременно составляется договор на гарантийное и постгарантийное обслуживание котла.
Схема нарушений в работе ЦОС
Оформив все справки и акты, можно начинать практическое воплощение мечты в жизнь, и срезать радиаторы и трубы домовой или квартирной разводки ЦОС. И не забудьте перекрыть ввод теплопровода и опломбировать его. В домах, к которым подключена система центрального обогрева, сделать это проще, чем в многоэтажках – в многоквартирных домах стояки труб прокладывались по помещениям, и для их демонтажа придется заручиться согласием соседей сверху и снизу, а продолжение обрезанных труб – закольцевать.
Замена радиаторовВажно: Стояки, которые не подключены к вашим радиаторам, но проходят через квартиру, считаются источником тепла. Чтобы не платить за их тепловую энергию в ЖЭК, трубы следует хорошенько теплоизолировать – так вы сможете доказать, что не пользуетесь центральным отоплением.
Радиаторы и батареи для отопления квартиры или дома
Если индивидуальное отопление решено устанавливать, то работать без подвода газа оно двумя способами: включать электрические конвекторы, и смонтировать систему отопления с электрическим котлом и жидкостным теплоносителем. Локальный обогрев квартиры конвекторами эффективен только для небольших помещений. Если в квартире две и больше комнат, то оптимальным решением будет монтаж газового или электрического котла, особенно в высотный дом – для частного дома предпочтительнее твердотопливное оборудование.
Отопление посредством газа – самое выгодное во всех отношениях, и для его реализации рекомендуется приобрести двухконтурный котел для дома схема подключения которого такая же, как и котла с одним контуром, чтобы сразу обеспечить дом или квартиру и теплом, и горячей водой. Схема отопления газом
Схема отопления газом
На втором месте по эффективности использования энергоносителей стоят электрические котлы – их мощность примерно равна мощности газового оборудования. Электрические агрегаты также производятся с одним или двумя контурами, но их стоимость ниже стоимости газовых котлов. Но в этом есть и элемент подвоха – дальнейшая их эксплуатация показывает, что за энергоносители приходится платить больше.
Отдельным списком стоят котлы электродного типа. Их размеры позволяют размещать агрегат в квартире, стоимость сопоставима с ценами на газовое оборудование, но экономичность выше, чем у электрических котлов. Единственный, но существенный недостаток – в них нет второго контура, а значит, нельзя организовать ГВС.
разное по теме — Верхний и нижний розлив
Системы отопления с естественной циркуляцией бывают двух типов – системы с верхним розливом и с нижним розливом. Именно розлив (ударение на «о»), а не разлив. Так же существует конфигурация системы, в которой возможна гибридная схема — когда есть электричество, система работает от циркуляционного насоса, например насоса HOMA, а если электричество отключили, то циркуляция идет естественным путем.
Система отопления с верхним розливом имеет один главный подающий стояк. Он от котла поднимается к самой верхней точке системы отопления, затем от него в разные стороны разводятся плечи, от которых уже опускаются второстепенные стояки, проходящие мимо радиаторов. Главный стояк обычно делают из стальной трубы диаметром 40 – 50 миллиметров. Это необходимо для уменьшения сопротивления движению теплоносителю. Плечи делают уже меньшего диаметра для равномерного розлива теплоносителя во все стороны. Стояки, идущие к радиатора обычно выполняют из трубы трехчетвертного или полдюймового диаметров.
Главный признак системы отопления с верхним розливом – наличие одной подающей трубы большого диаметра. Главное — не перепутайте с канализационной трубой, которая подключается к фекальному насосу, а то в случае каких-либо манипуляций может быть не приятный сюрприз. 🙂
Система отопления с нижним розливом отличается от вышеописанной. Если нет возможности расположить толстые трубы где-нибудь на чердаке, чтобы осуществить верхний розлив, то подающую трубу пускают по периметру по низу, от нее поднимаются вверх подающие стояки. Их длина ограничивается высотой расположения самого верхнего радиатора отопления над стояком. После каждого стояка диаметр подающей трубы уменьшают.
Их длина ограничивается высотой расположения самого верхнего радиатора отопления над стояком. После каждого стояка диаметр подающей трубы уменьшают.
Признак схемы с нижним розливом – отсутствие основного стояка с большим диаметром и наличие стояков с диаметром около дюйма. Количество таких стояков обусловлено числом радиаторов и их расположением. Системы с нижним розливом отдаленно напоминают двухтрубные системы отопления, так как присутствуют подающие стояки на каждый набор радиаторов и обратные стояки, отводящие теплоноситель обратно в котел.
Заполните резервуар для микроблоков сверху или снизу, в чем разница? Разъяснение тайны:
Криогенные резервуары обычно заполняются сверху методом продувки. Метод продувки — это когда давление в резервуаре снижается путем сброса давления напора резервуара для его заполнения. Продувка резервуара приводит к потере продукта и, в свою очередь, стоит денег. Верхнее заполнение также требует отключения резервуара или неиспользования его во время заполнения, поскольку резервуар не может удерживать давление, что приводит к отключению клиента, использующего резервуар, и прекращению работы во время заполнения.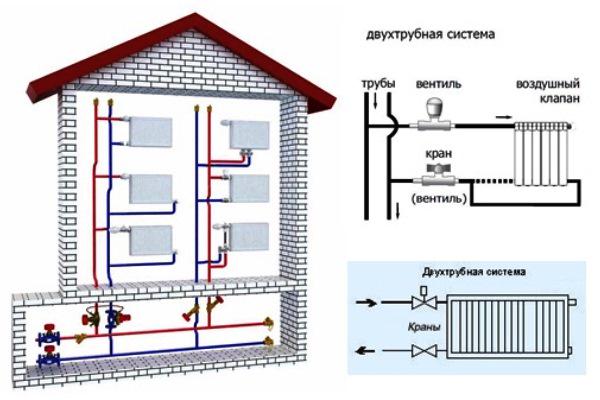 Однако бак Arctic Fox позволяет пользователю одновременно заполнять воду сверху и снизу, избавляя от необходимости использовать менее эффективный метод продувки. Метод нижнего заполнения поддерживает давление, позволяя пользователю поддерживать машину в рабочем состоянии и поддерживать ее работу, поскольку Arctic Fox поддерживает необходимое давление насоса для продолжения работы. Метод верхнего и нижнего наполнения не требует продувки резервуара и, следовательно, предотвращает потерю продукта во время процесса наполнения.
Однако бак Arctic Fox позволяет пользователю одновременно заполнять воду сверху и снизу, избавляя от необходимости использовать менее эффективный метод продувки. Метод нижнего заполнения поддерживает давление, позволяя пользователю поддерживать машину в рабочем состоянии и поддерживать ее работу, поскольку Arctic Fox поддерживает необходимое давление насоса для продолжения работы. Метод верхнего и нижнего наполнения не требует продувки резервуара и, следовательно, предотвращает потерю продукта во время процесса наполнения.
Для таких заказчиков, как предприятия лазерной резки, которые используют газообразный азот в своих станках для резки металлических изделий, резервуар Arctic Fox неоценим, поскольку он обеспечивает бесперебойную работу и производство на протяжении всего процесса наполнения. Поскольку возможность заполнения сверху и снизу поддерживает необходимый уровень давления во время процесса заполнения, пользователь может продолжать производство, не прекращая использование газа. Это обеспечивает бесперебойный период заполнения для клиента в отличие от процесса, требуемого для других резервуаров, которые полагаются на метод верхнего заполнения.
Это обеспечивает бесперебойный период заполнения для клиента в отличие от процесса, требуемого для других резервуаров, которые полагаются на метод верхнего заполнения.
Кроме того, для танка Arctic Fox предусмотрены различные варианты подключения. Такая гибкость позволяет подключать несколько типов грузовиков для наполнения цистерны, в том числе обычные микро-грузовики со стандартным криогенным шлангом и грузовики с полуторадюймовым шлангом. Таким образом, пользователи не ограничены в выборе грузовиков, которые они могут использовать для заправки своих цистерн.
На протяжении всего процесса оператор полностью контролирует давление насоса в резервуаре Arctic Fox. Благодаря возможности заполнения сверху и снизу заполнение происходит намного быстрее, чем при любом другом методе.Кроме того, пользователи могут быстро заполнить резервуары без использования специального патентованного насосного оборудования. Резервуар для песца спроектирован таким образом, чтобы его наполнение было непрерывным и эффективным.
С резервуаром Ratermann Manufacturing Arctic Fox Tank вы сможете максимизировать как производство, так и эффективность при минимальных затратах для компании вашего клиента. Функция наполнения резервуаров сверху и снизу Arctic Fox и продувочные вентиляционные отверстия открывают более разумный, быстрый и в целом более эффективный способ наполнения резервуаров, позволяя компаниям наполнять резервуары быстрее и доставлять больше грузов в день.(Чтобы просмотреть эту статью в формате PDF, нажмите здесь)
Нажмите здесь, чтобы посмотреть видео, показывающее особенности арктической лисы >>
Заполните эту форму, чтобы получить дополнительную информацию о Arctic Fox Tank:
Amazon.com: Увлажнители холодного тумана Homasy 4,5 л, увлажнители с верхним наполнением для спальни, тихий ультразвуковой увлажнитель 28 дБ для детской, увлажнитель свежего воздуха, спящий режим и автоматическое отключение, до 30 часов, All White: для дома и кухни
Это второй из этих увлажнителей, которые я купил. Я получил этот 28 марта 2020 года, чтобы заменить первый, который я купил в 2019 году, и мне пришлось использовать только около 2 месяцев, потому что он сильно заплесневел после того, как оставил в нем немного воды и не чистил его более неделю, в связи с госпитализацией моего отца, с последующим уходом на дому в хосписе, где я был его основным опекуном, пока он не умер от сердечной недостаточности. К тому времени, когда я попытался очистить его, плесень повредила его, поэтому мне пришлось выбросить его. Я связался с компанией по электронной почте и объяснил, что произошло, и спросил их, могу ли я что-нибудь сделать, чтобы починить увлажнитель, чтобы я мог продолжать его использовать, но я так и не получил от них ответа, поэтому я потерял почти 50 долларов, которые у меня были. заплатил за это.Но этот увлажнитель мне понравился настолько, что я купил второй. Мне просто хотелось, чтобы прозрачный синий резервуар был доступен / в наличии, когда я делал покупку, так как я получил бы его вместо того, у которого был непрозрачный белый резервуар.
Я получил этот 28 марта 2020 года, чтобы заменить первый, который я купил в 2019 году, и мне пришлось использовать только около 2 месяцев, потому что он сильно заплесневел после того, как оставил в нем немного воды и не чистил его более неделю, в связи с госпитализацией моего отца, с последующим уходом на дому в хосписе, где я был его основным опекуном, пока он не умер от сердечной недостаточности. К тому времени, когда я попытался очистить его, плесень повредила его, поэтому мне пришлось выбросить его. Я связался с компанией по электронной почте и объяснил, что произошло, и спросил их, могу ли я что-нибудь сделать, чтобы починить увлажнитель, чтобы я мог продолжать его использовать, но я так и не получил от них ответа, поэтому я потерял почти 50 долларов, которые у меня были. заплатил за это.Но этот увлажнитель мне понравился настолько, что я купил второй. Мне просто хотелось, чтобы прозрачный синий резервуар был доступен / в наличии, когда я делал покупку, так как я получил бы его вместо того, у которого был непрозрачный белый резервуар.
Что мне нравится в этом увлажнителе, так это то, что он наполняется спереди, вся верхняя часть резервуара поднимается, и вы можете заполнить резервуар галлоновым кувшином воды (я использую водопроводную воду), поэтому вам не нужно Отнесите бак в раковину, чтобы наполнить его, а затем нужно нести тяжелый полный бак обратно на базу, проливая немного воды по пути.
И его не так сложно чистить, как другие увлажнители (у меня был увлажнитель с теплым паром, который заполнен снизу, и его очень трудно очистить, так как минералы из жесткой воды сильно застревают на нагревательном элементе, и их трудно очистить. просуньте руку в отверстие, чтобы тщательно очистить внутреннюю часть резервуара). Но на дне резервуара для воды у него есть бесполезная и пустая штука, похожая на картридж, к которой прилипает грязь / минералы из воды, и ее нелегко очистить.Остальную часть бака легче чистить, а также легко содержать основание в чистоте. Ежедневно перед наполнением резервуара сливайте оставшуюся воду из базы, протирайте чистой тканью, смоченной раствором отбеливателя и воды. И чистить полностью раз в неделю.
И чистить полностью раз в неделю.
Но главная причина, по которой мне нравится этот увлажнитель с прохладным туманом, заключается в том, что минералы жесткой воды не сильно прилипают к распылителю, в то время как он, как сумасшедший, прилипает к нагревательному элементу увлажнителя с теплым туманом, вероятно, потому, что он не нагревает воду, поэтому минералы не конденсируются и не покрываются коркой на элементе.Так что больше не нужно замачиваться в уксусе на срок до одного дня плюс более получаса мытья, чтобы удалить корку на минералах жесткой воды.
Кажется, что он производит много тумана, но у меня нет измерителя влажности, чтобы проверить, значительно ли он повышает влажность в моей квартире, но, похоже, он производит достаточно влажности, чтобы кожа на моем лице не стала очень сухой. и пилинг, и это помогло мне остановить ежедневные кровотечения из носа. Поэтому я рекомендую этот увлажнитель воздуха, просто держите его в чистоте, и у вас не должно возникнуть проблем с ним.
Покупайте бак и распылитель с лучшим верхним наполнением у официальных дистрибьюторов бренда
Вообще говоря, почти все резервуары с самым высоким номинальным сопротивлением теперь являются устройствами для заполнения сверху. Топливные баки сейчас в моде, потому что это было очень удобно для наполнения электронного сока. Купите лучший верхний заправочный бак и распылитель у официальных дистрибьюторов бренда Urvapin.
Специальная цена 11,99 долл. США был 39,99 долл. США
Специальная цена 24 доллара.75 был 28,99 долл. США
Специальная цена 27,75 долл. США был 36,99 долл. США
Специальная цена 29,99 долл. США был 47,85 долл. США
Специальная цена 29,99 долл. США был 39,99 долл. США
Специальная цена 15,89 $ был 19,69 $
Специальная цена 25,75 долл.
 США был 36,99 долл. США
США был 36,99 долл. СШАСпециальная цена 32 доллара.95 был 39,99 долл. США
Специальная цена 29,99 долл. США был 34,99 доллара США
Специальная цена 55,89 $ был 68,99 долл. США
Специальная цена 24,99 доллара США был 29,99 долл. США
Специальная цена 19,69 $ был 23,90 долл. США
Специальная цена 18,75 долл. США был 22,85 долл. США
Специальная цена 19 долларов.75 был 28,99 долл. США
Специальная цена 15,99 долл. США был 23,99 доллара США
Специальная цена 28,75 долл. США был 36,90 долл. США
Специальная цена 22,75 $ был 25,99 долл. США
Специальная цена 19,89 $ был 29,69 долл.
 США
СШАСпециальная цена 23,99 доллара США был 27,00 долл. США
Специальная цена 23 доллара.85 был 25,89 $
Специальная цена 23,79 $ был 27,89 $
Специальная цена 26,89 $ был 29,89 $
Специальная цена 27,69 $ был 29,89 $
Ультразвуковой увлажнитель воздуха с верхним наполнением для древесины MO-HF007 MO-HF007 | Life on Products, Inc.
Бак для воды с антибактериальным покрытием
99.9% антибактериальный уровень, он принимает антибактериальный бак с ионом серебра.
Сертифицировано SIAA
Знаки SIAA означают сертификацию и соответствие руководящим принципам ISO22196. Этот знак предназначен для раскрытия информации о качестве и безопасности.
Чистота, пригодная для тщательной стирки
Доступен для снятия деталей в резервуаре для воды, чтобы вы могли тщательно промыть. Он всегда остается чистым.
Увлажнитель с верхним заполнением
Увлажнитель с верхним заполнением позволяет легко подавать воду. Вы можете узнать количество воды через окно с первого взгляда.
Вы можете узнать количество воды через окно с первого взгляда.
Умный корпус простого дизайна
Конструкция, в которой резервуар для воды совмещен с корпусом. Хотя внешний вид кажется компактным, в нем есть емкость 2,5 л. Элегантная форма подойдет к вашей комнате.
Приставная ароматическая тарелка
У него есть ароматический лоток, в который вы можете бросить свое любимое ароматическое масло и наслаждаться.Туман и аромат разносятся по воздуху.
20 Приготовление пищи, которая сдерживает голод
Факт: голод — это чудовище. Пытаетесь ли вы похудеть или просто дожидаетесь с завтрака до обеда, ваши дни намного лучше провести, когда вас не мучает урчание в животе.
Пытаетесь ли вы похудеть или просто дожидаетесь с завтрака до обеда, ваши дни намного лучше провести, когда вас не мучает урчание в животе.
К счастью, есть много продуктов, которые обладают тремя отличными качествами: богатые питательными веществами, умеренно калорийные и превосходно сытные.А главное, они на самом деле очень вкусные.
Вот несколько наших любимых.
Авокадо, самый важный фрукт тысячелетия, богат полезными жирами и клетчаткой, поэтому он может поддерживать вас в течение длительного времени. Он также может добавить наполнение другим продуктам, которые могут быть не такими вкусными, как тосты.
Греческий йогурт — это густой, богатый белком йогурт, содержащий пробиотические бактерии, которые могут улучшить здоровье пищеварительной системы.
Для максимальной сытости выберите полножирный греческий йогурт.Новое исследование показывает, что жирные молочные продукты могут быть лучше для некоторых аспектов здоровья, чем обезжиренные молочные продукты, и они содержат конъюгированную линолевую кислоту (CLA), жир, который может помочь вам почувствовать сытость.
Киноа («кин-вау» — пожалуйста) — это зерно, похожее на рис. Он идеально жевательный и имеет мягкий вкус, поэтому вы можете использовать его вместо риса в любом рецепте или даже съесть на завтрак.
Лучше всего то, что в нем больше белка, больше клетчатки и меньше калорий, чем в коричневом рисе. Звучит как беспроигрышный вариант.
Малина содержит относительно мало сахара и много клетчатки, поэтому это действительно сытный фрукт. В целой чашке (123 грамма) всего 64 калории и целых 8 граммов клетчатки.
Добавьте к нему немного темного шоколада, чтобы получить по-настоящему изысканный перекус.
Масло MCT состоит из жиров, называемых триглицеридами со средней длиной цепи. Масло MCT обычно получают из кокосового масла и является жидким при комнатной температуре. Исследования показывают, что масло MCT может помочь вам чувствовать себя более удовлетворенным и потреблять меньше калорий в течение дня.
Попробуйте добавить масло MCT в смузи, овсянку, кофе и заправки для салатов, чтобы получить полную дозу полезных жиров. Нет необходимости полностью отказываться от жира, поскольку приготовление пищи с использованием жира помогает вам усваивать больше питательных веществ (и улучшает вкус пищи).
Нет необходимости полностью отказываться от жира, поскольку приготовление пищи с использованием жира помогает вам усваивать больше питательных веществ (и улучшает вкус пищи).
Мы знаем, знаем: печень? Действительно?
Но на самом деле паштет — один из самых простых и вкусных способов есть печень, которую (по праву) называют «природными поливитаминами».
Намаженный на некоторые цельнозерновые крекеры, паштет является идеальной закуской, которая на некоторое время сохранит чувство сытости благодаря сочетанию жира и белка.
Комбинация протеина и противовоспалительных жиров омега-3, содержащаяся в лососе, на некоторое время сохранит чувство сытости, а рыба чрезвычайно универсальна.
Добавляйте его в салаты, готовьте на гриле (чтобы получился самый здоровый стейк, который вы когда-либо будете есть), сделайте из него гамбургеры или котлеты из лосося (и полейте их заправкой или соусом с маслом MCT для дополнительного насыщения) .
Нут — отличный источник веганского белка. В сочетании с цельнозерновыми (например, пшеничным хлебом) они представляют собой полноценный белок, содержащий все девять незаменимых аминокислот.Хумус и лаваш, кто-нибудь?
В сочетании с цельнозерновыми (например, пшеничным хлебом) они представляют собой полноценный белок, содержащий все девять незаменимых аминокислот.Хумус и лаваш, кто-нибудь?
Вы также можете использовать нут для приготовления фалафеля, есть его в качестве автономного источника белка или гарнира или использовать муку из нута, чтобы добавить протеин в выпечку. Конечно, мы любим хумус, но эти универсальные бобы полезны для гораздо большего!
Причина, по которой семена чиа делают потрясающий пудинг, по той же причине, по которой они могут помочь вам какать: в присутствии жидкости они превращаются в гель. Еще одно преимущество этого: они очень медленно распадаются, сохраняя чувство сытости.
Попробуйте добавить семена чиа в салаты, чтобы получить хруст, или приготовьте пудинг из семян чиа, чтобы получить полезное и сытное сладкое лакомство.
Отнеситесь к этому с недоверием, но некоторые исследования показывают, что олеиновая кислота, содержащаяся в оливковом масле, может помочь регулировать аппетит и потенциально предотвратить увеличение веса.
Попробуйте использовать оливковое масло для придания аромата своим блюдам, сбрызнув им салаты или обжарьте овощи в оливковом масле и чесноке, чтобы придать им пикантный вкус.
Вы, возможно, помните (с любовью или нет) дневной завтрак людей, сидящих на низкожирной диете в 80-х и 90-х годах: половина грейпфрута с ложкой творога на вершине.
Хотя теперь мы лучше понимаем важность жира, творог по-прежнему остается отличным выбором для сытной закуски. Соедините его с фруктами с высоким содержанием клетчатки, такими как малина (или грейпфрут, если хотите вернуться в 90-е годы), чтобы получить быстрый и сытный завтрак.
Вы не должны удивляться, увидев яйца в этом списке. Это недорогой и здоровый источник белка, жира и холина, стимулирующего работу мозга.
Нужен простой способ сделать завтрак из овсянки более сытным? Вбейте в него яйцо, подсластите его, как обычно, и поставьте в микроволновую печь еще на минуту.
Вы вряд ли заметите яйцо, и ваш желудок отблагодарит вас, промолчав до обеда.
Шпинат содержит много воды, которая быстро готовится, поэтому гора сырого шпината превращается примерно в половину наперстка приготовленного шпината. Однако это также означает, что вы можете съесть ТОННУ шпината при очень небольшом количестве калорий.
Из молодого шпината получается идеальный зеленый салат, а сочетание его с винегретом на основе оливкового масла увеличивает коэффициент наполнения и помогает вашему организму лучше усваивать многие питательные вещества, содержащиеся в шпинате.
Картофель действительно сытный по сравнению с другими крахмальными продуктами, такими как рис и макаронные изделия. Это включает в себя белый картофель (ах!), Который вам, возможно, сказали, что это буквально зло.
Белый картофель на самом деле так же полезен, как и сладкий картофель, его апельсиновые кузены, которые пользуются всей любовью. Но насколько полезен картофель, зависит от того, как он приготовлен — лучше отдавайте предпочтение жареному или печеному картофелю, а не картофелю фри с чипсами.
Если лосось кажется вам слишком сильным на вкус, тунец — хороший способ включить рыбу в свой рацион.Будь то свежие или консервированные, они богаты нежирным белком.
Чтобы быстро и сытно перекусить, выберите банку приправленного тунца в оливковом масле. Залейте им салатную зелень, добавьте наполнитель из углеводов, например, приготовленный нут, и наслаждайтесь!
Как и малина, клубника на удивление мало содержит сахара и калорий и помогает сохранять сытость.
В целой чашке (144 грамма) меньше 50 калорий. Сверху полейте взбитыми сливками с высоким содержанием CLA (настоящими), чтобы получилась сытность.
Как и шпинат, простая капуста полна воды и клетчатки, низкокалорийна и действительно универсальна.
Используйте его, чтобы добавить объем практически к любой еде, сырой или приготовленной. Из сырой капусты, мелко нашинкованной, можно приготовить салат из капусты — легкий гарнир, который можно приготовить за 5 минут.
Квашеная капуста, содержащаяся в кимчи и квашеной капусте, является отличным источником пробиотиков, которые могут помочь регулировать гормоны голода.
Что ни говори о красном мясе, но признай, что ужин со стейком действительно сытный.
Удаление видимого жира помогает снизить количество калорий.В 113 граммах рибай без видимого жира всего 190 калорий и 23 грамма белка. В качестве бонуса стейк — отличный источник легко усваиваемого железа, витамина B-12 и цинка.
Вместо того, чтобы отпускать глупых «веселых парней», мы скажем так: грибы — это крошечные источники питания. Они богаты клетчаткой и превосходно сытны и являются отличной вегетарианской альтернативой мясу.
Некоторые грибы, например шиитаке, богаты антиоксидантами, которые могут улучшить общее самочувствие. Попробуйте вяленое мясо с грибами, чтобы получить соленую, жевательную и сытную веганскую закуску.
Подорожник полон стойкого крахмала — уникального волокна, которое действительно помогает сжигать жир.
Чтобы быстро и сытно поесть, нарежьте подорожник, посыпьте его любимым сыром (лучше всего подойдут белые сыры, такие как моцарелла или оахака) и жарьте, пока сыр не расплавится.
Вопросы и ответы о текущей надлежащей производственной практике — производство и контроль процессов
- Требуют ли CGMP, чтобы фирма сохраняла ярлыки идентификации статуса оборудования вместе с записью партии или другим файлом? Предполагая, что каждая основная единица оборудования имеет уникальный журнал очистки и использования, который должным образом хранится, допустимо ли выбросить эти ярлыки с краткой справкой об оборудовании ?
- Можно ли брать пробы тары, укупорочных средств и упаковочных материалов для проверки поступления на склад?
- У фирмы несколько сбоев при заполнении носителя.Они заполняли свои среды, используя TSB (триптический соевый бульон), приготовленный фильтрованием через стерилизующий фильтр 0,2 микрона. Следствие не выявило очевидных причин.
 Что могло быть источником заражения?
Что могло быть источником заражения? - Некоторые продукты, такие как трансдермальные пластыри, производятся с использованием производственных процессов с более высокой степенью брака материала в процессе производства, чем для других продуктов и процессов. Это нормально?
- Требуются ли для CGMP три успешных партии валидации процесса, прежде чем новый активный фармацевтический ингредиент (API) или готовый лекарственный продукт будет выпущен для распространения?
- Приемлемо ли с точки зрения CGMP, чтобы производитель стерильных лекарственных препаратов, произведенных путем асептической обработки, полагался исключительно на ISO 14644-1 и ISO 14644-2 при аттестации своего предприятия?
- В 2004 году FDA выпустило руководство под названием PAT — A Framework for Innovative Pharmaceutical Development, Manufacturing, and Quality Assurance , которое побудило промышленность модернизировать производство за счет улучшения управления процессами.
 Как я могу внедрить PAT (технология анализа процессов)?
Как я могу внедрить PAT (технология анализа процессов)? - Как мне связаться с CDER с вопросами о PAT?
- Как мне связаться с CBER с вопросами о PAT?
- Какова допустимая частота заполнения носителя по отношению к количеству смен? Обычно заполнение носителем следует повторять дважды за смену на строку в год. Ожидается ли такая же частота процесса, проводимого в изоляторе?
- Почему FDA обеспокоено наличием антисептических препаратов для местного применения?
- Какие конкретные правила CGMP могут быть полезны производителям антисептических препаратов для местного применения?
- Как производители могут оценивать и устранять риск микробиологического заражения антисептиков местного действия?
- Может ли Leptospira видов проникать через фильтры стерилизующего класса? Если да, то что производители должны иметь в виду в своих постоянных усилиях по управлению рисками жизненного цикла для обеспечения микробиологического контроля?
- FDA отозвало проект руководства для промышленности по порошковым смесям и готовым дозированным единицам — отбор проб и оценка стратифицированных производственных единиц дозирования .
 Что больше всего беспокоило Агентство в этом руководстве?
Что больше всего беспокоило Агентство в этом руководстве? - Почему FDA заботится о правильном отборе проб смесей порошков?
- Какие рекомендуемые инновационные подходы к обеспечению адекватности смешивания порошковых смесей?
- Каковы рекомендации Агентства в отношении стратифицированного отбора проб готовых дозированных единиц в процессе?
- Для нестерильного компендиального лекарственного препарата, который включает в себя противомикробный консервант в своей формулировке, могу ли я выпустить и продать партии этого лекарственного препарата с исходным общим аэробным подсчетом, выходящим за пределы спецификации, если через 2 недели эти партии будут протестированы в соответствии со спецификацией?
- Нужно ли производителям фармацевтических препаратов иметь письменные процедуры для предотвращения роста нежелательных микроорганизмов в лекарственных препаратах, которые не должны быть стерильными? Что в любом случае означает нежелательный ?
- Для лекарственных препаратов, в состав которых входят консерванты для подавления роста микробов, необходимо ли проверять консерванты в рамках тестирования выпуска партии и стабильности?
1. Требуют ли CGMP, чтобы компания сохраняла идентификационные ярлыки состояния оборудования вместе с записью партии или другим файлом? Предполагая, что каждая основная единица оборудования имеет уникальный журнал очистки и использования, который должным образом хранится, допустимо ли выбросить эти ярлыки с краткой справкой для оборудования ?
Требуют ли CGMP, чтобы компания сохраняла идентификационные ярлыки состояния оборудования вместе с записью партии или другим файлом? Предполагая, что каждая основная единица оборудования имеет уникальный журнал очистки и использования, который должным образом хранится, допустимо ли выбросить эти ярлыки с краткой справкой для оборудования ?
Правила CGMP для готовых фармацевтических препаратов требуют сохранения журналов очистки и использования неспециализированного оборудования, но не существует аналогичных требований для сохранения того, что должно быть быстрой справкой или временными ярлыками статуса.Примеры таких меток состояния включают в себя партия смешивания ###; чистые, готовые к эксплуатации по состоянию на д / м / у; и не чистые . Мы не видим никакой пользы в сохранении таких этикеток в дополнение к необходимому журналу оборудования или документации партии. Этикетки служат ценной временной цели, позволяющей точно определить текущее состояние оборудования и обрабатываемого материала. Любая метка состояния должна быть правильной, разборчивой, легко видимой и относиться к нужному элементу оборудования.Информация на ярлыке временного статуса должна соответствовать информации, записанной в журнале очистки и использования оборудования, или предыдущей записи партии для неспециализированного оборудования.
Любая метка состояния должна быть правильной, разборчивой, легко видимой и относиться к нужному элементу оборудования.Информация на ярлыке временного статуса должна соответствовать информации, записанной в журнале очистки и использования оборудования, или предыдущей записи партии для неспециализированного оборудования.
Ярлыки — это всего лишь один из способов отображения информации о временном состоянии единицы оборудования. Считается приемлемой практикой отображать временную информацию о состоянии оборудования на досках для сухого стирания или классных досках. И следователю FDA было бы целесообразно убедиться, что информация на ярлыке временного статуса соответствует журналу.
Артикул:
- 21 CFR 211.182: Журнал очистки и использования оборудования
- 21 CFR 211.105: Идентификация оборудования
К началу
2. Можно ли брать пробы тары, укупорочных средств и упаковочных материалов для проверки поступления на складе?
Можно ли брать пробы тары, укупорочных средств и упаковочных материалов для проверки поступления на складе?
Да. Как правило, мы считаем, что отбор проб на складе типичного предприятия по производству лекарственных средств не представляет риска для тары или закрытия и не влияет на целостность результатов пробы.Но нарушает ли процесс сбора пробы на складе требование CGMP о том, что контейнеры «открываются, отбирают пробы и запечатывают таким образом, чтобы предотвратить загрязнение их содержимого …», будет зависеть от предполагаемых качественных характеристик материала, указанного в образец и складская среда. Для контейнеров или укупорочных средств, предположительно стерильных или депирогенизированных, отбор проб должен производиться в условиях, эквивалентных заявленному качеству материала: складской среды будет недостаточно (см. 21 CFR 211.94 и 211.113 (б)). Это необходимо для сохранения пригодности к использованию оставшихся контейнеров или укупорочных средств, а также для обеспечения целостности образцов, если они должны быть исследованы на микробное загрязнение. Как минимум, любой отбор проб должен производиться таким образом, чтобы ограничить воздействие окружающей среды во время и после того, как образцы были удалены (т. Е. Протирать внешние поверхности, ограничивать время открытия оригинальной упаковки и должным образом закрывать оригинальную упаковку). Грамотно написанные и соблюдаемые процедуры являются критическими элементами.
Как минимум, любой отбор проб должен производиться таким образом, чтобы ограничить воздействие окружающей среды во время и после того, как образцы были удалены (т. Е. Протирать внешние поверхности, ограничивать время открытия оригинальной упаковки и должным образом закрывать оригинальную упаковку). Грамотно написанные и соблюдаемые процедуры являются критическими элементами.
Обратите внимание, что CGMP в 21 CFR 211.84 разрешает производителю выпускать для использования партию контейнеров или укупорочных средств на основе сертификата анализа поставщика и визуальной идентификации контейнеров или укупорочных средств. Как только надежность поставщика будет подтверждена путем подтверждения результатов их испытаний, производитель может полностью провести визуальный осмотр на складе.
Артикул:
- 21 CFR 211.84: Тестирование и одобрение или отклонение компонентов, контейнеров для лекарственных препаратов и укупорочных средств
- 21 CFR 211.
 94: Контейнеры и укупорочные средства для лекарственных препаратов .
94: Контейнеры и укупорочные средства для лекарственных препаратов . - 21 CFR 211.113 (b): Контроль микробиологического загрязнения
- 21 CFR 211.122: Исследование материалов и критерии использования
К началу
3. У компании несколько сбоев при заполнении носителя. Они заполняли свои среды, используя TSB (триптический соевый бульон), приготовленный фильтрованием через стерилизующий фильтр 0,2 микрона. Следствие не выявило очевидных причин. Что могло быть источником заражения?
У фирмы было несколько сбоев при заполнении носителя.Циклы заполнения сред, имитирующие процесс заполнения во время производства, проводились внутри изолятора. Фирма использовала TSB (нестерильный сыпучий порошок) из коммерческого источника и приготовила стерильный раствор путем фильтрации через стерилизующий фильтр 0,2 микрона. Было начато расследование по выявлению источника заражения. В ходе расследования не удалось изолировать или восстановить контаминирующий организм с использованием обычных микробиологических методов, включая использование селективных (например, селективных).g., кровяной агар) и неселективных (например, TSB и триптический соевый агар) сред, а также исследование под микроскопом. В конечном итоге с помощью последовательности гена 16S рРНК было идентифицировано загрязняющее вещество Acholeplasma laylawii . Впоследствии компания провела исследования, чтобы подтвердить присутствие Acholeplasma laylawii в партии использованного TSB. Следовательно, это было загрязнение не из процесса, а из источника в СМИ.
В ходе расследования не удалось изолировать или восстановить контаминирующий организм с использованием обычных микробиологических методов, включая использование селективных (например, селективных).g., кровяной агар) и неселективных (например, TSB и триптический соевый агар) сред, а также исследование под микроскопом. В конечном итоге с помощью последовательности гена 16S рРНК было идентифицировано загрязняющее вещество Acholeplasma laylawii . Впоследствии компания провела исследования, чтобы подтвердить присутствие Acholeplasma laylawii в партии использованного TSB. Следовательно, это было загрязнение не из процесса, а из источника в СМИ.
Acholeplasma laylawii принадлежит к отряду Mycoplasma . Mycoplasma содержит только клеточную мембрану и не имеет клеточной стенки. Они не чувствительны к бета-лактамам и не окрашиваются по Граму. Отдельные организмы плеоморфны (принимают различные формы от кокков до палочек и нитей), их размер варьируется от 0,2 до 0,3 мкм или меньше. Было показано, что Acholeplasma laylawii способна проникать через фильтр 0,2 мкм, но задерживается фильтром 0,1 мкм (см. Sundaram, Eisenhuth, et al. 1999). Известно, что Acholeplasma laylawii связана с материалом животного происхождения, а микробиологические среды часто поступают из животных источников.Для мониторинга окружающей среды Mycoplasma требуется селективная среда (бульон PPLO или агар).
Было показано, что Acholeplasma laylawii способна проникать через фильтр 0,2 мкм, но задерживается фильтром 0,1 мкм (см. Sundaram, Eisenhuth, et al. 1999). Известно, что Acholeplasma laylawii связана с материалом животного происхождения, а микробиологические среды часто поступают из животных источников.Для мониторинга окружающей среды Mycoplasma требуется селективная среда (бульон PPLO или агар).
Разрешение:
На данный момент эта фирма решила отфильтровать подготовленный TSB для использования в наполнителях среды через фильтр 0,1 микрон (примечание: мы не ожидаем и не требуем от фирм регулярно использовать фильтры 0,1 микрон для подготовки среды). В будущем компания будет использовать стерильный облученный TSB, когда он станет доступным у коммерческого поставщика. (Автоклав фирмы слишком мал, чтобы разрешить обработку TSB для наполнения сред, поэтому этот вариант не был жизнеспособным.) Фирма продолжит мониторинг на предмет Mycoplasma и повторно утвердила свою процедуру очистки, чтобы проверить ее удаление.![]() В этом случае тщательное расследование, проведенное фирмой, привело к определению причины сбоя и принятию соответствующих корректирующих действий.
В этом случае тщательное расследование, проведенное фирмой, привело к определению причины сбоя и принятию соответствующих корректирующих действий.
Артикул:
- 21 CFR 211.113: Контроль микробиологического загрязнения
- 21 CFR 211.72: Фильтры
- 21 CFR 211.84 (d) (6): Тестирование и одобрение или отклонение компонентов, контейнера для лекарственного препарата и укупорочных средств
- Сундарам, С., Дж. Эйзенхут, Дж. Ховард и Х. Брандвайн, 1999, Применение мембранной фильтрации для удаления миниатюрных организмов с биологической нагрузкой в фармацевтических продуктах и процессах, PDA J Pharm Sci Technol, 53 (4): 186–201
- Конг, Ф., Дж. Джеймс, С. Гордон, А. Зекински и Г.Л. Гилберт, 2001, ПЦР для конкретных видов для идентификации распространенных контаминантных молликутов в клеточной культуре, Appl Environ Microbiol, 67 (7): 3195–3200
- Мюррей, П., Э. Барон, М. Пфаллер, Ф. Теновер и Р. Йолкен, 1995, Руководство по клинической микробиологии, 6-е изд.
 , Вашингтон, округ Колумбия: ASM Press
, Вашингтон, округ Колумбия: ASM Press
Дата: 18.05.2005
В начало
4. Некоторые продукты, такие как трансдермальные пластыри, изготавливаются с использованием производственных процессов с более высокими показателями брака материала в процессе производства, чем для других продуктов и процессов. Это нормально?
Может быть. Это зависит от причины и постоянства отклонения. Многие процессы производства трансдермальных пластырей производят больше отходов (т.е. меньший выход по сравнению с теоретическим), чем другие фармацевтические процессы.Само по себе это не должно вызывать беспокойства. Отходы обычно возникают из-за кумулятивного эффекта сращивания валков, запусков и остановок линии, смены рулонного материала и, возможно, более высоких темпов отбора проб в процессе. Наиболее ярко это проявляется в процессах ламинирования валков из различных слоев компонентов. Например, дефекты рулонного материала, обнаруженные во время нанесения на рулон клеевого покрытия, часто могут быть удалены с рулона только после окончательного изготовления / ламинирования всей накладки, что способствует окончательному потоку технологических отходов.
Например, дефекты рулонного материала, обнаруженные во время нанесения на рулон клеевого покрытия, часто могут быть удалены с рулона только после окончательного изготовления / ламинирования всей накладки, что способствует окончательному потоку технологических отходов.
Мы ожидаем, что проверенные и хорошо контролируемые процессы позволят достичь стабильного количества отходов от партии к партии. Отходы, превышающие нормальные рабочие нормы, могут нуждаться в оценке (см. 21 CFR 21.192) для определения причины (например, из-за увеличения количества проб или дефектов компонентов, превышающих нормальные … или того и другого) и последствий для качества продукции. Мы видели небольшое количество случаев, когда необычно высокий уровень брака / потерь внутри партии был вызван чрезмерной изменчивостью качества компонентов и плохо разработанными процессами.
Артикул:
21 CFR 211.100: Письменные процедуры; отклонения
21 CFR 211.
 103: Расчет доходности
103: Расчет доходности21 CFR 211.110: Отбор проб и тестирование материалов и лекарственных препаратов в процессе производства
21 CFR 211.192: Обзор производственной документации
К началу
5. Требуются ли для CGMP три успешных партии валидации процесса, прежде чем новый активный фармацевтический ингредиент (API) или готовый лекарственный продукт будет выпущен для распространения?
№Ни правила CGMP, ни политика FDA не указывают минимальное количество партий для проверки производственного процесса. Текущее руководство FDA по API (см. Руководство для отраслевых ICH Q7 для API) также не указывает конкретное количество партий для валидации процесса.
FDA признает, что проверка производственного процесса или изменение процесса не может быть сведено к такой упрощенной формуле, как завершение трех успешных полномасштабных партий. Агентство признает, что идея трех проверочных партий стала широко распространенной отчасти из-за формулировок, использованных в прошлых руководствах Агентства.В руководстве FDA по валидации процессов теперь рекомендуется подход, основанный на жизненном цикле продукта. Акцент при демонстрации валидированных процессов делается на исследованиях процесса проектирования и разработки, проводимых производителем, в дополнение к демонстрации воспроизводимости в масштабе — цели, которая всегда ожидалась.
Агентство признает, что идея трех проверочных партий стала широко распространенной отчасти из-за формулировок, использованных в прошлых руководствах Агентства.В руководстве FDA по валидации процессов теперь рекомендуется подход, основанный на жизненном цикле продукта. Акцент при демонстрации валидированных процессов делается на исследованиях процесса проектирования и разработки, проводимых производителем, в дополнение к демонстрации воспроизводимости в масштабе — цели, которая всегда ожидалась.
Однако минимальное количество партий на соответствие (также называемых валидацией), необходимое для валидации производственных процессов, не указано. Ожидается, что у производителя будет веское обоснование своего выбора в этом отношении.Агентство поощряет использование научно обоснованных подходов к валидации процессов.
В марте 2004 г. FDA пересмотрело Руководство по политике соответствия (CPG), разд. 490.100 на Требования к валидации процессов для лекарственных препаратов и активных фармацевтических ингредиентов, подлежащих предварительному утверждению . CPG описывает концепцию, согласно которой после выявления и установления контроля над всеми критическими источниками изменчивости готовятся партии соответствия, чтобы продемонстрировать, что при нормальных условиях и рабочих параметрах процесс приводит к производству приемлемого продукта.Успешное завершение начальных пакетов соответствия обычно ожидается до начала коммерческого распространения, но некоторые возможные исключения описаны в CPG. Например, хотя CPG конкретно не упоминает параллельную валидацию для API в дефиците, Агентство рассмотрит возможность использования параллельной валидации, когда это необходимо для решения ситуации истинной нехватки, и если исследование параллельной валидации соответствует условия, указанные в CPG (см. параграф 4, ac).
CPG описывает концепцию, согласно которой после выявления и установления контроля над всеми критическими источниками изменчивости готовятся партии соответствия, чтобы продемонстрировать, что при нормальных условиях и рабочих параметрах процесс приводит к производству приемлемого продукта.Успешное завершение начальных пакетов соответствия обычно ожидается до начала коммерческого распространения, но некоторые возможные исключения описаны в CPG. Например, хотя CPG конкретно не упоминает параллельную валидацию для API в дефиците, Агентство рассмотрит возможность использования параллельной валидации, когда это необходимо для решения ситуации истинной нехватки, и если исследование параллельной валидации соответствует условия, указанные в CPG (см. параграф 4, ac).
Условия, изложенные в CPG, включают расширенное тестирование каждой партии, предназначенное для решения ситуации с дефицитом. Расширенное тестирование, проводимое в соответствии с установленным протоколом валидации, может обеспечить дополнительную уверенность в том, что партия соответствует всем установленным и соответствующим критериям, прежде чем API будет использоваться в готовом лекарственном препарате. Кроме того, уверенности в процессе производства API можно добиться за счет расширенной выборки (больший размер выборки, представляющей партию) и, возможно, тестирования дополнительных атрибутов.Проверенные аналитические методы необходимы для тестирования каждой партии, включая партии для валидации. Агентство также ожидает, что производитель будет использовать протокол проверки, который включает обзор и окончательный отчет после завершения нескольких партий, даже если более ранние партии могли быть распределены или использованы в готовом лекарственном препарате.
Кроме того, уверенности в процессе производства API можно добиться за счет расширенной выборки (больший размер выборки, представляющей партию) и, возможно, тестирования дополнительных атрибутов.Проверенные аналитические методы необходимы для тестирования каждой партии, включая партии для валидации. Агентство также ожидает, что производитель будет использовать протокол проверки, который включает обзор и окончательный отчет после завершения нескольких партий, даже если более ранние партии могли быть распределены или использованы в готовом лекарственном препарате.
Артикул:
В начало
6. Допустимо ли с точки зрения CGMP, чтобы производитель стерильных лекарственных препаратов, произведенных путем асептической обработки, полагался исключительно на ISO 14644-1 и ISO 14644-2 при аттестации своего предприятия?
№С точки зрения CGMP, как правило, неприемлемо, чтобы производитель стерильных лекарственных препаратов, произведенных путем асептической обработки, полагался исключительно на ISO [Международная организация по стандартизации] 14644-1 Часть 1: Классификация линий очистки воздуха s (14644-1) и ISO 14644-2, часть 2: Требования к тестированию и мониторингу для подтверждения соответствия ISO 14644-1 (14644-2) при аттестации предприятия. Скорее, производитель стерильных лекарственных препаратов, произведенных путем асептической обработки, должен использовать эти стандарты ISO в сочетании с применимыми правилами FDA, руководствами и другими соответствующими ссылками, чтобы гарантировать, что фармацевтическое предприятие находится под надлежащим контролем.Следовательно, соответствующие меры, дополняющие рекомендации ISO (например, микробиологические данные), скорее всего, будут необходимы для того, чтобы фирма соответствовала или превышала CGMP на фармацевтическом предприятии.
Скорее, производитель стерильных лекарственных препаратов, произведенных путем асептической обработки, должен использовать эти стандарты ISO в сочетании с применимыми правилами FDA, руководствами и другими соответствующими ссылками, чтобы гарантировать, что фармацевтическое предприятие находится под надлежащим контролем.Следовательно, соответствующие меры, дополняющие рекомендации ISO (например, микробиологические данные), скорее всего, будут необходимы для того, чтобы фирма соответствовала или превышала CGMP на фармацевтическом предприятии.
Пожалуйста, поймите, что 14644-1 и 14644-2 заменили Федеральный стандарт 209E, Классы чистоты взвешенных частиц в чистых помещениях и чистых зонах (Федеральный стандарт 209E). В ноябре 2001 года Управление общих служб США отменило Федеральный стандарт 209E.
Хотя 14644-1 и 14644-2 не являются правилами FDA или руководящими указаниями FDA, Агентство считает, что они полезны для облегчения международной гармонизации промышленной классификации воздуха для обеспечения чистоты нежизнеспособных частиц во многих отраслях промышленности (например,г. , компьютерная, аэрокосмическая, фармацевтическая). Таким образом, FDA приняло эти рейтинги чистоты частиц в руководстве 2004 года для промышленности Стерильные лекарственные препараты, производимые путем асептической обработки — Текущая надлежащая производственная практика . Однако из-за уникальных аспектов производства стерильных лекарственных препаратов путем асептической обработки (например, микробиологические проблемы) производитель асептической обработки не должен полагаться исключительно на 14644-1 и 14644-2 при оценке своего предприятия.
, компьютерная, аэрокосмическая, фармацевтическая). Таким образом, FDA приняло эти рейтинги чистоты частиц в руководстве 2004 года для промышленности Стерильные лекарственные препараты, производимые путем асептической обработки — Текущая надлежащая производственная практика . Однако из-за уникальных аспектов производства стерильных лекарственных препаратов путем асептической обработки (например, микробиологические проблемы) производитель асептической обработки не должен полагаться исключительно на 14644-1 и 14644-2 при оценке своего предприятия.
Артикул:
В начало
7.В 2004 году FDA выпустило руководство под названием PAT — A Framework for Innovative Pharmaceutical Development, Manufacturing and Quality Assurance , которое побудило промышленность модернизировать производство за счет улучшения управления процессами. Как я могу внедрить PAT (технология анализа процессов)?
Целью программы PAT FDA является содействие внедрению PAT. В нашем руководстве от 2004 года мы обсуждаем совместный подход FDA, направленный на содействие внедрению в отрасли новых и полезных технологий, которые модернизируют производственные операции и улучшают контроль процессов.FDA признает, что следует поощрять фирмы к быстрому внедрению новых систем, улучшающих обеспечение качества и эффективности процессов. Соответственно, наш подход к реализации PAT основан на оценке рисков и включает несколько вариантов:
В нашем руководстве от 2004 года мы обсуждаем совместный подход FDA, направленный на содействие внедрению в отрасли новых и полезных технологий, которые модернизируют производственные операции и улучшают контроль процессов.FDA признает, что следует поощрять фирмы к быстрому внедрению новых систем, улучшающих обеспечение качества и эффективности процессов. Соответственно, наш подход к реализации PAT основан на оценке рисков и включает несколько вариантов:
(1) PAT может быть реализован в рамках собственной системы качества предприятия. Проверки CGMP, проводимые сертифицированным исследователем PAT, могут предшествовать внедрению PAT или следовать за ним.
(2) В качестве еще одного варианта внедрения системы качества FDA предлагает производителям запросить предэксплуатационную проверку их производственных мощностей и процесса PAT (см. Директиву ORA по полевому менеджменту No.135).
(3) Дополнение (вступающие в силу изменения (CBE), CBE-30 или Дополнение к предварительному утверждению (PAS)) может быть представлено в Агентство до внедрения, и, при необходимости, проверка может быть проведена с помощью PAT- сертифицированный исследователь перед внедрением. Эту опцию следует использовать, например, когда будет изменена спецификация тестирования конечного продукта, установленная в приложении.
Эту опцию следует использовать, например, когда будет изменена спецификация тестирования конечного продукта, установленная в приложении.
(4) В Агентство может быть направлен протокол сопоставимости, в котором излагаются исследования PAT, стратегии валидации и внедрения, а также временные рамки.После совместного анализа общей стратегии, изложенной в протоколе сопоставимости, путь регулирования может включать внедрение в рамках собственной системы качества объекта, предэксплуатационную проверку, инспекции CGMP (до или после внедрения PAT), их комбинацию или другой гибкий подход. .
Производители должны оценить и обсудить с Агентством наиболее подходящий вариант внедрения PAT (см. Вопросы 8 и 9 ниже).
Ссылки :
В начало
8.Как мне связаться с CDER с вопросами о PAT?
Производители должны связаться с Офисом фармацевтического качества и / или соответствующим отделом проверки в CDER, чтобы обсудить применимость PAT к регулируемым CDER продуктам.
Для получения дополнительной информации обращайтесь:
Ключевые должностные лица CDER
Дата изменения: 18.06.2015
В начало
9. Как мне связаться с CBER по вопросам о PAT?
Производители должны связаться с соответствующим отделом проверки CBER, чтобы обсудить применимость PAT к регулируемым CBER продуктам.
Для получения дополнительной информации обращайтесь:
Справочник ключевого персонала CBER
Дата изменения: 16.09.2013
В начало
10. Какова допустимая частота заполнения носителя по отношению к количеству смен? Обычно заполнение носителем следует повторять дважды за смену на строку в год. Ожидается ли такая же частота процесса, проводимого в изоляторе?
Обоснование фирмой частоты заполнения СМИ по отношению к сменам должно основываться на риске, в зависимости от типа операций и дизайна исследования заполнения СМИ.Для закрытых высокоавтоматизированных систем, работающих в несколько смен, фирме со строгим дизайном наполнения носителя может быть оправдано проведение меньшего количества циклов полного наполнения носителем. Такая программа может быть подходящей при условии, что она по-прежнему обеспечивает производительность заполнения сред для каждой асептической технологической линии, по крайней мере, раз в полгода. В руководстве для промышленности от 2004 г. по стерильным лекарственным продуктам, производимым с помощью асептической обработки говорится, что «[A] виды деятельности и вмешательства, характерные для каждой смены, а также смена смены, должны быть включены в структуру полугодовой программы квалификации.«Кроме того, в Приложении 1 ЕС, Производство стерильных лекарственных средств, говорится, что« Обычно тесты моделирования процесса следует повторять два раза в год за смену и процесс ».
Некоторые современные производственные конструкции (изоляторы и закрытые флаконы , наполнение ) позволяют изолировать асептический процесс от рисков микробиологического заражения (например, операторов и окружающей среды в помещении) на протяжении всего процесса. Для таких закрытых систем , , 1, , если конструкция технологического оборудования является надежной и объем ручных манипуляций в производственном процессе сведен к минимуму, фирма может учитывать эту информацию при определении своего подхода к проверке заполнения носителя.Например, ожидается, что обычная асептическая технологическая линия, работающая в две смены, будет оцениваться дважды в год за смену и завершится четырьмя заполнениями сред. Однако для асептического наполнения, проводимого в изоляторе в течение двух смен, может быть оправдано выполнение менее четырех циклов наполнения средой в год, при этом оценивая линию раз в полгода, чтобы гарантировать постоянное состояние контроля асептического процесса. Это меньшее общее количество запусков наполнения среды будет основано на обоснованном обосновании риска и будет подлежать повторной оценке, если возникнут проблемы с загрязнением (например,g., нестерильность продукта, нарушение заполнения носителя, любые проблемные экологические тенденции).
l Это не относится к RABS (системы ограждений с ограниченным доступом).
Артикул:
- 21 CFR 211.63: Конструкция, размер и расположение оборудования
- 21 CFR 211.65: Производство оборудования
- 21 CFR 211.67: Очистка и техническое обслуживание оборудования
- 21 CFR 211.84 (c) (3), в котором говорится, что «стерильное оборудование и методы асептического отбора проб должны использоваться при необходимости.«
- 21 CFR 211.113 (b), в котором говорится, что «Должны быть установлены и соблюдены соответствующие письменные процедуры, разработанные для предотвращения микробиологического заражения лекарственных препаратов, предположительно стерильных. Такие процедуры должны включать валидацию всего асептического и любого процесса стерилизации».
- Руководство FDA для промышленности, 2004 г., Стерильные лекарственные препараты, произведенные путем асептической обработки
- Приложение 1 к ЕС, 2003 г., Производство стерильных лекарственных средств
Дата: 03.12.2009
В начало
11. Почему FDA беспокоится о местных антисептических препаратах для людей?
FDA выявило несколько случаев нежелательного микробного заражения лекарственных препаратов местного действия (например, спиртовых салфеток или тампонов, используемых для подготовки кожи перед инъекцией). Микробное заражение может быть вызвано некачественной производственной практикой, и Агентство обеспокоено рисками безопасности, такими как инфекции, связанные с этим загрязнением.
Дата: 21.12.2011
В начало
12. Какие конкретные правила CGMP могут быть полезны производителям антисептических препаратов местного действия?
Раздел 501 (a) (2) (B) Федерального закона о пищевых продуктах, лекарствах и косметических средствах требует, чтобы все лекарства производились в соответствии с CGMP. Правила CGMP в 21 CFR части 210 и 211 для готовых фармацевтических препаратов в равной степени применяются к лекарственным препаратам, отпускаемым без рецепта (OTC), и к лекарственным препаратам, отпускаемым по рецепту (см. Раздел 450.100 Руководства по политике соответствия).
Правила CGMP обеспечивают минимальные юридические требования для проведения надежных операций (см. 21 CFR, часть 211).Некоторые соответствующие правила CGMP с кратким описанием приведены ниже:
Производственное проектирование и контроль: требования CGMP и рекомендуемые руководства для производителей
- Спроектировать производственные мощности (§ 211.42) и процессы (см. Ниже) для предотвращения микробного заражения:
- Для нестерильных лекарственных препаратов устанавливает процедуры контроля для мониторинга результатов и проверки процессов, включая тестирование бионагрузки (§§ 211.110 (a) (6)), 211.111), а также установить и соблюдать письменные процедуры, предназначенные для предотвращения интродукции нежелательных микроорганизмов (§ 211.113 (a)).
- Для стерильных лекарственных препаратов устанавливает и соблюдает письменные процедуры, разработанные для предотвращения микробного заражения (§ 211.113 (b)). См. Руководство для промышленности Стерильные лекарственные препараты, произведенные путем асептической обработки — Текущая надлежащая производственная практика .
- Проведение валидации процесса исследований для обеспечения приемлемого результата (например,g., с местными антисептиками, особенно с микробиологическим качеством продукта) (§ 211.110 (a)). Внедряйте и проверяйте необходимые изменения, когда несовершенные этапы производства, оборудование или сырье могут отрицательно влиять на контроль процесса. См. Руководство для промышленности Валидация процессов: общие принципы и методы .
- Убедитесь, что рабочие процедуры постоянно производят качественный продукт (§ 211.100). Изучите и оцените любые отклонения или несоответствия, задокументированные во время производства и тестирования, чтобы определить, не обладает ли продукт гарантией стерильности (для стерильных антисептиков) или может быть загрязнен нежелательными микроорганизмами (для нестерильных антисептиков).Задокументируйте и выполните любые корректирующие действия, вытекающие из оценки (§ 211.192).
- Убедитесь, что все оборудование , включая системы водоснабжения, работает стабильно, является чистым, гигиеничным и пригодным для использования по назначению (§§ 211.63, 211.65, 211.67 и 211.68).
- Внедрение и соблюдение процедур тестирования бионагрузки в процессе для помощи в мониторинге внутрипроизводственного контроля, включая понимание проблемы бионагрузки в процессе окончательной стерилизации (§ 211.110 (а) (6)).
Компоненты, производственные материалы, контейнеры или крышки, а также тестирование готовой продукции: требования CGMP для производителей
- Установите соответствующие письменные стандарты / спецификации испытаний и планы выборочного контроля для компонентов, производственных материалов, контейнеров или укупорочных средств и готовой продукции (§ 211.160).
- Установить процедуры тестирования и утверждения или отклонения компонентов, контейнеров с лекарственными препаратами и укупорочных средств (§ 211.80). Тест каждая партия компонента лекарственного препарата и контейнера или укупорочного средства, включая те, которые могут быть уязвимы для микробиологического загрязнения (§ 211.84) (d) (4-5), включая материал аппликатора (например, ватные диски) и воду используется в качестве ингредиента продукта.
- Проведите соответствующие микробиологические тесты перед принятием решения об утилизации партии. Проверяйте каждую партию стерильного продукта на стерильность (§ 211.167). Проверяйте каждую партию нестерильного продукта, чтобы убедиться в отсутствии нежелательных микроорганизмов (§ 211.165 (б)).
Менеджмент
CGMPs требуют, чтобы руководство производственного предприятия поддерживало хорошо функционирующую систему качества, которая включает эффективный отдел качества, наделенный обязанностями и полномочиями, требуемыми согласно CGMP (§ 211.22). См. Рекомендации ICH для промышленности Q9 Управление рисками качества и Q10 Фармацевтическая система качества .
Ссылки :
Дата: 21.12.2011
В начало
13. Как производители могут оценивать и устранять риск микробиологического заражения местных антисептиков?
Поскольку существует потенциально много различных первопричин загрязнения продукта микроорганизмами, производителям необходимо провести оценку производственных рисков, чтобы понять режимы производственных отказов и принять меры по их предотвращению.
Кроме того, любой подход к оценке риска должен основываться на понимании уязвимости соответствующего продукта к микробному загрязнению.Например, некоторые рекомендации по продукту для производителей включают, но не ограничиваются:
- Определите типы микробов, которые могут выжить или процветать в ваших продуктах. Обеспечьте дополнительный контроль и тестирование на основе результатов оценки риска для обеспечения качества продукции.
- Убедитесь, что ваши методы восстановления микробов способны обнаруживать типы микробов, которые могут повлиять на качество продукта.
- Оценить риск загрязнения от компонентов, в том числе во время производства компонентов, хранения или из-за риска, присущего исходным материалам.Учтите все возможные источники микробного заражения, включая следующие:
- Компоненты или продукты, хранящиеся в открытых контейнерах, могут подвергаться риску заражения спорообразующими микробами, такими как Bacillus cereus, , а также видами Serratia и другими вызывающими беспокойство микробами, переносимыми по воздуху (см. Пресс-релиз FDA и Заболеваемость и Еженедельный отчет о смертности , ссылка на который приведена ниже). Производственные участки, подверженные ветреным или плохим условиям HVAC, могут увеличить вероятность этого риска загрязнения окружающей среды.
- Некоторые материалы, особенно из природных источников, могут иметь высокую или нежелательную внутреннюю бионагрузку.
- Качество воды может представлять значительный риск, так как большинство антисептиков включают воду в качестве ключевого ингредиента. Загрязненная очищенная вода была основной причиной многократного отзыва антисептиков, включая случаи, когда антисептики были загрязнены Burkholderia (ранее Pseudomonas ) cepacia , условно-патогенным микроорганизмом.
- Антисанитарные методы или источники.
- При производстве в помещениях с высокой влажностью формы могут вызывать особую озабоченность.
Артикул:
Дата: 21.12.2011
В начало
14. Может ли Leptospira видов проникать через фильтры стерилизующего класса? Если да, то что производители должны иметь в виду в своих постоянных усилиях по управлению рисками жизненного цикла для обеспечения микробиологического контроля?
FDA известно об отчете о заражении Leptospira licerasiae в культурах клеток (см. Chen, Bergenvin, et al.2012). Нет никаких указаний на то, что эта бактерия в конечном итоге заразила либо готовую лекарственную субстанцию, либо лекарственный продукт. Было обнаружено, что эта бактерия проходит через мембранные фильтры с номинальным размером пор 0,1 мкм. В то время как этот конкретный вид был идентифицированным загрязнителем в данном случае, другие виды Leptospira также способны проходить через фильтры с номинальным размером пор 0,1 мкм (см. Faine 1982). Компактные методы микробиологического тестирования, обычно используемые в связи с предшествующими биотехнологиями и фармацевтическим производством, не способны обнаруживать этот тип бактерий.Неизвестно, может ли этот явно редкий риск загрязнения быть более распространенным, и мы делимся этой информацией, чтобы производители могли подумать, может ли эта опасность иметь отношение к их деятельности.
Leptospira — грамотрицательные аэробные спирохеты, гибкие, очень подвижные, спиралевидные с внутренними жгутиками. Бактерии имеют диаметр 1 мкм и длину 10-20 мкм. Leptospira — облигатные аэробы, которые используют кислород в качестве рецептора электронов и длинноцепочечные жирные кислоты в качестве основного источника энергии.В то время как некоторые из Leptospira являются безвредными пресноводными сапрофитами, другие виды являются патогенными и могут вызывать лептоспороз, серьезное заболевание у людей и животных (Ricaldi, Fouts, et al. 2012; Matthias, Ricaldi, et al. 2008; Bharti , Nally, et al. 2003). Основываясь на текущей информации, загрязнение Leptospira , по-видимому, происходит нечасто, и можно ожидать, что этапы очистки, которые следуют за культивированием клеток в типичной биотехнологической операции, предотвратят перенос в готовое лекарственное вещество.Тестирование нерасфасованных лекарственных веществ, произведенных в указанных случаях, не выявило видов Leptospira , и в известном тематическом исследовании не было обнаружено никаких доказательств вредного воздействия на продукт в процессе производства. Однако мы предоставляем это сообщение, чтобы предупредить производителей о том, что эти типы бактерий потенциально могут:
- Проникающие мембранные фильтры стерилизующего класса
- Присутствовать на производственной площадке
- Воздействие на незавершенное производство (e.g., выход продукции, уровни примесей, производительность процесса)
- Остаться необнаруженными из-за ограничений текущих сборных тестов на бионагрузку при обнаружении этого рода микробов
В качестве общего принципа производители должны использовать разумное управление рисками и знать о необычной микробиоте, описанной в литературе, которая может повлиять на их производственные процессы (например, биотехнология клеточных культур, производство обычных стерильных лекарств). Производители должны оценивать свою деятельность, знать о потенциальных рисках и применять соответствующее управление рисками, основанное на понимании возможных или возникающих рисков загрязнения (см. Раздел 18.3 в руководстве ICH для промышленности Q7 Руководство по надлежащей производственной практике для активных фармацевтических ингредиентов ). При необходимости, превентивные меры должны быть реализованы в течение жизненного цикла продукта и процесса. Для иллюстрации, если заражение лептоспиралами считается возможным или имело место, процедуры и методы снижения риска для этого микроорганизма должны включать, по крайней мере, следующее:
(1) Обзор доступных опубликованных статей из научной литературы и технических отчетов соответствующих отраслевых организаций, которые могут дать дальнейшее понимание того, как уменьшить эту опасность загрязнения.
(2) Использование молекулярных или нетрадиционных методов микробиологического мониторинга с соответствующими интервалами для обнаружения микробной флоры, которая может существовать на этапах обработки или в ближайшем окружении, но не может быть легко обнаружена текущими рутинными методами. Такое расширенное тестирование следует использовать для изменения стратегии (например, времени, частоты, типов тестов) обнаружения и контроля в случае вновь выявленного риска, создаваемого жизнеспособными, но нелегко культивируемыми микроорганизмами.
Примеры включают: a.Использование специализированных сред, таких как среда Эллингхаузена Маккалоу Джонсона Харриса (EMJH) (Ellinghausen and McCullough, 1965) или других подходящих сред (Rule and Alexander 1986). Следует отметить, что эти бактерии обычно растут очень медленно. б. Использование проверенных методов полимеразной цепной реакции (ПЦР) (например, в качестве исследовательского инструмента) для быстрого скрининга и обнаружения спирохетных бактерий. c. Рассмотрение специальных методов окрашивания или других средств для выявления присутствия Leptospira (Франк и Кон 1973 ) .
(3) Использование традиционных подходов. Фирмы должны продолжать надлежащим образом использовать базовые стандартные методы лабораторной микробиологии для обнаружения контаминации. Например, лаборатория должна гарантировать, что микроскопическое исследование является частью ее рутинной программы контроля процесса культивирования клеток, поскольку она обеспечивает важные средства обнаружения микробных загрязнителей, которые могут не расти на обычных средах.
(4) Внедрение таких мер по управлению рисками для качества в первоначальный проект (т.е., предупреждающие действия) и своевременное выполнение соответствующего плана корректирующих действий в ответ на вновь выявленные источники загрязнения на протяжении всего жизненного цикла продукта.
Список литературы :
- FDA Guidance for Industry, 2001, ICH Q7 Good Manufacturing Practice Guidance for Active Pharmaceutical Ingredients
- Чен, Дж., Дж. Бергенвин, Р. Кисс, Дж. Уокер, Т. Баттистони, П. Люфбурроу, Х. Лам и А. Винтер, 2012 г., Практический пример: новое бактериальное заражение в производстве клеточных культур — Leptospira licerasiae , КПК J Pharm Sci Технол, 66 (6): 580–591
- Faine, S (изд.), 1982 г., Руководство по борьбе с лептоспирозом, Женева: Всемирная организация здравоохранения, .
- Ricaldi, JN, DE Fouts, JD Selengut, DM Harkins, KP Patra, et al., 2012, Анализ всего генома Leptospira licerasiae обеспечивает понимание эволюции лептоспиралов и патогенности, PLoS Negl Trop Dis, 6 (10): e1853
- Маттиас, Массачусетс, Дж. Н. Рикальди, М. Сеспедес, М. М. Диаз, Р. Л. Галлоуэй и др., 2008, Лептоспироз человека, вызванный новой антигенно уникальной лептоспирой , ассоциированной с водохранилищем видов Rattus в перуанской Амазонии, PLoS Negl Tropic Дис, 2 (4): e213
- Bharti, AR, JE Nally, JN Ricaldi, MA Matthias, MM Diaz, et al., 2003, Лептоспироз: зоонозная болезнь глобального значения, Lancet Infect Dis, 3: 757–771
- Ellinghausen, HC, и WG McCullough, 1965, Питание Leptospira pomona и рост 13 других серотипов: фракционирование комплекса олеинового альбумина (OAC) и среды бычьего альбумина и полисорбата 80, Am J Vet, 26: 45– 51
- Rule Pl, и А. Д. Александер, 1986, Геллановая камедь как заменитель агара в лептоспиральной среде, J Clin Microbiol, 23 (3): 500–504
- Фрэнк С. и Дж. Кон, 1973, J Amer Med Technology, июль – август г.
Дата: 20.12.2012
В начало
15. FDA отозвало проект руководства для промышленности по порошковым смесям и готовым дозированным единицам — стратифицированный отбор и оценка производственных единиц дозировки. Что больше всего беспокоило Агентство в связи с этим руководством?
FDA больше всего беспокоило то, что разделы V и VII отозванного проекта руководства больше не отражают текущее мышление Агентства, как объясняется ниже. В Разделе V (Экспонат / Подтверждение однородности порошковой смеси партиями) рекомендуется брать не менее 3 повторных проб из не менее 10 мест в порошковом смесителе, но оценивать только 1 из 3-х повторностей для оценки однородности порошковой смеси.В настоящее время Агентство рекомендует, чтобы всех повторных проб, взятых из различных мест в смесителе, были оценены для проведения статистически достоверного анализа. Этот анализ может продемонстрировать, что вариабельность, связанная с расположением образца, не является значительной и что порошковая смесь однородна. Доступны статистические инструменты, позволяющие определить как количество повторов, так и количество точек отбора проб в блендере, которые необходимо проанализировать для проведения достоверного анализа. Раздел VII (Методы стандартного производственного испытания партии) критерии приемлемости, определенные для метода стандартных критериев и метода предельных критериев, основывались на пределах, опубликованных в Общей главе <905> Фармакопеи США (USP). Единообразие дозированных единиц .Однако процедуры и критерии приемлемости в Общей главе <905> не являются планом статистического отбора проб, и поэтому результаты процедур не следует экстраполировать на более крупные совокупности. Следовательно, поскольку процедура и критерии приемлемости, предписанные в разделе VII, обеспечивали лишь ограниченную статистическую уверенность в том, что партии лекарственных препаратов соответствовали соответствующим спецификациям и критериям статистического контроля качества, FDA больше не поддерживает их использование для выпуска серий. В настоящее время существует несколько стандартных статистических практик, которые при правильном использовании могут помочь обеспечить соблюдение правил CGMP, включая 21 CFR 211.110, 21 CFR 211.160 и 21 CFR 211.165.
Список литературы :
Дата: 06.08.2013
В начало
16. Почему FDA заботится о правильном отборе проб порошковых смесей?
CGMPs требуют, чтобы все планы выборочного контроля были научно обоснованными и репрезентативными для испытуемой партии (см. 21 CFR 211.160 (b)). Кроме того, производственное тестирование порошковых смесей для демонстрации адекватности смешивания является требованием CGMP (21 CFR 211.110). Различия в составе порошковой смеси между местами и внутри помещений являются критическим компонентом качества готовой продукции и, следовательно, должны быть оценены. Производители лекарственных препаратов должны использовать подход к отбору проб, основанный на научных данных и рисках, чтобы гарантировать (а) адекватность смешивания смесей и (б) отбор проб смеси на подходящем этапе производственного процесса. Отбор проб и анализ должны гарантировать отсутствие различий между местами в смеси, которые могут отрицательно повлиять на качество готовой продукции.Традиционный отбор проб с использованием порошкового крана может иметь недостатки и ограничения, такие как нарушение слоя порошка, сегрегация порошка или другие ошибки отбора проб. Тем не менее, отбор проб порошковым методом по-прежнему широко используется и во многих случаях дает надежные результаты. Агентство поощряет фирмы применять более инновационные подходы к обеспечению адекватности смешивания (см., Например, руководство для отрасли PAT — A Framework for Innovative Pharmaceutical Development, Manufacturing, and Quality Assurance ).Если производитель предлагает использовать метод отбора проб, надежность метода должна быть оценена в рамках разработки аналитических методов.
Артикул:
Дата: 06.08.2013
В начало
17. Какие рекомендуемые инновационные подходы к обеспечению адекватности смешивания порошковых смесей?
Инновационные подходы, которые следует рассмотреть, включают, но не ограничиваются: (a) мониторинг PAT в реальном времени и упреждающее управление процессом смешивания порошков (см. Руководство для промышленности PAT — A Framework for Innovative Pharmaceutical Development, Manufacturing, and Обеспечение качества ) и (b) использование инструментов статистического контроля процесса для мониторинга процесса смешивания порошков и поддержания состояния контроля.Когда производитель решает применить PAT или другие методы мониторинга и контроля процесса для оценки однородности порошковой смеси, его решение должно быть подкреплено соответствующими данными и обоснованием с использованием подхода, основанного на научных данных и рисках. Например, эффективный размер образца порошка, исследуемого датчиками PAT, должен быть оценен таким образом, чтобы можно было обосновать масштаб тщательного изучения мониторинга смешивания порошка PAT (Wu, Tawakkul, et al. 2009). Количество датчиков PAT и их расположение также должны быть обоснованы.Если установлена научно обоснованная стратегия мониторинга и контроля PAT, она может облегчить оценку (а) изменчивости в разных местах в пределах порохового слоя (Эль-Хаграси, Моррис и др. 2001), (б) изменчивости во времени в одном месте. и (c) потенциальная корреляция между образцом порошка и стандартной лекарственной формой.
Артикул:
- FDA Guidance for Industry, 2004, PAT — A Framework for Innovative Pharmaceutical Development, Manufacturing, and Quality Assurance
- Ву, Х., М. Таваккул, М. Уайт и М. Хан, 2009 г., Качество по дизайну (QbD): интегрированный многомерный подход для количественной оценки компонентов в порошковых смесях, Международный журнал фармацевтики, 372 (1-2): 39–48
- Эль-Хаграси, А., Х. Моррис, Ф. Д’Амико и др., 2001, Спектроскопия в ближнем инфракрасном диапазоне и визуализация для мониторинга однородности порошковой смеси, Journal of Pharmaceutical Sciences, 90 (9): 1298–1307
Дата: 06.08.2013
В начало
18. Каковы рекомендации Агентства в отношении стратифицированного отбора проб готовых дозированных единиц в процессе производства?
Рекомендуется использовать стратифицированную выборку, если известно, что популяция состоит из нескольких подразделений (т. Е. Участков), что может дать разные результаты для измеренных характеристик качества.Агентство ожидает, что не должно существовать значительных различий между точками производства, которые могли бы повлиять на качество готовой продукции. Изменчивость между местоположениями и внутри них является критическим компонентом качества готовой продукции и, следовательно, должна быть оценена. Пожалуйста, обратитесь к ASTM E2709 и ASTM E2810 для получения дополнительных указаний по установлению критериев приемлемости для плана стратифицированного выборочного контроля. Артикул:
- Стандарт ASTM E2709, 2014, Стандартная практика для демонстрации способности соответствовать процедуре приемки, Вест Коншохокен, Пенсильвания: ASTM International
- Стандарт ASTM E2810, 2011 г., Стандартная практика для демонстрации способности соответствовать тесту на однородность дозированных единиц, Вест Коншохокен, Пенсильвания: ASTM International
Дата: 06.08.2013
В начало
19. Для нестерильного компендиального лекарственного препарата, который включает в себя противомикробный консервант, могу ли я выпустить и продать партии этого лекарственного препарата с исходным общим аэробным подсчетом, выходящим за пределы спецификации, если эти партии будут протестированы в соответствии со спецификацией через 2 недели?
No. 21 CFR 211.113 (a) требует, чтобы во время производства были установлены и соблюдались соответствующие письменные процедуры для предотвращения нежелательных микроорганизмов в лекарственных препаратах, которые не должны быть стерильными.Кроме того, второй абзац Общей главы Фармакопеи США <51> Тестирование противомикробной эффективности гласит: Противомикробные консерванты не должны использоваться в качестве замены надлежащей производственной практики исключительно для уменьшения жизнеспособной микробной популяции нестерильного продукта или контроля бионагрузки перед стерилизацией продукта. многодозовый состав при производстве. Производители лекарств не должны полагаться на противомикробные консерванты, чтобы уменьшить начальное количество планшетов, не соответствующих спецификации, до уровней в пределах спецификации, а затем продавать продукт.Раздел 211.165 (f) требует, чтобы лекарственные препараты, не соответствующие установленным стандартам или спецификациям, были отклонены. Первоначальные результаты испытаний, показывающие уровни микробов вне спецификации, не аннулируются, даже если последующие результаты испытаний находятся в пределах спецификаций. В таких случаях FDA по-прежнему ожидает, что производитель отклонит лекарственный продукт на основании первоначальных результатов. Для производителей также неприемлемо пропускать неоправданно долгое время (например, недели) перед тестированием продукта, что может позволить консерванту снизить уровни микробов, которые могут быть внесены во время производства, и, таким образом, избежать результатов тестирования, выходящих за рамки спецификации.Наконец, производители лекарств должны пересмотреть свой производственный процесс, чтобы определить процедуры или оборудование, которые могут внести в процесс или продукт контаминирующие микроорганизмы.
Артикул:
- 21 CFR 211.113: Контроль микробиологического загрязнения
- 21 CFR 211.165: Тестирование и выпуск для распространения
- USP 38 – Национальный формуляр (NF) 33 (2015) Общая глава <51> Тестирование противомикробной эффективности
- USP 38 – NF 33 (2015) Общая глава <61> Микробиологическое исследование нестерильных продуктов: тесты для подсчета микробов
- USP 38 – NF 33 (2015) Общая глава <62> Микробиологическое исследование нестерильных продуктов: тесты на определенные микроорганизмы
Дата: 11.06.2015
В начало
20. Нужно ли производителям фармацевтических препаратов иметь письменные процедуры для предотвращения роста нежелательных микроорганизмов в лекарственных препаратах, которые не должны быть стерильными? Что в любом случае означает нежелательный ?
Да, правила CGMP требуют наличия этих письменных процедур. 21 CFR 211.113 (a) определяет, что должны быть установлены и соблюдены соответствующие письменные процедуры для предотвращения роста нежелательных микроорганизмов в лекарственных препаратах, которые не должны быть стерильными. Несмотря на то, что лекарственный продукт не является стерильным, фирма должна следовать письменным процедурам, которые активно предотвращают внедрение и распространение нежелательных микроорганизмов.21 CFR 211.165 (b) гласит, что «[t] здесь должны проводиться соответствующие лабораторные испытания, если необходимо, каждой партии лекарственного препарата, которая должна быть свободна от нежелательных микроорганизмов», прежде чем она будет выпущена для распространения. Значение термина нежелательный необходимо оценивать в индивидуальном порядке каждым производителем лекарств. Основное значение относится к микробным загрязнителям, которые в зависимости от вида микробов, количества организмов, лекарственной формы, предполагаемого использования, популяции пациентов и пути введения могут отрицательно повлиять на безопасность продукта.Микроорганизмы могут быть нежелательными по нескольким причинам; например, они:
- являются известным патогеном человека
- отрицательно влияет на стабильность продукта
- Вступить в реакцию или потенциально повредить целостность системы укупорки контейнера (например, ферментация, которая создает давление газа, достаточное для разрушения контейнера / укупорочного средства продукта).
- Помешать аналитическим методам или биодоступности активного ингредиента
Установление предельных сроков производства является примером контроля для предотвращения роста нежелательных микроорганизмов.Согласно 21 CFR 211.111, сроки завершения каждой фазы производства, когда это необходимо, должны быть установлены и соблюдаться. Например, если фирма считает необходимым хранить объемный продукт для местного применения или жидкий продукт в течение нескольких месяцев, пока он не будет наполнен, она может установить предел времени хранения, чтобы предотвратить нежелательное накопление микробов. Валидация и контроль микробного содержания в системах очищенной воды, используемых в некоторых продуктах для местного применения, также являются примерами таких процедур (см. Руководство FDA, ссылка на который приведена ниже).
Артикул:
- 21 CFR 211.113: Контроль микробиологического загрязнения
- 21 CFR 211.165: Тестирование и выпуск для распространения
- 21 CFR 211.111: Сроки производства
- Руководство FDA для промышленности, 2011 г., Валидация процессов: общие принципы и практики
Дата: 11.06.2015
В начало
21. Для лекарственных препаратов, в состав которых входят консерванты для подавления роста микробов, необходимо ли тестировать консерванты в рамках тестирования выпуска партии и стабильности?
Да.Обычно используются два типа тестов. Первоначально фирмы проводят тестирование эффективности противомикробных консервантов, чтобы определить минимально эффективный уровень консерванта. После определения этого уровня фирмы могут разработать соответствующие спецификации аналитических испытаний. Затем фирмы могут применять аналитические тесты на содержание консервантов при выпуске партии и в течение всего срока годности партий на стабильность.
Артикул:
- 21 CFR 211.165: Тестирование и выпуск для распространения
- 21 CFR 211.166: Проверка стабильности
- USP 38 – NF 33 (2015) Общая глава <51> Тестирование противомикробной эффективности
Дата: 11.06.2015
В начало
Контакт для получения дополнительной информации:
Домой | Общие положения | Здания и сооружения | Оборудование | Контроль компонентов и контейнеров для лекарственных препаратов и укупорочных средств | Производство и управление процессами | Хранение и распространение | Лабораторный контроль | Записи и отчеты | Возвращенные и утилизированные лекарственные препараты
Настольные фасовочно-укупорочные машины
GENiSYS
® Lab: настольные машины для лабораторного использования и мелкосерийного производства Линия настольных разливочных машинAST, GENiSYS ® Lab, является идеальной системой для разработки лекарственных препаратов и производства цГМФ.Каждая система предназначена для автоматизации критических асептических операций при обработке флаконов, шприцев и картриджей, чтобы снизить риск загрязнения и вариативность продукта. Эти настольные системы спроектированы так, чтобы иметь полную совместимость со средами чистых помещений, включая вытяжные шкафы с ламинарным потоком воздуха, шкафы биобезопасности и асептические изоляторы.
Система наполнения контейнеров (CFS) заполняет флаконы, шприцы и картриджи и закрывает флаконы пробками с сывороткой или лио-пробками. Он может даже устанавливать на флакон запрессованные колпачки.
Система укупорки флаконов (VSS) дополняет CFS для герметизации или «укупорки» ранее заполненных и закупоренных флаконов алюминиевой крышкой. VSS также используется для установки алюминиевого колпачка и линейного уплотнения на картриджи перед заполнением и закрытием.
Система закрытия контейнера (CCS) вставляет поршень / плунжер в предварительно заполненные шприцы и картриджи, используя либо вентиляционную трубку, либо вакуум.
Каждая из настольных разливочных машин AST предлагает идеальный баланс между автоматическими функциями, размером и доступностью без ущерба для качества, безопасности и простоты использования.
Упростите процесс НИОКР и передачи технологий
Для разработки лекарственных препаратов завтрашнего дня требуются очень гибкие решения, позволяющие реализовать крупномасштабное производство. Каждая система GENiSYS Lab предоставляет параметры рецептов, системные функции и сервоуправление, которые точно имитируют операции массового производства в лабораторном масштабе. Доступ, анализ и оптимизация каждого параметра процесса — ключ к эффективной передаче технологий. Каждая система GENiSYS Lab оснащена ASTView, который собирает все важные данные о параметрах процесса и позволяет пользователю экспортировать данные для анализа и оптимизации.Каждую систему можно модернизировать с помощью системы электронной пакетной записи (EBR), чтобы обеспечить соответствие 21 CFR Part 11.
Устранение необходимости заполнения вручную и рискованных ручных операций
Ручной розлив мелкосерийных продуктов может привести к загрязнению и снижению качества асептического процесса.

 Тем более, что чердак не отапливается, и трубы могут просто размерзнуться и порваться.
Тем более, что чердак не отапливается, и трубы могут просто размерзнуться и порваться. Своими силами вы можете только развести трубы и подключить радиаторы. Если котел электрический, то все работы можно проводить своими руками;
Своими силами вы можете только развести трубы и подключить радиаторы. Если котел электрический, то все работы можно проводить своими руками; США был 36,99 долл. США
США был 36,99 долл. США США
США Что могло быть источником заражения?
Что могло быть источником заражения?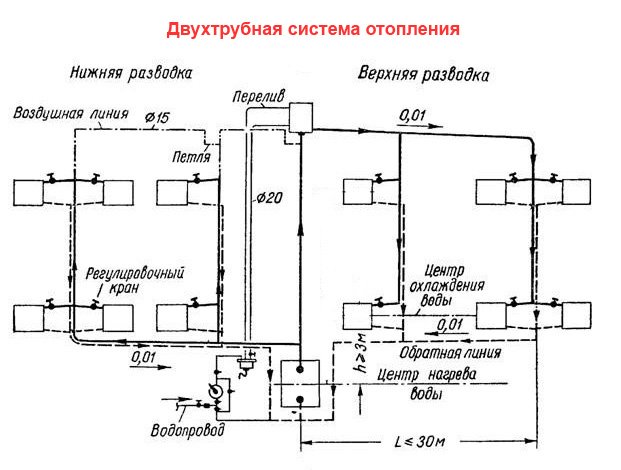 Как я могу внедрить PAT (технология анализа процессов)?
Как я могу внедрить PAT (технология анализа процессов)? Что больше всего беспокоило Агентство в этом руководстве?
Что больше всего беспокоило Агентство в этом руководстве? 94: Контейнеры и укупорочные средства для лекарственных препаратов
94: Контейнеры и укупорочные средства для лекарственных препаратов , Вашингтон, округ Колумбия: ASM Press
, Вашингтон, округ Колумбия: ASM Press 103: Расчет доходности
103: Расчет доходности