Чем опасен электролит для человека
Химические реакции внутри аккумулятора происходят в среде электролита, который обеспечивает движение заряженных частиц к электродам.Какие электролиты используются в АКБ?
Электролит может находиться в аккумуляторе в жидком или гелеобразном состоянии. В первом случае он представляет собой раствор серной кислоты либо щелочи в дистиллированной воде. Гелевые аккумуляторы также используют раствор серной кислоты, который с помощью специальных добавок переводится в гель. Наибольшее распространение имеют свинцово-кислотные автомобильные аккумуляторные батареи. Щелочи используются реже – преимущественно в никель-кадмиевых или никель-железных источниках электропитания автомобиля.Чем опасен электролит аккумуляторной батареи?
Любое из указанных химически агрессивных веществ является опасным для человека, требует осторожного обращения и соблюдения специальных мер безопасности. Людям, которым часто приходится иметь дело с автомобильными аккумуляторами, следует опасаться непосредственного контакта с опасной жидкостью:- попадание на открытые участки кожи;
- вдыхание паров электролита;
- попадание вещества в глаза;
- случайное проглатывание жидкости и ее проникновение в пищеварительный тракт.

Какой вред можно нанести здоровью при неосторожном обращении с электролитом?
Соприкосновение раствора с кожей вызывает химический ожог, сопровождающийся покраснением, отечностью, появлению волдырей, формированию болезненных струпьев. Человека, надышавшегося парами кислотного или щелочного раствора, будут беспокоить симптомы поражения слизистой оболочки дыхательных путей и органов:- кашель;
- чихание;
- сильное слюноотделение;
- одышка;
- падение кровяного давления;
- бронхиальный спазм;
- удушье;
- судороги.
Как можно уберечься от опасности?
Для предотвращения неприятностей автомобилистам, работникам станций техобслуживания, людям, осуществляющим прием автомобильных аккумуляторов, следует предпринимать совсем несложные меры:- быть предельно внимательными;
- соблюдать рекомендации производителей аккумуляторов относительно условий их эксплуатации, ремонта и утилизации;
- придерживаться элементарных правил техники безопасности;
- пользоваться средствами индивидуальной защиты.

Первая помощь при попадании электролита в организм человека
Хорошими средствами, нейтрализующими кислоту, являются всем доступные сода и нашатырный спирт (раствор). На щелочные растворы воздействуют с помощью лимонной и уксусной кислоты. Если при работе с аккумулятором не удалось избежать попадания электролита на кожу, то следует немедленно обработать пораженный участок каким-либо из перечисленных веществ, после чего не менее 15 минут подержать его под струей чистой воды. Глаза при несчастном случае нужно сразу промыть большим количеством воды, после чего немедленно обратиться к врачу. При попадании химикатов в желудочно-кишечный тракт потребуется как можно быстрее сделать промывание желудка, обеспечить пострадавшему обильное питье. В любом случае необходимо найти способ сразу же после происшествия обратиться за профессиональной врачебной помощью. Это поможет спасти не только здоровье, но и во многих случаях жизнь пострадавшего.Как утилизировать электролит из аккумулятора — MOREREMONTA
Практически все предприятия в развитых странах перерабатывают аккумуляторы, заполненные электролитом.
Существуют два принципиальных пути утилизации сернокислотного электролита: нейтрализация с последующим сбросом в стоки и регенерация с получением серной кислоты, как товарного продукта. Технологическая схема утилизации сернокислотного электролита представлена на рисунке 5.1.
Рисунок 5.1 Технологическая схема утилизации сернокислотного электролита
Нейтрализация сернокислотного электролита основана на реакциях взаимодействия H2S03 с нейтрализующими агентами. В качестве последних наибольшее применение нашли кальцинированная сода Na Реакции с участием указанных реагентов протекают следующим образом:
Реакции с участием указанных реагентов протекают следующим образом:
Примечание: гидроксид кальция может быть использован из отходов ацетиленового производства.
В результате реакций (5.9—5.10) образуется растворимый сульфат натрия, а реакций (5.11—5.12)- нерастворимый сульфат кальция (гипс).
При разработке технологии нейтрализации h3S04 с помощью кальцинированной соды важно знать величину растворимости Na2C03 в воде в зависимости от температуры. Соответствующие данные приведены в таблице 5.8
Как видно из приведенных данных, максимальная растворимость кальцинированной соды имеет место при 40°С. Дальнейшее повышение температуры приводит к некоторому снижению этой величины.
Приведем пример расчета количества кальцинированной соды на нейтрализацию H2S04. Примем объем сливаемого электролита, равный 100л плотностью 1,200г/см3, приведенной к 30°С. В одном литре электролита плотностью 1,200г/ содержится 346г моногидрида серной кислоты, следовательно, в 100л — 34,6кг H2S04. Согласно реакции (5.9) на нейтрализацию 1г-моля H2S04 расходуется 1,081г-моля Na2C03. Следовательно, для нейтрализации 34,6 кг H2S04 потребуется 38,2кг кальцинированной соды.
Согласно реакции (5.9) на нейтрализацию 1г-моля H2S04 расходуется 1,081г-моля Na2C03. Следовательно, для нейтрализации 34,6 кг H2S04 потребуется 38,2кг кальцинированной соды.
Таким же образом может быть рассчитан расход каустической соды и извести. Согласно реакциям (5.10 и 5.11) на нейтрализацию г-моля H2S04 расходуется 0,408 и 1,222г-моля NaOH и СаС03 соответственно.
Как видно, наименьший расход на нейтрализацию серной кислоты обеспечивает использование каустической соды. Однако для практического выбора нейтрализующего агента необходимо учитывать его доступность и стоимость.
Согласно приведенной на рисунке 5.1 схеме слив электролита из аккумуляторов осуществляется в приемные емкости, объем которых зависит от количества перерабатываемых аккумуляторов. Приемные емкости могут быть выполнены из любого кислотостойкого пластика (винипласта, стеклопластика и др.) или футерованы рольным свинцом. После заполнения приемной емкости электролит с помощью насоса перекачивается в емкость для отстоя (осветления). Отстой электролита производится с целью осаждения частиц шлама, состоящего в основном из диоксида свинца, то есть частиц положительной активной массы аккумуляторов. Отстой ориентировочно продолжается в течение суток.
После заполнения приемной емкости электролит с помощью насоса перекачивается в емкость для отстоя (осветления). Отстой электролита производится с целью осаждения частиц шлама, состоящего в основном из диоксида свинца, то есть частиц положительной активной массы аккумуляторов. Отстой ориентировочно продолжается в течение суток.
В зависимости от объема нейтрализуемого электролита и организации производства могут быть использованы попеременно наполняемые две или три приемные емкости, в которых может осуществляться также и его отстой. При приготовлении раствора реагента в емкость первоначально заливается вода, а затем небольшими порциями вводится расчетное количество нейтрализующего агента. Раствор агента вводится при периодическом перемешивании деревянной или пластиковой мешалкой.
Процесс нейтрализации контролируется с помощью универсальной индикаторной бумаги по величине водородного показателя.
Сливную емкость (отстойник) и нейтрализатор по мере накопления шламов очищают от осадков. Осадки направляются на металлургическую переработку. Следует учесть, что процесс нейтрализации сернокислотного раствора происходит с большим выделением тепла. Поэтому выбор объема нейтрализующего раствора должен осуществляться с учетом его разогрева. Нейтрализованный электролит направляется в стоки.
Осадки направляются на металлургическую переработку. Следует учесть, что процесс нейтрализации сернокислотного раствора происходит с большим выделением тепла. Поэтому выбор объема нейтрализующего раствора должен осуществляться с учетом его разогрева. Нейтрализованный электролит направляется в стоки.
Содержание компонентов в нейтрализованном растворе не должно превышать следующих показателей: соединения свинца — 0,1мг/л; взвешенные частицы — до 50мг/л. РН раствора должен быть равным 6, 5÷8, 0.
Для перекачки сернокислотного электролита из одной емкости в другую могут использоваться центробежные насосы серии «КМХ», производимые АО «НИИ ТЭМ» (г. Чайковский Пермской обл.). Насосы пригодны для перекачки серной кислоты любой концентрации при температурах от 1 до 70°С.
Основные технические характеристики насосов приведены в таблице 5.9.
Электроформинг
Гальванопластика
в канализацию можно, если не заморачиваться с охраной окружающей среды. более того, поскольку среда слабокислотная, то есть шанс что электролит очистит немного камня или грязи в трубах.
проверить съест ли унитаз/ванну/раковину (все разные, мало ли) — надо в незаметном месте. если нет реакции, то лить можно.
если же задумываетесь о окружающей среде — то вам надо в компанию, утилизирующую автомобильные аккумуляторы, как вариант. они работают с сернокислыми электролитами.
а что такое ОТРАБОТАННЫЙ электролит, кстати?
о! и меня этот вопрос интересовал (пока слила непригодный в бутылку — там стоит по сей день). значит надо фильтровать.
а еще интересно от чего полосами омеднение идет.. сначала ровненько затягивается, а потом с какого-то момента медь начинает наростать полосками
кто-то знает? за отсылку к литературе/статьям/постам тоже буду благодарна
Я знаю 🙂 И полоски, что характерно, вертикальные. Если понаблюдать при хорошем освещении — струйки электролита на изделии перемещаются вверх-вниз.
А что такое НЕПРИГОДНЫЙ электролит, кстати?
а вот отчего такие полосы получаются? почему электролит так струйками перемещается? это что-то с силой ток или с электролитом?
под непригодным я имею ввиду тот, который нуждается в корректировке (а я с ней не угадываю обычно, поэтому легче сделать новый, а старый в бутылочку сливаю на случай, если научусь корректировать нормально)
тоже как-то взялся лопатить тырнет на эту тему нашел вот что:
«Утилизация отработанных реактивов меднения
В растворе для нанесения медного покрытия есть два необходимых для утилизации вредных вещества: кислота и медная соль.
Для утилизации медной соли необходимо удалить медь из раствора. уДля этого установите емкость с 2 достаточно большими стальными пластинами, расположенными друг против друга, одна из которых будет использоваться в качестве анода, а другая — в качестве катода. При помощи преобразователя (или обычного зарядного устройства) подсоедините положительную клемму к одной пластине, а отрицательную — к другой и оставьте его на несколько часов. Установите напряжение 12 вольт и максимально возможную силу тока и оставьте на несколько часов в рабочем режиме
Утилизация аккумуляторов – сложная многоэтапная процедура, которая требует использования специального оборудования. Старые и неработающие аккумуляторы нельзя выбрасывать на свалку, потому что они опасны для человека и наносят вред экологии. В составе аккумуляторных батарей (АКБ) имеется свинец, кислотные и щелочные вещества, способные загрязнить воздух и почву в значительной степени.
Утилизация аккумуляторов разных типов
Существует несколько основных видов аккумуляторов для автомобилей, но каждый из них нуждается в утилизации. Если просто выбросить АКБ на помойку, то через некоторое время под воздействием разных факторов из него может начать вытекать электролит. Это опасное, ядовитое для животных и грунта химическое соединение, наносящее окружающей среде непоправимый вред.
Если просто выбросить АКБ на помойку, то через некоторое время под воздействием разных факторов из него может начать вытекать электролит. Это опасное, ядовитое для животных и грунта химическое соединение, наносящее окружающей среде непоправимый вред.
Поэтому утилизация аккумуляторных батарей – это обязанность современного общества. Во многих развитых странах мира подобные процессы давно нашли поддержку на государственном уровне.
Зачем нужна?
Утилизировать отработанные автомобильные аккумуляторы нужно обязательно потому, что при простом выбросе их на свалку, на разложение пластиковых элементов изделия уйдет около 40-60 лет, а на разложение химических соединений и электролита – не одно столетие. Иными словами, в течение столетий в месте выброса АКБ грунт будет отравлен и непригоден для использования.
Утилизация АКБ также позволяет использовать многие компоненты аккумулятора повторно. Металлы могут применяться в металлургической промышленности, полимерные компоненты – при изготовлении пластиковых изделий, серная кислота и щелочи – в химической отрасли.
Как происходит?
Сдача аккумулятора в утиль – правильное решение, позволяющее не только обеспечить безопасность переработки АКБ, но получить немного денег. Утилизируют старые АКБ на специальных технологических линиях. Такое оборудование позволяет безопасно разобрать и разделить бывшие в употреблении автомобильные аккумуляторы на отдельные компоненты, многие в дальнейшем можно использовать повторно (например, практически все металлы).
Из обычного автомобильной батареи обычно получают:
- Стальной лом.
- Полимерные гранулы.
- Медные компоненты.
- Электролит.
- Свинец, свинцовые соединения.
Процесс утилизации автомобильных АКБ включает в себя несколько этапов.
Работы проводятся в следующей последовательности:
- Сначала сливается и перерабатывается химическим образом электролит (его нейтрализуют для дальнейшей утилизации в стоки либо регенерируют для получения сернистой кислоты, пригодной для повторного использования).

- Дробление (с помощью дробильного оборудования для разрушения изделия).
- Фильтрация (чтобы отсеять кислотно-свинцовую пасту).
- Разделение полимеров и металлов.
- Переработка полимерных компонентов.
- Очистка металлов.
- Получение свинца.
- Очищение и плавка свинца.
Получившийся лом от аккумуляторов применяется в металлургической промышленности либо при производстве новых АКБ и аналогичной продукции.
Куда сдать старый автомобильный аккумулятор?
Сдать старый аккумулятор можно в специализированные фирмы или на перерабатывающие заводы, которые занимаются утилизационной деятельностью. Важно, чтобы организация, куда можно сдать автомобильный АКБ, имела государственную лицензию на ведение такой деятельности.
Еще один вариант – сдача изделий в пункты приема металлолома. Основные минусы этого решения заключаются в том, что в подобных пунктах принимают АКБ на вес, поэтому клиент получит намного меньше денег. Также неизвестно, как именно будут утилизированы батареи.
Также неизвестно, как именно будут утилизированы батареи.
Неплохой вариант – сдать автомобильные аккумуляторы в специальных пунктах приема АКБ (рекламу можно видеть повсеместно в нашей стране). Это действительно неплохое решение, потому что такие предприниматели собирают с частных лиц большое количество аккумуляторов, после чего перевозят их на перерабатывающие заводы, которые и принимают такие изделия только в оптовых объемах.
Некоторые автомагазины, которые продают новые аккумуляторы, также принимают и старые АКБ. Более того, в ряде случаев клиенту будет предложена скидка на покупку новой модели при сдаче старой.
Почему нельзя выбрасывать АКБ в обычный мусор?
Многие люди не знают, куда можно сдать старый аккумулятор авто, поэтому выбрасывают его в мусор. Это категорически неправильное решение, потому что подобные изделия относятся ко второму классу опасности – при простом выбросе на свалку они наносят окружающей среде серьезный вред.
В составе автомобильных и обычных АКБ содержатся:
- Ртуть.
- Никель.
- Свинец.
- Кадмий.
- Щелочные вещества.
- Кислотные вещества.
Во время пребывания на свалке в течение нескольких лет металлическая оболочка АКБ начинает постепенно разъедаться коррозией, в результате чего тяжелые металлы, щелочи и кислоты попадают в грунт и атмосферу, просачиваются в грунтовые воды. Подсчитано, что одна маленькая батарейка способна загрязнить около 15 кв. м. грунта.
Сбор старых АКБ
Сдача аккумулятора авто на утилизацию – правильное решение современного человека. Найти место, где примут подобное изделие для переработки, можно без труда. Это можно сделать в пунктах приема металлолома либо в специализированных точках, где занимаются только приемом отработанных АКБ. В таких точках оплата выполняется по факту номинальной емкости батареи, а не по весу.
Принимают старые АКБ по той простой причине, что свинец, который используется для производства решетки аккумулятора, является дорогостоящим металлом. Повторное использование металла позволяет производителям существенно снизить свои затраты на производственный процесс, поэтому компании заинтересованы в приобретении сырья у перерабатывающих организаций, занимающихся приемом старых АКБ и их переработкой.
Повторное использование металла позволяет производителям существенно снизить свои затраты на производственный процесс, поэтому компании заинтересованы в приобретении сырья у перерабатывающих организаций, занимающихся приемом старых АКБ и их переработкой.
Технология переработки старых аккумуляторов
Основной целью утилизации автомобильных отработанных аккумуляторов является максимальное уменьшение уровня опасности б/у изделия для окружающей среды и экологии. Этого возможно достигнуть только при полноценной переработке АКБ, за счет которой от изделия остается только свинец, полимерные компоненты, серная кислота и другие металлы – всё это сырье вполне подходит для повторного использования и не выбрасывается на свалку.
Можно выделить две технологии переработки старых АКБ:
- Ручная. Подразумевает банальную разборку аккумулятора с использованием подручных средств, инструментов и физической силы. Это простой метод, во время которого из батареи сливают электролит, удаляют нагревом герметизирующую мастику, снимают верхнюю крышку, высверливают борны, перемычки, снимают крышки банок, вынимают блоки электродов и т.
 д.
д. - Автоматическая. Разборка старых АКБ в этом случае производится на перерабатывающих заводах с использованием специализированного оборудования. Процесс максимально автоматизирован, безопасен. Автоматическим образом выполняется утилизация свинцовых и других аккумуляторов, а также обычных батареек.
Переработка батареек на основе лития
Переработка батарей, сделанных на основе литий-ионной технологии, на сегодняшний день для всего мира является серьезной проблемой.
По примерным подсчетам, даже в развитых европейских странах перерабатывается не более 20% всех выбрасываемых литий-ионных батарей, что становится причиной развития высокого риска загрязнения окружающей среды.
Сфера переработке батареек на основе лития только развивается, поэтому есть перспективы того, что в скором времени и в России появятся предприятия, которые будут заниматься их утилизацией.
Как утилизировать электролит из аккумулятора?
Многие люди, у которых не получается дорого сдать свой аккумулятор, стараются утилизировать электролит из АКБ самостоятельно.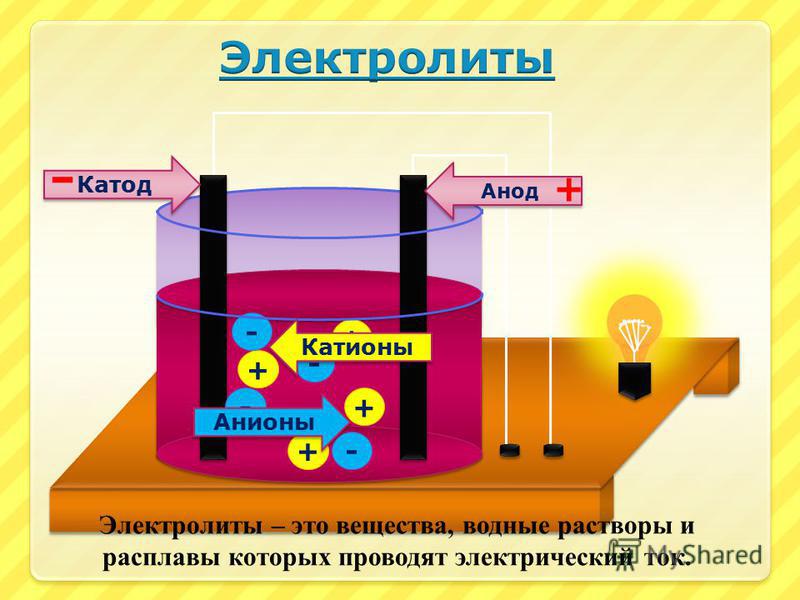 Это опасный, безосновательный подход, который ни к чему хорошему обычно не приводит.
Это опасный, безосновательный подход, который ни к чему хорошему обычно не приводит.
Можно выделить два основных пути утилизации электролита (самого распространенного сернокислотного типа):
- Предварительная нейтрализация электролита с дальнейшим сбросом жидкости в сточную канализацию.
- Регенерация электролита с последующим получением серной кислоты, пригодной для повторного использования в качестве товарного продукта.
Процессы нейтрализации электролита базируются на реакции взаимодействия сернистой кислоты со специальными нейтрализующими агентами. В качестве нейтрализующих агентов активное используются: известь, гидроксид кальция, кальцинированная сода, каустическая сода.
Вред от старой аккумуляторной батареи на свалке?
Самый простой автомобильный аккумулятор на 50-70% состоит из свинца. Остальными составляющими этого изделия являются: свинцовые соединения (в основном диоксид), серная кислота, полимерные материалы.
После того, как автомобильная АКБ оказывается на мусорном полигоне, всё это через несколько лет после выброса начинает отправлять окружающую среду, нанося экологии серьезный вред:
- Свинец является тяжелым металлом, который из всех компонентов АКБ представляет максимальную опасность.

- При проникновении в грунт он начинает накапливаться в растительности, в животных и насекомых, негативно сказываясь на их здоровье, репродуктивную функцию, жизни.
- Свинец также может накапливаться в организме человека. В основном он скапливается в костях, делая их более хрупкими.
- Если систематически вдыхать свинцовые пары или пыль, то негативное воздействие будет оказано на кровеносную и дыхательную системы, на головной мозг.
Опасны и свинцовые соединения, содержащиеся в автомобильных аккумуляторах. К примеру, сульфаты токсичны. Серная кислота из АКБ менее токсична, чем сульфаты, но при проникновении в грунт она начинает активно реагировать практически со всеми веществами, что становится причиной формирования новых, в том числе и токсичных веществ.
Отработанные автомобильные АКБ, которые были выброшены на свалку и не были должным образом утилизированы – настоящие экологические бомбы, наносящие вред экологии сейчас, и будут делать это еще не один десяток, и даже сотню лет.
Кто занимается проблемами утилизации в России?
По состоянию на 2019 год в РФ не работают специализированные заводы, которые бы занимались только утилизацией аккумуляторов автомобилей. Такой завод есть в Днепропетровске. На сегодняшний день линия полной переработки батареек действует в Челябинске. Предприятие занимается рециклингом батареек – восстановлением сырья для изготовления новых источников питания (добываются компоненты – графит, железо, марганец, сульфит цинка и т.п.).
Проблема утилизации заключается не только в отсутствии специализированных заводов, но и точек сбора отработанных батареек и АКБ, а также порядка этого сбора, регламентированного на государственном уровне.
Переработка аккумуляторных батарей (2 видео)
Электрохимический метод регенерации сернокислых отходов отработанных аккумуляторных батарей
В Украине в результате образования большого количества токсичных отходов проблема экологической безопасности крайне актуальна. Свинцово-кислотные аккумуляторы (СКА) – применяемые практически во всех видах автотранспортных средств – при выходе из строя представляют значительную угрозу окружающей среде. При обезвреживании данного вида отходов решают две основные задачи: утилизация свинецсодержащих компонентов и отработанного электролита, представляющего собой сложный сернокислый раствор. Прямой сброс кислотного электролита в окружающую среду в необработанном виде, данная тенденция, к сожалению, в настоящее время имеет широкое распространение, приводит к серьезнейшим экологическим последствиям. В частности, в наибольшей степени воздействию подвержена литосфера [1]. Величина ущерба наносимого окружающей природной среде 1тонной электролита, в зависимости от типа территории подвергаемого экодеструктивному воздействию, составляет 1399,9 – 6999.9 грн. Для Донецкой области, при условии, что в год образуется 3514,10т отработанного аккумуляторного электролита, величина эколого-экономического ущерба составляет 4,9млн.грн.
Свинцово-кислотные аккумуляторы (СКА) – применяемые практически во всех видах автотранспортных средств – при выходе из строя представляют значительную угрозу окружающей среде. При обезвреживании данного вида отходов решают две основные задачи: утилизация свинецсодержащих компонентов и отработанного электролита, представляющего собой сложный сернокислый раствор. Прямой сброс кислотного электролита в окружающую среду в необработанном виде, данная тенденция, к сожалению, в настоящее время имеет широкое распространение, приводит к серьезнейшим экологическим последствиям. В частности, в наибольшей степени воздействию подвержена литосфера [1]. Величина ущерба наносимого окружающей природной среде 1тонной электролита, в зависимости от типа территории подвергаемого экодеструктивному воздействию, составляет 1399,9 – 6999.9 грн. Для Донецкой области, при условии, что в год образуется 3514,10т отработанного аккумуляторного электролита, величина эколого-экономического ущерба составляет 4,9млн.грн. если воздействию подвержены только земли промышленности и 24,5млн.грн. – для земель сельскохозяйственного назначения.
если воздействию подвержены только земли промышленности и 24,5млн.грн. – для земель сельскохозяйственного назначения.
На сегодняшний день для предотвращения отравления окружающей среды серной кислотой отработанный электролит проходит следующие стадии регенерации: осветление, фильтрация, нейтрализация щелочными реагентами [2]. При использовании указанной схемы происходит нейтрализация аккумуляторной серной кислоты. Но при этом образуются жидкие отходы, которые содержат тяжелые металлы. А также при нейтрализации теряется дорогой продукт – серная кислота, которая могла быть повторно использована.
Цель – разработать способ регенерации электролита отработанных кислотных аккумуляторов, который мог бы стать приемлемой альтернативой используемому в настоящее время методу нейтрализации щелочными реагентами. Для регенерации использовали метод электродиализа с использованием ионообменных мембран.
На базе Академии проведены исследовательские работы по решению поставленной задачи:
- изучены закономерности поведения ионов металлов загрязняющих электролит в сернокислой среде под действием постоянного тока;
- разработан способ регенерации отработанного сернокислотного электролита, который позволяет получить товарные продукты: серную кислоту, которую можно повторно использовать при производстве новых аккумуляторных батарей, и гипс;
- проведена качественная и количественная оценка воздействия процесса регенерации (газообразных и жидких отходов, которые образуются в процессе) на окружающую среду.

Получены следующие результаты:
- в результате применения разработанного способа полностью нейтрализуется такой опасный отход как сернокислый электролит. Все выходные продукты имеют коммерческую ценность. При этом воздействие на воздушную среду незначительны: в процессе регенерации 1 тонны электролита в атмосферный воздух выбрасывается 4,3?10-6 т серной кислоты.
- по полученным экспериментальным данным, из 1 тонны отработанного электролита могут быть получены 331,25 кг(0,331т) серной кислоты, очищенной от мешающих работе аккумулятора примесей, и 26-110кг (0,026-0,110т) гипса.
Литература
1. Бобылев В.П., Матухно Е.В., Кравцов С.В., Саввин А.В. Ресурсосберегающая технология нейтрализации и утилизации отработанных электролитов аккумуляторных батарей // Вісник Харківського інституту соціального прогресу. Сер.: Екологія, техногенна безпека і соціальний прогрес. –2004. – Вип.. 1(6). – С. 121-126.
2. Положення про порядок збирання та переробки відпрацьованих свинцево-кислотних акумуляторів. Постанова Кабінету Міністрів України від 11.09.96, № 1086.
Постанова Кабінету Міністрів України від 11.09.96, № 1086.
Башевая Т.С., Сердюк А.И., Яценко А.Г. (Украина, Макеевка)
Электрохимический метод регенерации сернокислых отходов отработанных аккумуляторных батарей
МНПК “Перший Всеукраїнський з’їзд екологів”, 4-7 жовтня, 2006 р.
Вінницький національний технічний університет
Секція 1 “Техногенно-екологічна безпека України і прогнозування ризиків. Переробка та утилізація промислових і побутових відходів”.
Скачати в форматі pdf:
Заливка сырья и удаление отработанного электролита » Строительство, недвижимость, интерьер: теория и практика
При электролизе концентрация хлористого магния понижается по мере его разложения. Одновременно понижается уровень расплава вследствие удаления из электролизера продуктов электролиза.
Периодической заливкой хлористого магния или безводного карналлита достигается одновременно повышение концентрации MgCl2 и сохранение нормального уровня электролита.
 Минимально допустимое содержание MgCl2 в электролите равно 6—7%. Верхний предел содержания MgCla в рабочем электролите при хлормагниевой схеме питания ванн составляет 15%, при карналлитовой и смешанной он может быть снижен до 10—12%.
Минимально допустимое содержание MgCl2 в электролите равно 6—7%. Верхний предел содержания MgCla в рабочем электролите при хлормагниевой схеме питания ванн составляет 15%, при карналлитовой и смешанной он может быть снижен до 10—12%.Заливку обычно производят три-четыре раза в сутки. Количество заливаемого расплава определяют в зависимости от содержания хлористого магния в электролите и заливаемом продукте.
Режим заливки зависит также от применяемой схемы питания и характера сырья.
Если бы продукт из шахтных печей состоял только из хлористого магния, то частота и размер заливки его в электролизер определялись бы только уровнем электролита и содержанием MgCl2 в нем.
Технический хлористый магний содержит 80—92% MgCl2 и определенное количество хлоридов калия, натрия и кальция. Некоторая часть KCl, NaCl и CaCl2 удаляется из электролизера в виде возгона и главным образом со шламом. Однако количество вводимых с техническим хлористым магнием указанных солей превышает их расход и поэтому они накапливаются в электролите.
 Это приводит к постепенному изменению состава рабочего электролита, причем в направлении отклонения от оптимального состава. Особенно отрицательно влияет повышение концентрации CaCl2 выше 50%, при этом значительно возрастает вязкость электролита и ухудшается работа электролизера. Кроме того, уровень электролита в электролизере постепенно повышается настолько, что нехватает объема для заливки хлористого магния, хотя это необходимо делать для повышения содержания MgCl2 в электролите. Поэтому при хлормагниевой схеме питания периодически (1 раз в 2—3 месяца) освобождают часть объема ванны и затем заполняют его хлористым натрием или специально приготовленным сплавом солей с расчетом получения электролита оптимального состава. Эту операцию называют корректировкой состава электролита.
Это приводит к постепенному изменению состава рабочего электролита, причем в направлении отклонения от оптимального состава. Особенно отрицательно влияет повышение концентрации CaCl2 выше 50%, при этом значительно возрастает вязкость электролита и ухудшается работа электролизера. Кроме того, уровень электролита в электролизере постепенно повышается настолько, что нехватает объема для заливки хлористого магния, хотя это необходимо делать для повышения содержания MgCl2 в электролите. Поэтому при хлормагниевой схеме питания периодически (1 раз в 2—3 месяца) освобождают часть объема ванны и затем заполняют его хлористым натрием или специально приготовленным сплавом солей с расчетом получения электролита оптимального состава. Эту операцию называют корректировкой состава электролита.Можно путем соответствующей дозировки компонентов сухой шихты шахтных электрических печей, получать в них технический безводный хлористый магний, содержащий 2,5% CaCl2, 5% NaCl и не более 1 %; КСl.
При применении такого сырья для электролиза, состав электролита практически не изменяется и необходимость в корректировке его специальными сплавами солей отпадает.

Когда применяют расплавленный безводный карналлит, содержащий в среднем 45% MgCl2, то по указанной выше причине повышение концентрации балластных солей и заполнение ими объема ванны происходит значительно быстрее, чем при хлор магниевой схеме питания. В этом случае приходится удалять часть электролита перед каждой заливкой безводного карналлита. При этом количество заливаемого расплава на 1 т получаемого магния в два раза больше, чем при хлормагниевой схеме. Это является одним из существенных недостатков карналлитовой схемы питания электролизеров. Вследствие частого удаления отработанного электролита при карналлитовой и смешанной схемах питания допускают снижение предельной концентрации MgCl2 до 4—5%.
Расплав заливают в катодное пространство электролизера через воронку из ковша, в котором его привозят от печей Ковши перевозятся электрокарами, либо мостовыми кранами. Возможно также комбинированное транспортирование расплава, на электрокарах и с помощью мостового электрического крана.

Отработанный электролит удаляют из электролизера специальным центробежным насосом, подвешенным на мостовом кране. Можно также удалять отработанный электролит вакуум-ковшами, применяемыми для удаления металла из электролизеров. При откачке отработанного электролита необходимо следить за тем, чтобы уровень его не был ниже диафрагмы, в противном случае воздух засасывается в анодное пространство и концентрация хлора в анодном газе снижается.
Непосредственно после заливки в электролизер загружают фтористый кальций (плавиковый шпат) или фтористый натрий, в количестве 1—2% от веса загруженного расплава. Перед загрузкой в ванны фтористые соли должны быть хорошо просушены. В случае применения плавикового шпата его предварительно размалывают на молотковой дробилке и просеивают через сито с отверстиями 2 мм.
Для питания электролизеров следует применять только расплавленное сырье, нагретое до 700—720°. Загрузка застывших твердых безводного хлористого магния или карналлита разрешается только как исключение, в особых случаях.

| На главную | База 1 | База 2 | База 3 |
| Поиск по реквизитамПоиск по номеру документаПоиск по названию документаПоиск по тексту документа |
Искать все виды документовДокументы неопределённого видаISOАвиационные правилаАльбомАпелляционное определениеАТКАТК-РЭАТПЭАТРВИВМРВМУВНВНиРВНКРВНМДВНПВНПБВНТМ/МЧМ СССРВНТПВНТП/МПСВНЭВОМВПНРМВППБВРДВРДСВременное положениеВременное руководствоВременные методические рекомендацииВременные нормативыВременные рекомендацииВременные указанияВременный порядокВрТЕРВрТЕРрВрТЭСНВрТЭСНрВСНВСН АСВСН ВКВСН-АПКВСПВСТПВТУВТУ МММПВТУ НКММПВУП СНЭВУППВУТПВыпускГКИНПГКИНП (ОНТА)ГНГОСТГОСТ CEN/TRГОСТ CISPRГОСТ ENГОСТ EN ISOГОСТ EN/TSГОСТ IECГОСТ IEC/PASГОСТ IEC/TRГОСТ IEC/TSГОСТ ISOГОСТ ISO GuideГОСТ ISO/DISГОСТ ISO/HL7ГОСТ ISO/IECГОСТ ISO/IEC GuideГОСТ ISO/TRГОСТ ISO/TSГОСТ OIML RГОСТ ЕНГОСТ ИСОГОСТ ИСО/МЭКГОСТ ИСО/ТОГОСТ ИСО/ТСГОСТ МЭКГОСТ РГОСТ Р ЕНГОСТ Р ЕН ИСОГОСТ Р ИСОГОСТ Р ИСО/HL7ГОСТ Р ИСО/АСТМГОСТ Р ИСО/МЭКГОСТ Р ИСО/МЭК МФСГОСТ Р ИСО/МЭК ТОГОСТ Р ИСО/ТОГОСТ Р ИСО/ТСГОСТ Р ИСО/ТУГОСТ Р МЭКГОСТ Р МЭК/ТОГОСТ Р МЭК/ТСГОСТ ЭД1ГСНГСНрГСССДГЭСНГЭСНмГЭСНмрГЭСНмтГЭСНпГЭСНПиТЕРГЭСНПиТЕРрГЭСНрГЭСНсДИДиОРДирективное письмоДоговорДополнение к ВСНДополнение к РНиПДСЕКЕНВиРЕНВиР-ПЕНиРЕСДЗемЕТКСЖНМЗаключениеЗаконЗаконопроектЗональный типовой проектИИБТВИДИКИМИНИнструктивное письмоИнструкцияИнструкция НСАМИнформационно-методическое письмоИнформационно-технический сборникИнформационное письмоИнформацияИОТИРИСОИСО/TRИТНИТОсИТПИТСИЭСНИЭСНиЕР Республика КарелияККарта трудового процессаКарта-нарядКаталогКаталог-справочникККТКОКодексКОТКПОКСИКТКТПММ-МВИМВИМВНМВРМГСНМДМДКМДСМеждународные стандартыМетодикаМетодика НСАММетодические рекомендацииМетодические рекомендации к СПМетодические указанияМетодический документМетодическое пособиеМетодическое руководствоМИМИ БГЕИМИ УЯВИМИГКМММНМОДНМонтажные чертежиМос МУМосМРМосСанПинМППБМРМРДСМРОМРРМРТУМСанПиНМСНМСПМТМУМУ ОТ РММУКМЭКННАС ГАНБ ЖТНВННГЭАНДНДПНиТУНКНормыНормы времениНПНПБНПРМНРНРБНСПНТПНТП АПКНТП ЭППНТПДНТПСНТСНЦКРНЦСОДМОДНОЕРЖОЕРЖкрОЕРЖмОЕРЖмрОЕРЖпОЕРЖрОКОМТРМОНОНДОНКОНТПОПВОПКП АЭСОПНРМСОРДОСГиСППиНОСНОСН-АПКОСПОССПЖОССЦЖОСТОСТ 1ОСТ 2ОСТ 34ОСТ 4ОСТ 5ОСТ ВКСОСТ КЗ СНКОСТ НКЗагОСТ НКЛесОСТ НКМОСТ НКММПОСТ НКППОСТ НКПП и НКВТОСТ НКСМОСТ НКТПОСТ5ОСТНОСЭМЖОТРОТТПП ССФЖТПБПБПРВПБЭ НППБЯПВ НППВКМПВСРПГВУПереченьПиН АЭПисьмоПМГПНАЭПНД ФПНД Ф СБПНД Ф ТПНСТПОПоложениеПорядокПособиеПособие в развитие СНиППособие к ВНТППособие к ВСНПособие к МГСНПособие к МРПособие к РДПособие к РТМПособие к СНПособие к СНиППособие к СППособие к СТОПособие по применению СППостановлениеПОТ РПОЭСНрППБППБ-АСППБ-СППБВППБОППРПРПР РСКПР СМНПравилаПрактическое пособие к СППРБ АСПрейскурантПриказПротоколПСРр Калининградской областиПТБПТЭПУГПУЭПЦСНПЭУРР ГазпромР НОПРИЗР НОСТРОЙР НОСТРОЙ/НОПР РСКР СМНР-НП СРО ССКРазъяснениеРаспоряжениеРАФРБРГРДРД БГЕИРД БТРД ГМРД НИИКраностроенияРД РОСЭКРД РСКРД РТМРД СМАРД СМНРД ЭОРД-АПКРДИРДМРДМУРДПРДСРДТПРегламентРекомендацииРекомендацияРешениеРешение коллегииРКРМРМГРМДРМКРНДРНиПРПРРТОП ТЭРС ГАРСНРСТ РСФСРРСТ РСФСР ЭД1РТРТМРТПРУРуководствоРУЭСТОП ГАРЭГА РФРЭСНрСАСанитарные нормыСанитарные правилаСанПиНСборникСборник НТД к СНиПСборники ПВРСборники РСН МОСборники РСН ПНРСборники РСН ССРСборники ценСБЦПСДАСДАЭСДОССерияСЗКСНСН-РФСНиПСНиРСНККСНОРСНПСОСоглашениеСПСП АССП АЭССправочникСправочное пособие к ВСНСправочное пособие к СНиПСправочное пособие к СПСправочное пособие к ТЕРСправочное пособие к ТЕРрСРПССНССЦСТ ССФЖТСТ СЭВСТ ЦКБАСТ-НП СРОСТАСТКСТМСТНСТН ЦЭСТОСТО 030 НОСТРОЙСТО АСЧМСТО БДПСТО ВНИИСТСТО ГазпромСТО Газпром РДСТО ГГИСТО ГУ ГГИСТО ДД ХМАОСТО ДОКТОР БЕТОНСТО МАДИСТО МВИСТО МИСТО НААГСТО НАКССТО НКССТО НОПСТО НОСТРОЙСТО НОСТРОЙ/НОПСТО РЖДСТО РосГеоСТО РОСТЕХЭКСПЕРТИЗАСТО САСТО СМКСТО ФЦССТО ЦКТИСТО-ГК «Трансстрой»СТО-НСОПБСТПСТП ВНИИГСТП НИИЭССтП РМПСУПСССУРСУСНСЦНПРТВТЕТелеграммаТелетайпограммаТематическая подборкаТЕРТЕР Алтайский крайТЕР Белгородская областьТЕР Калининградской областиТЕР Карачаево-Черкесская РеспубликаТЕР Краснодарского краяТЕР Мурманская областьТЕР Новосибирской областиТЕР Орловской областиТЕР Республика ДагестанТЕР Республика КарелияТЕР Ростовской областиТЕР Самарской областиТЕР Смоленской обл. ТЕР Ямало-Ненецкий автономный округТЕР Ярославской областиТЕРмТЕРм Алтайский крайТЕРм Белгородская областьТЕРм Воронежской областиТЕРм Калининградской областиТЕРм Карачаево-Черкесская РеспубликаТЕРм Мурманская областьТЕРм Республика ДагестанТЕРм Республика КарелияТЕРм Ямало-Ненецкий автономный округТЕРмрТЕРмр Алтайский крайТЕРмр Белгородская областьТЕРмр Карачаево-Черкесская РеспубликаТЕРмр Краснодарского краяТЕРмр Республика ДагестанТЕРмр Республика КарелияТЕРмр Ямало-Ненецкий автономный округТЕРпТЕРп Алтайский крайТЕРп Белгородская областьТЕРп Калининградской областиТЕРп Карачаево-Черкесская РеспубликаТЕРп Краснодарского краяТЕРп Республика КарелияТЕРп Ямало-Ненецкий автономный округТЕРп Ярославской областиТЕРрТЕРр Алтайский крайТЕРр Белгородская областьТЕРр Калининградской областиТЕРр Карачаево-Черкесская РеспубликаТЕРр Краснодарского краяТЕРр Новосибирской областиТЕРр Омской областиТЕРр Орловской областиТЕРр Республика ДагестанТЕРр Республика КарелияТЕРр Ростовской областиТЕРр Рязанской областиТЕРр Самарской областиТЕРр Смоленской областиТЕРр Удмуртской РеспубликиТЕРр Ульяновской областиТЕРр Ямало-Ненецкий автономный округТЕРррТЕРрр Ямало-Ненецкий автономный округТЕРс Ямало-Ненецкий автономный округТЕРтр Ямало-Ненецкий автономный округТехнический каталогТехнический регламентТехнический регламент Таможенного союзаТехнический циркулярТехнологическая инструкцияТехнологическая картаТехнологические картыТехнологический регламентТИТИ РТИ РОТиповая инструкцияТиповая технологическая инструкцияТиповое положениеТиповой проектТиповые конструкцииТиповые материалы для проектированияТиповые проектные решенияТКТКБЯТМД Санкт-ПетербургТНПБТОИТОИ-РДТПТПРТРТР АВОКТР ЕАЭСТР ТСТРДТСНТСН МУТСН ПМСТСН РКТСН ЭКТСН ЭОТСНэ и ТЕРэТССЦТССЦ Алтайский крайТССЦ Белгородская областьТССЦ Воронежской областиТССЦ Карачаево-Черкесская РеспубликаТССЦ Ямало-Ненецкий автономный округТССЦпгТССЦпг Белгородская областьТСЦТСЦ Белгородская областьТСЦ Краснодарского краяТСЦ Орловской областиТСЦ Республика ДагестанТСЦ Республика КарелияТСЦ Ростовской областиТСЦ Ульяновской областиТСЦмТСЦО Ямало-Ненецкий автономный округТСЦп Калининградской областиТСЦПГ Ямало-Ненецкий автономный округТСЦэ Калининградской областиТСЭМТСЭМ Алтайский крайТСЭМ Белгородская областьТСЭМ Карачаево-Черкесская РеспубликаТСЭМ Ямало-Ненецкий автономный округТТТТКТТПТУТУ-газТУКТЭСНиЕР Воронежской областиТЭСНиЕРм Воронежской областиТЭСНиЕРрТЭСНиТЕРэУУ-СТУказУказаниеУказанияУКНУНУОУРврУРкрУРррУРСНУСНУТП БГЕИФАПФедеральный законФедеральный стандарт оценкиФЕРФЕРмФЕРмрФЕРпФЕРрФормаФорма ИГАСНФРФСНФССЦФССЦпгФСЭМФТС ЖТЦВЦенникЦИРВЦиркулярЦПИШифрЭксплуатационный циркулярЭРД ТЕР Ямало-Ненецкий автономный округТЕР Ярославской областиТЕРмТЕРм Алтайский крайТЕРм Белгородская областьТЕРм Воронежской областиТЕРм Калининградской областиТЕРм Карачаево-Черкесская РеспубликаТЕРм Мурманская областьТЕРм Республика ДагестанТЕРм Республика КарелияТЕРм Ямало-Ненецкий автономный округТЕРмрТЕРмр Алтайский крайТЕРмр Белгородская областьТЕРмр Карачаево-Черкесская РеспубликаТЕРмр Краснодарского краяТЕРмр Республика ДагестанТЕРмр Республика КарелияТЕРмр Ямало-Ненецкий автономный округТЕРпТЕРп Алтайский крайТЕРп Белгородская областьТЕРп Калининградской областиТЕРп Карачаево-Черкесская РеспубликаТЕРп Краснодарского краяТЕРп Республика КарелияТЕРп Ямало-Ненецкий автономный округТЕРп Ярославской областиТЕРрТЕРр Алтайский крайТЕРр Белгородская областьТЕРр Калининградской областиТЕРр Карачаево-Черкесская РеспубликаТЕРр Краснодарского краяТЕРр Новосибирской областиТЕРр Омской областиТЕРр Орловской областиТЕРр Республика ДагестанТЕРр Республика КарелияТЕРр Ростовской областиТЕРр Рязанской областиТЕРр Самарской областиТЕРр Смоленской областиТЕРр Удмуртской РеспубликиТЕРр Ульяновской областиТЕРр Ямало-Ненецкий автономный округТЕРррТЕРрр Ямало-Ненецкий автономный округТЕРс Ямало-Ненецкий автономный округТЕРтр Ямало-Ненецкий автономный округТехнический каталогТехнический регламентТехнический регламент Таможенного союзаТехнический циркулярТехнологическая инструкцияТехнологическая картаТехнологические картыТехнологический регламентТИТИ РТИ РОТиповая инструкцияТиповая технологическая инструкцияТиповое положениеТиповой проектТиповые конструкцииТиповые материалы для проектированияТиповые проектные решенияТКТКБЯТМД Санкт-ПетербургТНПБТОИТОИ-РДТПТПРТРТР АВОКТР ЕАЭСТР ТСТРДТСНТСН МУТСН ПМСТСН РКТСН ЭКТСН ЭОТСНэ и ТЕРэТССЦТССЦ Алтайский крайТССЦ Белгородская областьТССЦ Воронежской областиТССЦ Карачаево-Черкесская РеспубликаТССЦ Ямало-Ненецкий автономный округТССЦпгТССЦпг Белгородская областьТСЦТСЦ Белгородская областьТСЦ Краснодарского краяТСЦ Орловской областиТСЦ Республика ДагестанТСЦ Республика КарелияТСЦ Ростовской областиТСЦ Ульяновской областиТСЦмТСЦО Ямало-Ненецкий автономный округТСЦп Калининградской областиТСЦПГ Ямало-Ненецкий автономный округТСЦэ Калининградской областиТСЭМТСЭМ Алтайский крайТСЭМ Белгородская областьТСЭМ Карачаево-Черкесская РеспубликаТСЭМ Ямало-Ненецкий автономный округТТТТКТТПТУТУ-газТУКТЭСНиЕР Воронежской областиТЭСНиЕРм Воронежской областиТЭСНиЕРрТЭСНиТЕРэУУ-СТУказУказаниеУказанияУКНУНУОУРврУРкрУРррУРСНУСНУТП БГЕИФАПФедеральный законФедеральный стандарт оценкиФЕРФЕРмФЕРмрФЕРпФЕРрФормаФорма ИГАСНФРФСНФССЦФССЦпгФСЭМФТС ЖТЦВЦенникЦИРВЦиркулярЦПИШифрЭксплуатационный циркулярЭРД |
| Показать все найденныеПоказать действующиеПоказать частично действующиеПоказать не действующиеПоказать проектыПоказать документы с неизвестным статусом |
| Упорядочить по номеру документаУпорядочить по дате введения |
Регенерация — отработанный электролит — Большая Энциклопедия Нефти и Газа, статья, страница 1
Регенерация — отработанный электролит
Cтраница 1
Регенерация отработанных электролитов производится пропусканием тока сероводорода через электролит, подкисленный соляной кислотой. При прокаливании полученного осадка платина восстанавливается до металла.
[1]
При прокаливании полученного осадка платина восстанавливается до металла.
[1]
Регенерация отработанных электролитов платинирования производится путем пропускания сероводорода через электролит, подкисленный соляной кислотой. При прокаливании полученного осадка платина восстанавливается до металла. [2]
Регенерацию отработанных электролитов и извлечение платины из промывных вод производят путем пропускания сероводорода через растворы, подкисленные соляной кислотой. При прокаливании полученный осадок сернистой платины восстанавливается до металла. [3]
Регенерацию отработанных электролитов золочения осуществляют следующими способами. [4]
Для регенерации отработанного электролита с целью возвращения его в производство был применен ионообменный метод с использованием катионита КУ-2 ( 8 % дивинилбензола) и анионита АВ-17, как ионитов, наиболее устойчивых к действию окислителей. [5]
[5]
Особенно ценна регенерация отработанного электролита тем, что в результате ее удается вновь получить из карбоната металла дорогой и дефицитный едкий литий. [6]
Создание централизованных пунктов регенерации отработанных электролитов экономически целесообразно, если иметь в ввиду, что составляя всего 6 % от объема сточных вод, отработанные электролиты содержат около 70 % выносимых с ними загрязнений. [7]
Наиболее простой способ регенерации отработанного электролита заключается в следующем: в электролит помещают цинковый и стальной листы или хорошо перемешивают электролит с цинковым порошком, после чего добавляют в ванну немного едкого натра. Через 2 дня серебро оседает в порошкообразном состоянии. Этот серебряный осадок фильтруют, сушат и сплавляют вместе с селитрой и бурой. Выделившееся при этом серебро растворяется в азотной кислоте и осаждается в виде хлористого серебра. Последнее промывают в воде и сушат. Затем хлористое серебро смешивают в сосуде с разведенным раствором серной кислоты и помещают в сосуд цинковый лист.
[8]
Последнее промывают в воде и сушат. Затем хлористое серебро смешивают в сосуде с разведенным раствором серной кислоты и помещают в сосуд цинковый лист.
[8]
Какие существуют способы регенерации отработанных электролитов золочения. [9]
Ионнообменный метод — универсальный метод регенерации отработанных электролитов. Однако по техническим и экономическим соображениям его целесообразно использовать для регенерации электролитов хромирования и извлечения цветных и благородных металлов. [10]
Должен знать: устройство электролизных ванн; причины и разновидности возникновения коррозии металлов и способы предохранения от нее; особенности подготовительных и отделочных операций и их последовательность перед покрытием; материалы, применяемые в гальваностегии и их основные свойства; вредные примеси в электролитах, их влияние на гальванические осадки и способы их удаления; рецептуру изоляционных паст; нейтрализацию и регенерацию отработанных электролитов и растворов; устройство универсальных и специальных приспособлений и средней сложности контрольно-измерительных приборов и инструментов. [11]
[11]
Должен знать: устройство электролизных ванн; причины возникновения и разновидности коррозии металлов и способы предохранения от нее; особенности подготовительных и отделочных операций и их последовательность перед покрытием; материалы, применяемые в гальваностегии, и их основные свойства; вредные примеси в электролитах, их влияние на гальванические осадки и способы их удаления; рецептуру изоляционных наст; нейтрализацию и регенерацию отработанных электролитов и растворов; устройство универсальных и специальных приспособлений и средней сложности контрольно-измерительных приборов и инструментов. [12]
Должен знать: устройство электролизных ванн; причины возникновения и разновидности коррозии металлов и способы предохранения от нее; особенности подготовительных и отделочных операций и их последовательность перед покрытием; материалы, применяемые в гальваностегии, и их основные свойства; вредные примеси в электролитах, их влияние на гальванические осадки и способы их удаления; рецептуру изоляционных паст; нейтрализацию и регенерацию отработанных электролитов и растворов; устройство универсальных и специальных приспособлений и средней сложности контрольно-измерительных приборов и инструментов. [13]
[13]
ВаСОз в виде нерастворимого осадка оседает на дно р
Определение, функции, дисбаланс и источники
Электролиты участвуют во многих важных процессах в организме.
Они играют роль в проведении нервных импульсов, сокращении мышц, поддержании гидратации и регулировании уровня pH в организме (1, 2, 3, 4).
Следовательно, вам необходимо получать достаточное количество электролитов из своего рациона, чтобы ваше тело функционировало должным образом.
В этой статье подробно рассматриваются электролиты, их функции, риск дисбаланса и возможные источники.
«Электролит» — это общий термин для частиц, которые несут положительный или отрицательный электрический заряд (5).
В области питания этот термин относится к важным минералам, содержащимся в крови, поте и моче.
Когда эти минералы растворяются в жидкости, они образуют электролиты — положительные или отрицательные ионы, используемые в метаболических процессах.
К электролитам, содержащимся в вашем теле, относятся:
Эти электролиты необходимы для различных процессов организма, включая правильную работу нервов и мышц, поддержание кислотно-щелочного баланса и поддержание гидратации.
РезюмеЭлектролиты — это минералы, несущие электрический заряд. Они содержатся в крови, моче и поте и имеют жизненно важное значение для определенных процессов, которые поддерживают нормальное функционирование вашего тела.
Электролиты имеют решающее значение для поддержания функционирования нервной системы и мышц, а также для поддержания баланса внутренней среды.
Функция нервной системы
Ваш мозг посылает электрические сигналы через нервные клетки, чтобы общаться с клетками по всему телу.
Эти сигналы называются нервными импульсами, и они генерируются изменениями электрического заряда мембраны нервной клетки (6).
Изменения происходят из-за движения электролита натрия через мембрану нервной клетки.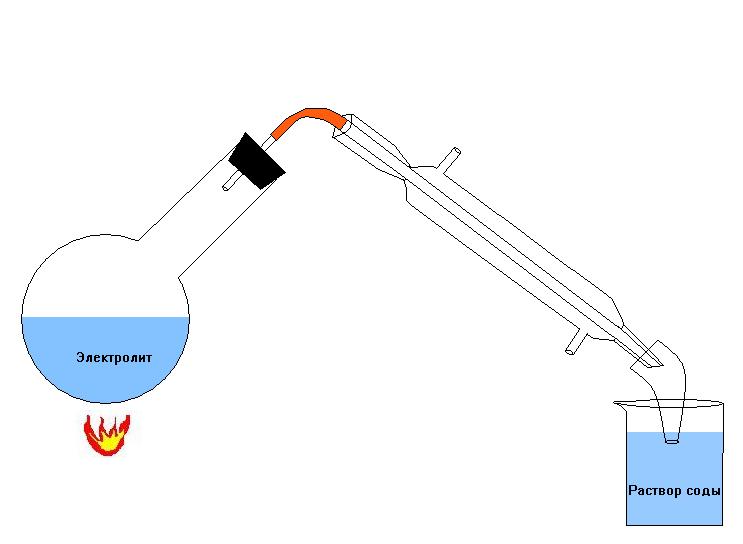
Когда это происходит, запускается цепная реакция, перемещая больше ионов натрия (и изменяя заряд) по длине аксона нервной клетки.
Функция мышц
Электролит кальция необходим для сокращения мышц (7).
Позволяет мышечным волокнам скользить вместе и перемещаться друг над другом по мере того, как мышца укорачивается и сокращается.
Магний также необходим в этом процессе, чтобы мышечные волокна могли скользить наружу, а мышцы расслаблялись после сокращения.
Правильная гидратация
Вода должна храниться в нужных количествах как внутри, так и снаружи каждой клетки вашего тела (8).
Электролиты, особенно натрий, помогают поддерживать баланс жидкости за счет осмоса.
Осмос — это процесс, при котором вода движется через стенку клеточной мембраны от разбавленного раствора (больше воды и меньше электролитов) к более концентрированному раствору (меньше воды и больше электролитов).
Это предотвращает разрушение клеток от переполнения или сморщивание из-за обезвоживания (9).
Внутренние уровни pH
Чтобы оставаться здоровым, вашему организму необходимо регулировать свой внутренний pH (10).
pH — это показатель кислотности или щелочности раствора. В вашем теле это регулируется химическими буферами или слабыми кислотами и основаниями, которые помогают минимизировать изменения во внутренней среде.
Например, ваша кровь должна поддерживать pH около 7.От 35 до 7,45. Если он отклоняется от этого, ваше тело не может функционировать должным образом, и вы заболеете.
Правильный баланс электролитов имеет основополагающее значение для поддержания уровня pH в крови (10).
РезюмеЭлектролиты необходимы для поддержания функционирования нервной системы и мышц. Они также обеспечивают оптимальную внутреннюю среду вашего тела, поддерживая гидратацию и помогая регулировать внутренний pH.
В некоторых случаях уровень электролитов в крови может стать слишком высоким или низким, вызывая дисбаланс (11, 12, 13).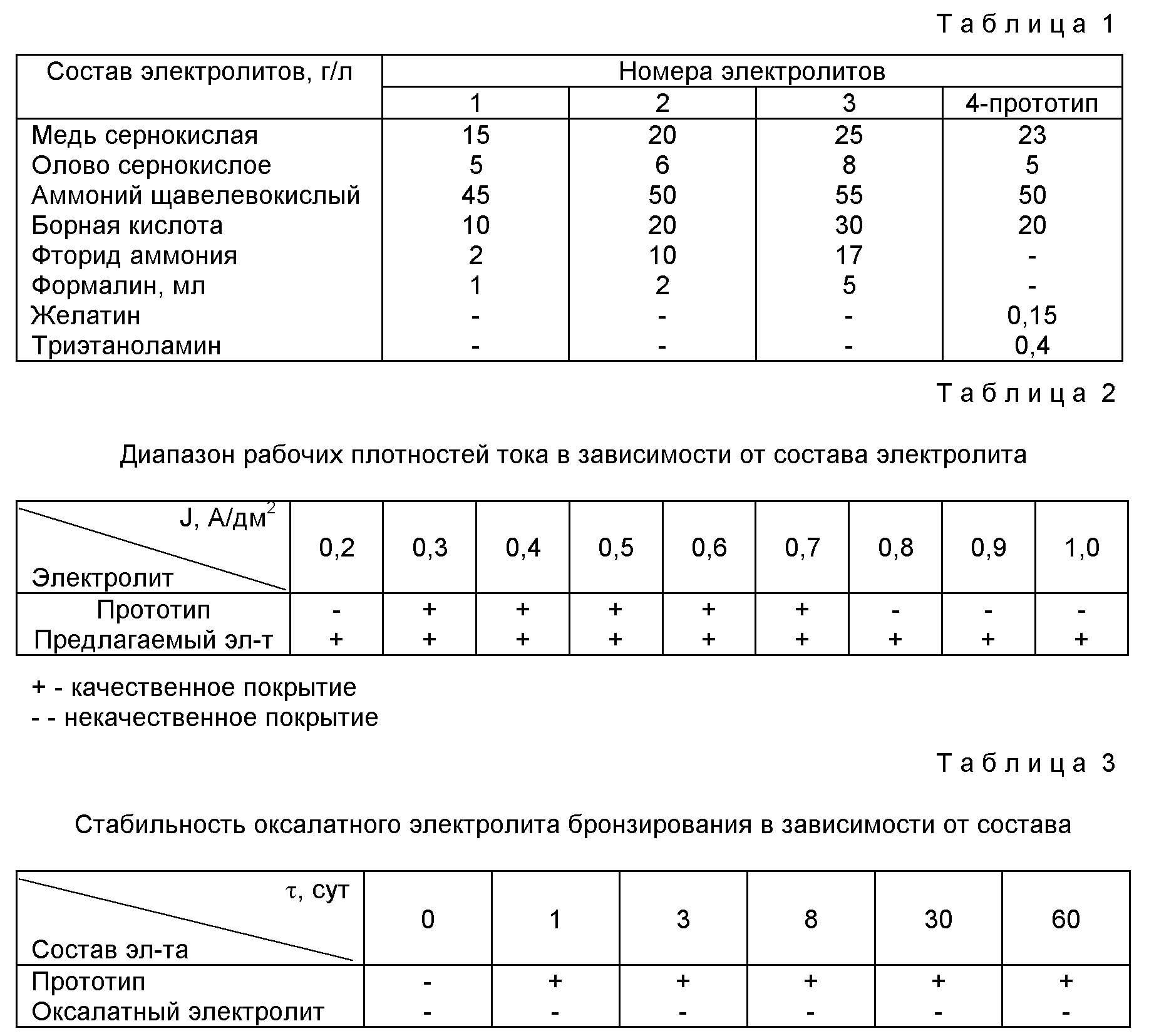
Нарушения электролитов могут нанести вред вашему здоровью, а в редких случаях даже привести к летальному исходу (14).
Нарушение баланса электролитов часто возникает из-за обезвоживания, вызванного чрезмерным нагревом, рвотой или диареей. Вот почему вы должны помнить о восполнении любых потерянных жидкостей, когда вам жарко или когда вы больны (15).
Некоторые болезни, в том числе болезни почек, расстройства пищевого поведения и травмы, такие как тяжелые ожоги, также могут вызывать нарушение электролитного баланса (16, 17, 18, 19).
Если у вас легкое нарушение электролитного баланса, у вас, вероятно, не будет никаких симптомов.
Однако более серьезные дисбалансы могут вызывать такие симптомы, как (20, 21):
- Усталость
- Быстрое или нерегулярное сердцебиение
- Онемение и покалывание
- Спутанность сознания
- Слабость и спазмы мышц
- Головные боли
- Судороги
Если вы подозреваете, что у вас дисбаланс электролитов, обязательно обсудите свои симптомы с врачом.
РезюмеНарушение баланса электролитов чаще всего возникает, когда люди сильно обезвожены из-за рвоты, диареи или чрезмерного потоотделения. Сильный дисбаланс может мешать функционированию вашего тела.
Когда вы потеете, вы теряете воду и электролиты, особенно натрий и хлорид.
В результате длительные физические нагрузки или активность, особенно в жару, могут вызвать значительную потерю электролитов.
По оценкам, пот в среднем содержит около 40–60 ммоль натрия на литр (22).
Но фактическое количество электролитов, теряемых с потом, может варьироваться от человека к человеку (23, 24).
В США максимальная рекомендуемая доза натрия составляет 2300 мг в день, что эквивалентно 6 граммам или 1 чайной ложке поваренной соли (25).
Поскольку около 90% взрослых американцев потребляют намного больше, большинству людей не нужно восполнять потерю натрия с потом (26).
Однако некоторые группы населения, такие как спортсмены на выносливость, которые тренируются более двух часов, или те, кто тренируется в условиях сильной жары, могут захотеть подумать о том, чтобы пить спортивные напитки, обогащенные электролитом, чтобы восполнить свои потери (27).
Для всех остальных достаточно получать нормальное количество натрия из пищи и питьевой воды, чтобы оставаться гидратированным.
РезюмеКогда вы потеете, вы теряете воду и электролиты, особенно натрий. Тем не менее, натрия, потребляемого с пищей, обычно достаточно, чтобы покрыть любые потери.
Лучший способ достичь и поддерживать баланс электролитов — это здоровое питание.
Основными пищевыми источниками электролитов являются фрукты и овощи.Однако в западной диете обычным источником натрия и хлоридов является поваренная соль.
Ниже приведены некоторые продукты, содержащие электролиты (28, 29, 30):
- Натрий: Маринованные продукты, сыр и поваренная соль.
- Хлорид: Поваренная соль.
- Калий: Фрукты и овощи, такие как бананы, авокадо и сладкий картофель.
- Магний: Семена и орехи.
- Кальций: Молочные продукты, витаминизированные заменители молока и зеленые листовые овощи.

Электролиты, такие как бикарбонат, вырабатываются естественным путем в организме, поэтому вам не нужно беспокоиться о том, чтобы включить их в свой рацион.
РезюмеЭлектролиты содержатся во многих продуктах питания, включая фрукты, овощи, молочные продукты, орехи и семена.
Некоторые люди пьют воду с электролитом или добавляют электролиты, такие как натрий и кальций, чтобы обеспечить их достаточное количество.
Однако сбалансированной диеты, включающей источники электролитов, должно хватить для большинства.
Ваше тело обычно может эффективно регулировать электролиты и поддерживать их на нужном уровне.
Но в некоторых случаях, например, во время приступов рвоты и диареи, когда потери электролитов чрезмерны, может оказаться полезным добавление раствора для регидратации, содержащего электролиты (31).
Сумма, которую вам нужно будет израсходовать, будет зависеть от ваших потерь. Всегда читайте инструкции по замене без рецепта.
Также обратите внимание, что если у вас не низкий уровень электролитов из-за чрезмерных потерь, то прием добавок может вызвать аномальный уровень и, возможно, болезнь (32).
Перед добавлением электролитов лучше проконсультироваться с врачом или фармацевтом.
РезюмеЕсли вы придерживаетесь сбалансированной диеты, содержащей хорошие источники электролитов, добавление добавок обычно не требуется.
Электролиты — это минералы, которые несут электрический заряд при растворении в воде.
Они жизненно важны для вашей нервной системы, мышц и поддержания оптимальной среды тела.
Большинство людей удовлетворяют свои потребности в электролитах с помощью сбалансированной диеты, хотя может возникнуть дисбаланс, если вы обезвожены из-за болезни или чрезмерного тепла.
Если вы подозреваете, что у вас нарушение баланса электролитов, поговорите со своим врачом.
Симптомы, причины, типы и лечение
Понимание нарушений электролитного баланса
Электролиты — это элементы и соединения, которые естественным образом встречаются в организме. Они контролируют важные физиологические функции.
Они контролируют важные физиологические функции.
Примеры электролитов:
Эти вещества присутствуют в вашей крови, биологических жидкостях и моче. Они также попадают в организм с едой, напитками и добавками.
Электролитное нарушение возникает, когда уровень электролитов в вашем теле слишком высок или слишком низок. Для правильного функционирования вашего тела необходимо поддерживать равномерный баланс электролитов. В противном случае могут пострадать жизненно важные системы организма.
Сильный дисбаланс электролитов может вызвать серьезные проблемы, такие как кома, судороги и остановка сердца.
Легкие формы электролитных нарушений могут не вызывать никаких симптомов. Такие нарушения могут оставаться незамеченными, пока они не будут обнаружены во время обычного анализа крови.Симптомы обычно начинают появляться, когда конкретное расстройство становится более серьезным.
Не все электролитные дисбалансы вызывают одни и те же симптомы, но многие имеют схожие симптомы.
Общие симптомы электролитного нарушения включают:
Немедленно позвоните своему врачу, если вы испытываете какой-либо из этих симптомов и подозреваете, что у вас может быть нарушение электролитного баланса. Нарушения электролитного баланса могут стать опасными для жизни, если их не лечить.
Электролитные нарушения чаще всего вызываются потерей жидкостей организма в результате продолжительной рвоты, диареи или потоотделения.Они также могут развиться из-за потери жидкости, связанной с ожогами.
Некоторые лекарства также могут вызывать нарушение электролитного баланса. В некоторых случаях виноваты основные заболевания, например острые или хронические заболевания почек.
Точная причина может варьироваться в зависимости от конкретного типа нарушения электролита.
Повышенный уровень электролита обозначается префиксом «гипер-». Истощенный уровень электролита обозначается как «гипо».
Состояния, вызванные дисбалансом уровня электролитов, включают:
Кальций
Кальций — жизненно важный минерал, который ваше тело использует для стабилизации кровяного давления и контроля сокращения скелетных мышц. Он также используется для укрепления костей и зубов.
Он также используется для укрепления костей и зубов.
Гиперкальциемия возникает, когда в крови слишком много кальция. Обычно это вызвано следующими причинами:
Гипокальциемия возникает из-за недостатка кальция в кровотоке. Возможные причины:
Хлорид
Хлорид необходим для поддержания надлежащего баланса жидкостей организма.
Гиперхлоремия возникает, когда в организме слишком много хлоридов. Это может произойти в результате:
Гипохлоремия развивается, когда в организме слишком мало хлоридов.Часто это вызвано проблемами с натрием или калием.
Другие причины могут включать:
Магний
Магний — важный минерал, регулирующий многие важные функции, такие как:
- сокращение мышц
- сердечный ритм
- нервная функция
Гипермагниемия означает избыточное количество магния. Это заболевание в первую очередь поражает людей с болезнью Аддисона и терминальной стадией болезни почек.
Гипомагниемия означает, что в организме слишком мало магния. Общие причины включают:
Общие причины включают:
Фосфат
Почки, кости и кишечник работают, чтобы сбалансировать уровень фосфатов в организме. Фосфат необходим для множества функций и тесно взаимодействует с кальцием.
Гиперфосфатемия может возникать из-за:
- низкого уровня кальция
- хронической болезни почек
- тяжелого затруднения дыхания
- недостаточной активности паращитовидных желез
- тяжелой мышечной травмы
- синдрома лизиса опухоли, осложнения лечения рака
- чрезмерного использования фосфатсодержащие слабительные
Низкий уровень фосфатов или гипофосфатемия можно увидеть в:
Калий
Калий особенно важен для регуляции функции сердца.Это также помогает поддерживать здоровье нервов и мышц.
Гиперкалиемия может развиться из-за высокого уровня калия. Это состояние может быть фатальным, если его не диагностировать и не лечить. Обычно это вызвано:
Гипокалиемия возникает, когда уровень калия слишком низкий. Это часто происходит в результате:
Это часто происходит в результате:
- расстройств пищевого поведения
- сильной рвоты или диареи
- обезвоживания
- определенных лекарств, включая слабительные, диуретики и кортикостероиды
натрия
Натрий необходим организму для поддержания баланса жидкости и имеет решающее значение для нормального функционирования организма.Это также помогает регулировать функцию нервов и сокращение мышц.
Гипернатриемия возникает, когда в крови слишком много натрия. Аномально высокий уровень натрия может быть вызван:
- недостаточным потреблением воды
- сильным обезвоживанием
- чрезмерной потерей жидкости организма в результате продолжительной рвоты, диареи, потоотделения или респираторного заболевания
- некоторыми лекарствами, включая кортикостероиды
Гипонатриемия развивается при недостатке натрия.К распространенным причинам низкого уровня натрия относятся:
Простой анализ крови может определить уровень электролитов в вашем организме.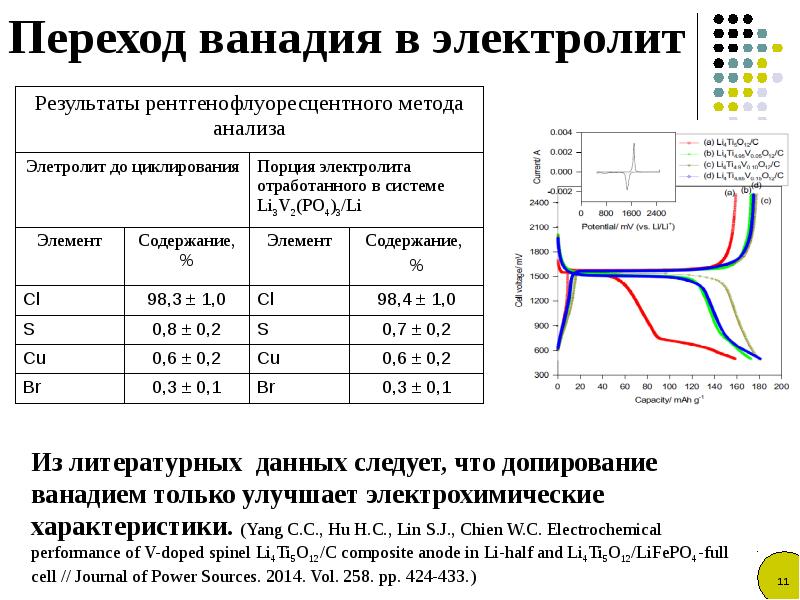 Также важен анализ крови, позволяющий оценить функцию почек.
Также важен анализ крови, позволяющий оценить функцию почек.
Ваш врач может захотеть провести медицинский осмотр или назначить дополнительные анализы для подтверждения подозреваемого нарушения электролитного баланса. Эти дополнительные тесты будут отличаться в зависимости от рассматриваемого состояния.
Например, гипернатриемия (слишком много натрия) может вызвать потерю эластичности кожи из-за значительного обезвоживания.Ваш врач может провести щипковый тест, чтобы определить, влияет ли на вас обезвоживание.
Они могут также проверить ваши рефлексы, поскольку повышенный и истощенный уровень некоторых электролитов может влиять на рефлексы.
Электрокардиограмма (ЭКГ или ЭКГ), электрическая запись вашего сердца, также может быть полезна для проверки любых нерегулярных сердечных сокращений, ритмов или изменений ЭКГ или ЭКГ, вызванных проблемами с электролитами.
Лечение различается в зависимости от типа нарушения электролитного баланса и основного состояния, которое его вызывает.
Как правило, используются определенные процедуры для восстановления правильного баланса минералов в организме. К ним относятся:
Внутривенные (IV) жидкости
Внутривенные (IV) жидкости, обычно хлорид натрия, могут помочь регидратировать организм. Это лечение обычно используется в случаях обезвоживания в результате рвоты или диареи. Добавки электролитов могут быть добавлены к жидкостям для внутривенного вливания для устранения недостатков.
Некоторые препараты для внутривенного введения
Препараты для внутривенного введения могут помочь вашему организму быстро восстановить электролитный баланс.Они также могут защитить вас от негативных последствий, пока вы лечитесь другим методом.
Прием лекарств будет зависеть от вашего электролитного нарушения. Лекарства, которые можно вводить, включают глюконат кальция, хлорид магния и хлорид калия.
Пероральные препараты и добавки
Пероральные препараты и добавки часто используются для коррекции хронических минеральных аномалий в организме. Это чаще встречается, если вам поставили диагноз продолжающееся заболевание почек.
Это чаще встречается, если вам поставили диагноз продолжающееся заболевание почек.
В зависимости от вашего электролитного нарушения вы можете получать лекарства или добавки, такие как:
- кальция (глюконат, карбонат, цитрат или лактат)
- оксид магния
- хлорид калия
- фосфат-связывающие вещества, которые включают гидрохлорид севеламера (Ренагель) , лантан (фосренол) и препараты на основе кальция, такие как карбонат кальция
Они могут помочь восполнить обедненные электролиты на краткосрочной или долгосрочной основе, в зависимости от основной причины вашего заболевания.Как только дисбаланс будет исправлен, ваш врач устранит основную причину.
Хотя некоторые добавки можно купить без рецепта, большинство людей с нарушениями электролитного баланса получают рецепт на добавки от своего врача.
Гемодиализ
Гемодиализ — это вид диализа, при котором для удаления отходов из крови используется аппарат.
Один из способов заставить кровь течь к этой искусственной почке — это хирургическим путем создать сосудистый доступ или точку входа в ваши кровеносные сосуды.
Эта точка входа позволит большему количеству крови проходить через ваше тело во время процедуры гемодиализа. Это означает, что можно фильтровать и очищать больше крови.
Гемодиализ можно использовать, когда нарушение электролитного баланса вызвано внезапным повреждением почек и другие методы лечения не работают. Ваш врач также может принять решение о лечении гемодиализом, если проблема с электролитами стала опасной для жизни.
Нарушение электролитного баланса может развиться у любого человека. Некоторые люди подвергаются повышенному риску из-за их истории болезни.Условия, которые увеличивают риск нарушения электролитного баланса, включают:
Следуйте этим советам, чтобы предотвратить нарушения электролита:
- оставайтесь гидратированными, если вы испытываете длительную рвоту, диарею или потливость
- Обратитесь к врачу, если у вас обычное Симптомы нарушения электролитного баланса
Если нарушение электролитного баланса вызвано лекарствами или сопутствующими заболеваниями, врач скорректирует прием лекарств и устранит причину. Это поможет предотвратить будущий дисбаланс электролитов.
Это поможет предотвратить будущий дисбаланс электролитов.
8.2 Электролиты и неэлектролиты — скачать онлайн-видео на ppt
Презентация на тему: «8.2 Электролиты и неэлектролиты» — стенограмма презентации:
1 8.2 Электролиты и неэлектролиты
Общая, органическая и биологическая химия, четвертое издание Карен Тимберлейк Глава 8 Растворы 8.2 Лекции по электролитам и неэлектролитам © 2013 Pearson Education, Inc.
2 Электролиты, неэлектролиты
В воде сильные электролиты разделяются на ионы, образуя растворы, проводящие электричество. слабые электролиты производят несколько ионов. неэлектролиты производят молекулы, а не ионы.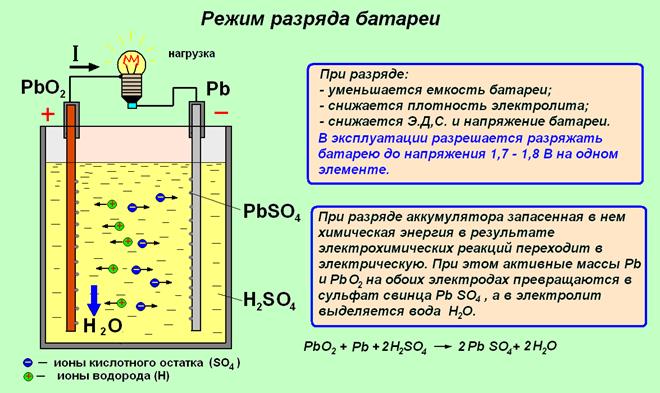
3 Сильные электролиты Растворенные вещества, являющиеся сильными электролитами
, диссоциируют на 100% или распадаются на положительные и отрицательные ионы в воде.при растворении в воде образуют водный раствор (водный раствор), который проводит электрический ток. h3O% ионы NaCl (т.) Na + (водн.) + Cl (водн.) h3O CaBr2 (т.) Ca2 + (водн.) + 2Br (водн.)
4 Learning Check Заполните каждое из следующих уравнений для сильных электролитов
, растворяющихся в воде.
5
Решение Завершите каждое из следующих уравнений для сильных электролитов
, растворяющихся в воде.
6 Слабые электролиты Растворенные вещества, являющиеся слабыми электролитами
, растворяются в воде в основном в виде молекул. растворяются в воде с образованием нескольких ионов. производят растворы, слабо проводящие электричество.
растворяются в воде с образованием нескольких ионов. производят растворы, слабо проводящие электричество.
7 Неэлектролиты Растворенные вещества, не являющиеся электролитами
, растворяются в воде в виде молекул.не производят ионы в воде. образуют растворы, не проводящие электрический ток.
9
Эквиваленты Эквивалент (уравнение) — это количество этого иона, равное 1
моль положительного или отрицательного электрического заряда (+ или -). Например, каждый 1 моль ионов Na + и 1 моль ионов Cl- составляет 1 эквивалент или 1000 миллиэквивалентов (мЭкв), потому что каждый из них содержит 1 моль заряда, а ионы с зарядом 2+ или 2- содержат 2 эквивалента для каждая родинка.1 моль Na + = 1 уравнение 1 моль Ca2 + = 2 уравнение 1 моль S2− = 2 уравнение
11 Электролиты в жидкостях организма
Электролиты играют важную роль в поддержании надлежащего функционирования клеток и органов в организме.


 д.
д.


